
III к. - Атомная и ядерная физика / Лекции / Глава4
.docСложение моментов импульса. Типы связей электронных моментов в атоме.
-
Состояния атома, состоящего из N электронов, описываются
волновой функцией
![]() .
Эта функция удовлетворяет уравнению
Шредингера с оператором Гамильтона
.
Эта функция удовлетворяет уравнению
Шредингера с оператором Гамильтона

Здесь
 – энергия взаимодействия
i – го электрона с
ядром,
находящегося на
расстоянии –
– энергия взаимодействия
i – го электрона с
ядром,
находящегося на
расстоянии –
![]() – энергия
электростатического взаимодействия
между электронами. Энергия взаимодействия
между электронами гораздо слабее
взаимодействия каждого электрона с
ядром, поэтому в нулевом приближении
электростатическим взаимодействием
между электронами можно пренебречь.
Тогда все электроны можно считать
независимыми, так что каждый из них
описывается сохраняющимся орбитальным
моментом
– энергия
электростатического взаимодействия
между электронами. Энергия взаимодействия
между электронами гораздо слабее
взаимодействия каждого электрона с
ядром, поэтому в нулевом приближении
электростатическим взаимодействием
между электронами можно пренебречь.
Тогда все электроны можно считать
независимыми, так что каждый из них
описывается сохраняющимся орбитальным
моментом
![]() .
Это значит, что сохраняется со временем
длина каждого вектора
.
Это значит, что сохраняется со временем
длина каждого вектора
![]() и его проекция на ось Z.
Полный (суммарный) вектор орбитального
момента импульса также является
сохраняющейся величиной:
и его проекция на ось Z.
Полный (суммарный) вектор орбитального
момента импульса также является
сохраняющейся величиной:
![]()
Наличие кулоновского взаимодействия
между электронами приводит к тому, что
векторы
![]() ,
не сохраняются, но полный момент
орбитального движения является
сохраняющейся величиной, т.к. система
изолирована. Это значит, что оператор
полного орбитального момента импульса
коммутирует с оператором Гамильтона.
В этом случае не изменяется длина
каждого вектора
,
не сохраняются, но полный момент
орбитального движения является
сохраняющейся величиной, т.к. система
изолирована. Это значит, что оператор
полного орбитального момента импульса
коммутирует с оператором Гамильтона.
В этом случае не изменяется длина
каждого вектора
![]() ,
которая определяется орбитальным
квантовым числом li
:
,
которая определяется орбитальным
квантовым числом li
: ![]()
Сохранение длин векторов
![]() означает, что каждый из
них прецессирует вокруг направления
вектора
означает, что каждый из
них прецессирует вокруг направления
вектора
![]() .
Сам же вектор полного орбитального
момента импульса характеризуется
длиной, которая определяется квантовым
числом L:
.
Сам же вектор полного орбитального
момента импульса характеризуется
длиной, которая определяется квантовым
числом L:
![]()
а также проекцией на ось Z:
![]()
Здесь mL - магнитное квантовое число, пробегающее 2L+1 значение:
mL = L, L-1,…-(L-1), -L
Отметим, что поскольку энергия взаимодействия электронов с ядром и друг с другом имеют разные знаки, то учет кулоновского взаимодействия между электронами приводит к сдвигу уровней энергии "вверх", т.е. к уменьшению энергии по абсолютной величине.
Далее рассмотрим систему
двух электронов, состояния
которых
характеризуется квантовыми
числами l1,
m1
и
l2
, m2.
При заданных числах
l1,l2
числа m1,m2
пробегают по 2l1+1
и 2l2+1
значений,
соответственно, т.е. имеется всего
(2l1+1)(2l2+1)
различных состояний.
Эти состояния описываются волновыми
функциями
![]() При учете слабого
кулоновского взаимодействия между
электронами их
состояния описываются
волновыми функциями
При учете слабого
кулоновского взаимодействия между
электронами их
состояния описываются
волновыми функциями
![]() Естественно,
что этих состояний
при заданных числах
l1,l2
по
- прежнему должно
быть
(2l1+1)(2l2+1),
т.е. столько пар значений может пробегать
пара чисел
L,mL.
Определим эти значения. По определению
оператор полного орбитального момента
импульса равен
Естественно,
что этих состояний
при заданных числах
l1,l2
по
- прежнему должно
быть
(2l1+1)(2l2+1),
т.е. столько пар значений может пробегать
пара чисел
L,mL.
Определим эти значения. По определению
оператор полного орбитального момента
импульса равен
![]() .
Отсюда
.
Отсюда
![]() .
Следовательно,
mL=
m1
+ m2.
Это равенство определяет также соотношение
между наибольшими значениями магнитных
квантовых чисел
.
Следовательно,
mL=
m1
+ m2.
Это равенство определяет также соотношение
между наибольшими значениями магнитных
квантовых чисел
![]() .
Так как максимальное значение магнитного
квантового числа равно соответствующему
орбитальному квантовому числу, то
получаем, что
.
Так как максимальное значение магнитного
квантового числа равно соответствующему
орбитальному квантовому числу, то
получаем, что
![]() .
Вспомним далее, что квантовые числа
m1,m2
изменяются на единицу, так что и число
mL
может изменяться на единицу. Так
как l1+
l2
это максимальное значение числа mL,
то следующее его
значение должно
быть mL=
l1
+ l2
- 1.
Такому значению числа mL
отвечает два состояния: либо
m1=
l1,
m2=
l2
– 1, либо
m1=
l1
- 1,
m2=
l2.
.
Вспомним далее, что квантовые числа
m1,m2
изменяются на единицу, так что и число
mL
может изменяться на единицу. Так
как l1+
l2
это максимальное значение числа mL,
то следующее его
значение должно
быть mL=
l1
+ l2
- 1.
Такому значению числа mL
отвечает два состояния: либо
m1=
l1,
m2=
l2
– 1, либо
m1=
l1
- 1,
m2=
l2.
Отсюда следует, что эти два состояния характеризуются числами L= l1 + l2 (при этом mL= L - 1) и L= l1 + l2 - 1 (при этом mL= L). При уменьшении значения mL еще на единицу имеем три состояния:
m1= l1, m2= l2 - 2; m1= l1 - 1 и m2= l2 - 1; m1= l1 - 2 , m2= l2 .
Это значит, что число L может принимать значения L= l1 + l2 , l1 + l2 – 1, l1 + l2 - 2. Эти рассуждения можно продолжить и придти к выводу, что минимальное значение числа Lmin = l1 + l2 (при l1 > l2). Таким образом, при заданных числах l1,l2 число L пробегает значения:
L= l1 + l2 , l1 + l2 – 1, …, |l1 - l2|.
Этих значений всего 2l2 + 1 (при l1 > l2) или 2l1 + 1 (при l2 > l1). Нетрудно убедиться, что полное число состояний, отвечающих данным числам l1 , l2 , равно (2l1+1)(2l2+1):

Формула определяет правило сложения моментов. Это правило было найдено еще до построения квантовой механики. Если нужно сложить три и более моментов импульса, то можно пользоваться правилом с помощью его повторного применения. Это правило является универсальным. Оно не зависит от природы момента импульса. Например, сложение орбитального и спинового моментов является частным случаем правила .
Определим четность состояний
многоэлектронного атома. Четность
состояний одноэлектронного атома
определяется орбитальным квантовым
числом как (-1)l
. Так как взаимодействие электронов
друг с другом является достаточно
слабым, то их можно считать независимыми.
Тогда волновая функция системы электронов
в центрально-симметричном поле ядра
разбивается на произведение волновых
функций отдельных электронов. Это
значит, что четность состояний всей
системы равна произведению
![]() .
.
2.Учтем теперь спин электронов.
В этом случае каждый из элект- ронов
обладает своим орбитальным моментом
![]() и спиновым моментом
и спиновым моментом
![]() .
Тогда потенциальная
энергия системы электронов складывается
не только из энергии
взаимодействия каждого из электронов
с ядром и друг с другом, но также из
спин-орбитального и спин-спинового
взаимодей-
ствия. Последние
взаимодействия связывают с соответствующими
то-
ками. Одновременный учет всех
типов взаимодействий практически
не-
возможен. Из экспериментальных
данных следует, что часто электроста-
тическое
взаимодействие между электронами
гораздо сильнее спин-орби-
тального
и спин-спинового взаимодействия, так
что в нулевом прибли-
жении ими
можно пренебречь. Средняя энергия
электростатического
взаимодействия
электронов, находящихся в поле ядра с
зарядом Zl,
равная
.
Тогда потенциальная
энергия системы электронов складывается
не только из энергии
взаимодействия каждого из электронов
с ядром и друг с другом, но также из
спин-орбитального и спин-спинового
взаимодей-
ствия. Последние
взаимодействия связывают с соответствующими
то-
ками. Одновременный учет всех
типов взаимодействий практически
не-
возможен. Из экспериментальных
данных следует, что часто электроста-
тическое
взаимодействие между электронами
гораздо сильнее спин-орби-
тального
и спин-спинового взаимодействия, так
что в нулевом прибли-
жении ими
можно пренебречь. Средняя энергия
электростатического
взаимодействия
электронов, находящихся в поле ядра с
зарядом Zl,
равная
![]() ,
примерно пропорциональна
Z. Энергия спин-
,
примерно пропорциональна
Z. Энергия спин-
орбитального взаимодействия пропорциональна Z4. Таким образом, пренебрежение спин-орбитальным взаимодействием оправдано для достаточно легких элементов, а для тяжелых элементов преобладающим становится спин-орбитальное взаимодействие, которое превосходит спин-спиновое взаимодействие. При пренебрежении спин-орбитальным взаимодействием орбитальный и спиновый моменты каждого электрона складываются по отдельности, образуя полный орбитальный момент и полный спиновый момент
![]()
При учете слабого взаимодействия
между спинами полный спин сохраняется,
при этом векторы спина отдельных
электронов прецессируют вокруг
направления вектора
![]() .
Сохранение полного спина означает, что
оператор полного спина коммутирует с
оператором Гамильтона.
.
Сохранение полного спина означает, что
оператор полного спина коммутирует с
оператором Гамильтона.
Полный момент импульса всех
электронов
![]() является суммой полного орбитального
и полного спинового моментов:
является суммой полного орбитального
и полного спинового моментов:
![]()
Такой тип сложения моментов отвечает нормальной связи, или связи Рассела – Саундерса (B. Russel, E.A. Saunders, 1904)
Этот тип связи моментов
называют также LS
связью. Для замкнутой
системы вектор полного момента импульса
![]() сохраняется, т.е. оператор полного
момента импульса коммутирует с
гамильтонианом. Векторы же
сохраняется, т.е. оператор полного
момента импульса коммутирует с
гамильтонианом. Векторы же
![]() и
и
![]() изменяются из-за спин-орбитального
взаимодействия. Однако величины этих
векторов и их проекции на направление
полного момента имеют определенные
значения. Это
значит, что векторы
изменяются из-за спин-орбитального
взаимодействия. Однако величины этих
векторов и их проекции на направление
полного момента имеют определенные
значения. Это
значит, что векторы
![]() и
и
![]() прецессируют вокруг направления
вектора
прецессируют вокруг направления
вектора
![]() (
рис. 1).
(
рис. 1).
Р и с. 1
Когда спин-орбитальное
взаимодействие для отдельного электрона
оказывается более сильным, чем
взаимодействие между моментами разных
электронов, то складываются орбитальный
и спиновый моменты для каждого электрона
и образуется его полный момент импульса:
![]() .
Полный момент
импульса всех электронов является
векторной суммой полных моментов
отдельных электронов:
.
Полный момент
импульса всех электронов является
векторной суммой полных моментов
отдельных электронов:
![]() .
.
Векторы, не сохраняются
Р и с. 2
Они прецессируют вокруг направления вектора полного момента импульса (рис. 2). Такой тип сложения моментов отвечает j - j связи. В чистом виде этот тип связи моментов встречается редко. Часто реализуются другие, более сложные типы связей электронных моментов. Наиболее распространенным среди атомов периодической системы элементов является нормальный тип связи. Рассмотрим его подробнее.
3. Квантовые векторы моментов характеризуются соответствующими квантовыми числами. Полному орбитальному моменту согласно отвечает квантовое число L, возможные значения которого определяются правилом . Величина (длина) вектора полного спина определяется квантовым числом полного спина S :
![]()
при этом магнитное спиновое квантовое число mS, принимает 2S+1 значение:
mS=S,…,0,…-S.
Квантовое число
J
полного момента импульса определяет
величину (длину) вектора
![]() :
:
![]()
Проекция полного момента на ось Z имеет квантованные значения JZ=ћmJ. Магнитное квантовое число mJ пробегает 2J +1 значение:
mJ=J,…,0,…-J.![]()
Квантовое число J определяется на основании если Известны числа L,S:
J=L+S, L+S-1,…,|L-S|
Отсюда видно, что число J принимает 2S +1 значение; если L ≥ S , или 2L +1 значение, если L ≤ S. Сами квантовые числа L, S определяются в соответствии с правилом сложения . Отметим, что все числа L, S, J по своему смыслу являются неотрицательными.
Определим возможные значения
квантового числа полного спина.
В
случае двух электронов имеем:![]() .
По правилу сложения моментов получаем,
что число S
принимает значения:
.
По правилу сложения моментов получаем,
что число S
принимает значения:
S=s1+ s2 ,…,|s1 – s2 | . Так как спиновое квантовое число для каждого электрона s1+ s2 равно 1/2, то квантовое число полного спина принимает два значения, соответственно при противоположной и параллельной ориентации спинов:
![]()
В случае трех электронов получаем также два значения полного спинового числа:
![]()
В случае четырех электронов полный спин имеет три значения:

Вспомним теперь обозначение состояний электрона в атоме водорода. Аналогичные обозначения принимают для электронных состояний других атомов. Состоянию с данным значением числа приписывают соответствующую букву, только не строчную, а прописную:
Значение L 0 1 2 3 4 5 6 7 8 9 10
Состояние S P D F G H I K L M N
Уровни энергии, определяемые
заданными значениями чисел L
и
S
называются
спектральными термами,
или просто термами.
К терму
LS
относятся
(2L + 1)(2S
+ 1) состояний,
которые различаются значениями проекций
орбитального и спинового моментов на
ось Z.
Учет спина и релятивистских эффектов
приводит к расщеплению терма LS
на ряд компонент, соответствующих
значениям полного момента
J.
Это тонкое, или мультиплетное
расщепление. В этом
случае справа от буквы, обозначающей
состояние, внизу пишут значение числа
J,
а
слева вверху – мультиплетность
2S + 1,
т.е. общее число значений,
которое
принимает квантовое число
J
(при L ≥ S).
Таким образом,
состояние обозначается
как
![]() .
Например, символ
.
Например, символ
![]() означает,
что числа
L = 1, J =
1, S = 1. Читают так:
"триплет P
- единица".
означает,
что числа
L = 1, J =
1, S = 1. Читают так:
"триплет P
- единица".
При L ≤ S число компонент равно 2L + 1. Таким образом, энергия атома определяется числами L, J, S и не зависит от квантового числа mJ, принимающего 2J + 1 значение. Это значит, что каждый уровень энергии имеет кратность вырождения 2J + 1, при этом при заданных числах L, S имеется, как и должно быть, (2L + 1) (2S + 1) разлиичных состояний:
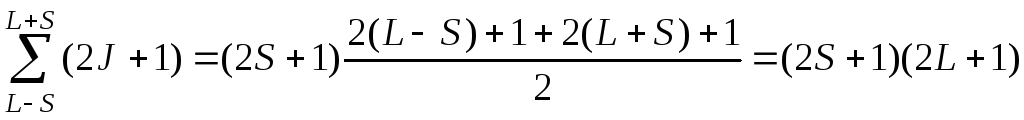
В обозначениях состояний
отмечают также их четность: если состояние
нечетно, то
справа вверху добавляют индекс 0
(0dd
- нечетный). Например,
![]() .
Четное
состояние обычно никак не отмечают.
.
Четное
состояние обычно никак не отмечают.
Мультиплетность состояний (и термов) определяется спиновым квантовым числом как 2S + 1 (при L ≥ S ). Возможные значения числа S зависят от количества электронов согласно - .
В случае одного электрона термы являются дублетами. В случае двух электронов число S = 0 или 1. Тогда мультиплетность равна: 2·0+1=1
или 2·1+1=3. Состояния с мультиплетностью 1 называют синглетами, а с мультиплетностью 3 - триплетами. В случае трех электронов число S=1/2 или 3/2. Тогда состояния являются дублетами и квартетами. В случае четырех электронов S=0,1,2. Состояния атомов являются синглетами, триплетами и квинтетами. Аналогично определяется мультиплетность в случае большого числа электронов.
4. Возможные радиационные переходы между различными состояниями атома LSJmJ → L’S’J’m’J определяются правилами отбора. При излучении или поглощении фотона в системе "атом+фотон" выполняется закон сохранения момента импульса:
![]()
где
![]() - собственный механический момент
импульса (спин) фотона.
- собственный механический момент
импульса (спин) фотона.
Отсюда в дипольном приближении следуют правила отбора для квантового числа J:
∆J = 0, ±1.
При ∆J
= 0 происходит
поворот вектора
![]() без
изменения его величины (см.рис. 3в).
Когда одно из квантовых чисел
без
изменения его величины (см.рис. 3в).
Когда одно из квантовых чисел
![]() или
или
![]() обращается в нуль, то треугольники на
рис. 3 вырождаются в два равных отрезка
прямых, направленных в одну сторону или
противоположно. Равенство нулю и другого
квантового числа, очевидно, невозможно,
поскольку это нарушает закон сохранения
момента импульса. Говорят, что по
квантовому числу J
переход
обращается в нуль, то треугольники на
рис. 3 вырождаются в два равных отрезка
прямых, направленных в одну сторону или
противоположно. Равенство нулю и другого
квантового числа, очевидно, невозможно,
поскольку это нарушает закон сохранения
момента импульса. Говорят, что по
квантовому числу J
переход
![]() строго запрещен
(A. Lande, 1921).
строго запрещен
(A. Lande, 1921).
Р и с.3
Чтобы учесть запрещение таких переходов, правило дополняют условием: J + J’ ≥ 1.
Запишем теперь закон
сохранения момента импульса в другой
форме:
![]() Отсюда следует, что момент импульса,
уносимый (или
приносимый)
фотоном, складывается из изменений
орбитального и спинового моментов
атома. Эти изменения определяются
характером взаимодействия электронов
с фотоном. Эксперименты и расчеты
показывают, что по крайней мере в
оптическом диапазоне м и при дипольном
излучении (или поглощении) фотона, не
происходит изменения числа электронов
в атоме, а также ориентации их спинов,
т.е. полный спин электронов атома не
изменяется. Это значит, что для спинового
квантового числа существует правило
отбора:
Отсюда следует, что момент импульса,
уносимый (или
приносимый)
фотоном, складывается из изменений
орбитального и спинового моментов
атома. Эти изменения определяются
характером взаимодействия электронов
с фотоном. Эксперименты и расчеты
показывают, что по крайней мере в
оптическом диапазоне м и при дипольном
излучении (или поглощении) фотона, не
происходит изменения числа электронов
в атоме, а также ориентации их спинов,
т.е. полный спин электронов атома не
изменяется. Это значит, что для спинового
квантового числа существует правило
отбора:
∆S = 0
Поскольку число S определяет мультиплетность термов (и состояний), то правило означает, что переходы между состояниями с различной мультиплетностью запрещены. Это так называемый принцип запрета интеркомбинаций. Отметим, что этот принцип не является абсолютно жестким – в спектрах атомов наблюдаются его нарушения. Из закона сохранения момента импульса и правила следуют также правила отбора для квантового числа L:
ΔL=0,±1
при этом 0 – 0 переходы запрещены, т.е. L + L’ ≥ 1. Отметим, что переходы без изменения орбитального квантового числа совершенно невозможны для водородоподобных атомов и для атомов с одним электроном сверх заполненных оболочек. Этот запрет вытекает из закона сохранения четности волновых функций одно электронных состояний атомов
Электронные оболочки атомов.
Физическое объяснение периодической системы элементов Менделеева
1. Атом водорода является простейшим из атомов. Он содержит в себе только один электрон, находящийся в основном состоянии 1s. Возникает вопрос: каким образом располагаются электроны в других атомах, как распределение электронного заряда в атомах отражается в их свойствах? Почему при монотонном изменении заряда ядра атомов происходит периодическое изменение их химических и физических свойств? Эти вопросы неразрывно связаны с построением периодической системы Элементов Д.И. Менделеева (1869 г.). Первую физическую интерпретацию этой системы с использованием химических и спектроскопических данных и квантовой теории водородоподобного атома дал Н. Бор в 1922 г. Последовательное объяснение электронного строения атомов стало возможным лишь после открытия спина электрона и принципа Паули. Этот принцип исключает возможность стягивания всех атомных электронов в состояние с минимальной энергией.
При физическом рассмотрении периодической системы исходят из того, что при пренебрежении спин-орбитальным взаимодействием состояния электрона в атоме описываются четверкой квантовых чисел n,l,ml,ms. По принципу Паули, в состояниях с этой фиксированной четверкой чисел может находиться только один электрон. В состояниях с фиксированной тройкой чисел n,l,ml может находиться два электрона. Состояниям с фиксированными числами n,l отвечают 2(2l+1) электронов. Совокупность одноэлектронных состояний с фиксиро-ванными значениями чисел n,l называют электронной оболочкой атома. Электроны с одинаковыми значениями квантовых чисел n,l называются эквивалентными. Очевидно, что число электронов в оболочке не зависит от значения главного квантового числа. Например, в р – оболочке максимальное число электронов равно 2(2·1+1)=6. Нахождение нескольких электронов в оболочке принято обозначать в виде показателя степени.
