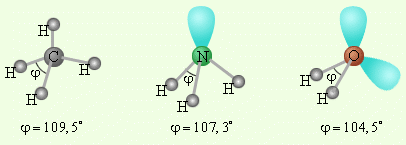- •Строение вещества
- •Методические указания для самостоятельной работы
- •Студентов всех специальностей и проведения
- •Практических занятий по химии
- •1 Строение атома
- •1.1 Современные представления о строении атома
- •1.2 Строение электронной оболочки атома
- •1.2.2 Принципы заполнения атомных орбиталей.
- •1.3 Электронные формулы элементов
- •1.4 Электронные семейства элементов
- •1.5 Атомная валентная зона. Возможные валентные состояния
- •1.6 Проскок (провал) электронов
- •2 Периодическая система элементов
- •2.1 Периодический закон
- •2.2 Современная структура Периодической таблицы Менделеева
- •2.3 Периодичность атомных характеристик
- •3 Химическая связь
- •3.1 Основные характеристики химической связи
- •3.3 Типы химических связей
- •3.4 Геометрия молекул. Гибридизация атомных орбиталей
- •3.5 Химическая связь в твердых телах. Кристаллические решетки
- •4 Вопросы и задания
3.4 Геометрия молекул. Гибридизация атомных орбиталей
Гибридизация орбиталей – это выравнивание формы и энергии некоторых орбиталей при образовании ковалентной связи. Гибридные орбитали представляют собой линейную комбинацию АО и обладают определенной ориентацией в пространстве (симметрией).
Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие:
1) гибридные орбитали обладают более высокой энергией, чем исходные атомные, зато они обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей и, соответственно, дают больший выигрыш в энергии при образовании связи;
2) число гибридных орбиталей равно числу АО, участвующих в гибридизации;
3) гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты;
4) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
Если валентная оболочка атома включает электроны на одной s-орбитали и одной p-орбитали, имеет место sp-гибридизация. Рассмотрим её на примере молекулы BeCl2.
Э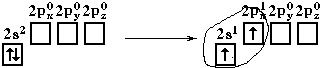 лектронная
конфигурация валентной оболочки бериллия
2s2.
Для реакции с двумя атомами хлора
необходим переход электронов бериллия
в возбужденное состояние.
лектронная
конфигурация валентной оболочки бериллия
2s2.
Для реакции с двумя атомами хлора
необходим переход электронов бериллия
в возбужденное состояние.
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2px-электрона бериллия, то связи Be-Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180° за счёт того, что одна s– орбиталь и одна p– орбиталь “смешиваются” и выравниваются по форме и энергии, давая две одинаковые sp– гибридные орбитали (рисунок 13).

Рисунок
13 - sp-гибридизация валентных орбиталей
бериллия
Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия отталкиваются и лежат на одной прямой и благодаря этому молекула BeCl2 имеет линейную форму, а обе связи Be-Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы: HC≡CH, MgН2 и т. д.
Е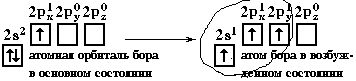
 сли
валентная оболочка атома включает
электроны на однойs-орбитали
и двух
p-орбиталях,
то наблюдается sp2-гибридизация,
которая даёт несколько иную геометрию
молекулы. Примером может служить
sp2-гибридизация
бора при образовании молекулы BF3
(рисунок 14). Три sp2-гибридные
орбитали лежат в одной плоскости под
углом 120°. Они располагаются как можно
дальше друг от друга и молекула имеет
форму плоского треугольника.
сли
валентная оболочка атома включает
электроны на однойs-орбитали
и двух
p-орбиталях,
то наблюдается sp2-гибридизация,
которая даёт несколько иную геометрию
молекулы. Примером может служить
sp2-гибридизация
бора при образовании молекулы BF3
(рисунок 14). Три sp2-гибридные
орбитали лежат в одной плоскости под
углом 120°. Они располагаются как можно
дальше друг от друга и молекула имеет
форму плоского треугольника.
Рисунок
14 - sp2-гибридизация
валентных орбиталей бора
Такую же форму будут иметь и молекулы BH3, H2C=CH2, C6H6 и т. д.
Н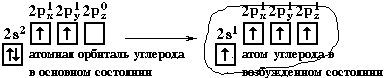 аконец,
когда смешиваютсяодна
s-
и три
p-орбитали,
возникают sp3-гибридизованные
молекулы, имеющие геометрию тетраэдра
(рисунок 15).
аконец,
когда смешиваютсяодна
s-
и три
p-орбитали,
возникают sp3-гибридизованные
молекулы, имеющие геометрию тетраэдра
(рисунок 15).
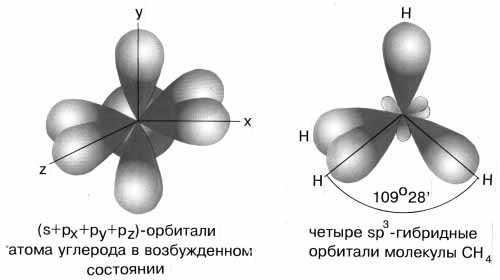
Рисунок
15 - sp3-гибридизация
валентных орбиталей углерода
Примером может служить соединение углерода с водородом СН4 (метан). В стационарном состоянии углерод двухвалентен, а для образования связи с водородом необходимо четыре свободных электрона. Они появляются при распаривании s-электронов. В результате образуется четыре гибридных орбитали, которые расположатся максимально далеко друг от друга только тогда, когда молекула примет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28'.
Такой же тип гибридизации будет характерен для молекул CCl4, H3C–CH3.
Все вышеописанные молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими или неподеленными электронными парами.
|
|
|
Рисунок 16 - Несвязывающие электронные пары и углы связи в молекулах NH3 и H2O в сравнении с молекулой CH4 |
Объясняется это тем, что электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательность периферийных атомов, то есть неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга.
Поэтому реально этот тетраэдр в молекулах NH3 и H2O слегка искажен, потому что реальный угол составляет не 109о, а 107,3о и 104,5о соответственно.
При образовании иона аммония NH4+ по донорно-акцепторному механизму неподелённая электронная пара азота занимает свободную атомную орбиталь протона водорода и угол в ионе увеличивается до 109°28'.
Аналогичное явление наблюдается при образовании иона аксония Н3О+, но угол увеличивается до 107,3о, поскольку только одна из двух неподелённых пар находит себе свободную орбиталь. А вот в ледяной воде угол увеличивается до109°28', поскольку ещё одна неподелённая пара электронов оказывается вовлечённой в водородную связь.