
- •Строение вещества
- •Методические указания для самостоятельной работы
- •Студентов всех специальностей и проведения
- •Практических занятий по химии
- •1 Строение атома
- •1.1 Современные представления о строении атома
- •1.2 Строение электронной оболочки атома
- •1.2.2 Принципы заполнения атомных орбиталей.
- •1.3 Электронные формулы элементов
- •1.4 Электронные семейства элементов
- •1.5 Атомная валентная зона. Возможные валентные состояния
- •1.6 Проскок (провал) электронов
- •2 Периодическая система элементов
- •2.1 Периодический закон
- •2.2 Современная структура Периодической таблицы Менделеева
- •2.3 Периодичность атомных характеристик
- •3 Химическая связь
- •3.1 Основные характеристики химической связи
- •3.3 Типы химических связей
- •3.4 Геометрия молекул. Гибридизация атомных орбиталей
- •3.5 Химическая связь в твердых телах. Кристаллические решетки
- •4 Вопросы и задания
3 Химическая связь
Химическая связь – это взаимодействие двух атомов, осуществляемое в процессе перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая восьми– или двухэлектронная конфигурация ближайшего благородного газа (октет или дублет) за счет образования ионов (В.Коссель) или образования общих электронных пар (Г.Льюис). Общая энергия системы при этом понижается.
3.1 Основные характеристики химической связи
3.1.1 Энергия связи – это энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества, или выигрыш в энергии при образовании соединения из отдельных атомов (Eсв). Чем больше энергия химической связи, тем прочнее сама связь, тем устойчивее молекула.
Обычно энергию связи измеряют в килоджоулях на моль, кДж/моль.
кДж/моль. Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Так, на разрыв связи H–H затрачивается 432,1 кДж/∙моль, а на атомизацию метана CH4 – 1648 кДж/∙моль, в этом случае EC–H = 1648: 4 = 412 кДж.
Наиболее прочными являются ионные и ковалентные связи, энергии которых составляют величины от десятков до сотен кДж/моль. Металлическая связь, как правило, несколько слабее ионных и ковалентных связей, но величины энергий связи в металлах близки к значениям энергии ионных и ковалентных связей. Энергия водородной связи очень небольшая и составляет обычно величину 20-40 кДж/моль, тогда как энергия ковалентных связей может достигать несколько сотен килоджоулей на моль, кДж/моль.
3.1.2 Длина связи lсв. При образовании химической связи происходит перекрывание электронных облаков двух атомов и расстояние между ядрами атомов становится меньше суммы расстояний от ядер до внешних зон наибольшей электронной плотности в атомах.
Длина связи равна расстоянию между ядрами взаимодействующих атомов в соединении. Измеряется в нанометрах, нм, или ангстремах, А (1А = 10-8 см). Она зависит от размеров электронных оболочек и степени их перекрывания. Имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и соответственно устойчивость молекул к распаду или воздействию других веществ.
3.1.3 Полярность связи характеризуется ионной составляющей, то есть смещением электронной пары к более электроотрицательному атому, в результате чего образуется диполь. Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя μ=e ∙ l. Дипольный момент измеряется в кулонах на метр, Кл∙м, или в дебаях, D.
1D = 0,333∙10–29 Кл∙м. Он является величиной векторной и направлен по оси диполя от отрицательного заряда к положительному.
Полярность молекулы в целом определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Она выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
Следует различать дипольные моменты (полярность) связи и молекулы в целом. Например, для линейной молекулы CO2 μ = 0 (хотя каждая из связей полярна, а молекула в целом неполярна, так как молекула О=С=О линейна, и дипольные моменты связей С=О компенсируют друг друга), но для Н2О μ ≠ 0. Наличие дипольного момента в молекуле воды означает, что она нелинейна, т. е. связи О—Н расположены под углом, не равным 180°.
3.1.4 Пространственное строение молекул – это форма и расположение в пространстве электронных облаков с учётом природы химической связи.
В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.
3.1.5 Порядок связи (кратность связи) – это число обобществленных поделенных пар между двумя связанными атомами. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь. Порядок связи выше трех не встречается. Например, порядок связи в молекулах H2, O2 и N2 равен 1, 2 и 3 соответственно, поскольку связь в этих случаях образуется за счёт перекрывания одной, двух и трех пар электронных облаков.
3.1.6 Насыщаемость связи – способность атома давать определённое количество химических связей. Некоторые виды химического взаимодействия не обладают насыщаемостью, то есть частицы могут образовывать различное число связей со своими соседями. Такое свойство присуще ионной связи.
3.1.7 Способ перекрывания электронных облаков. По способу перекрывания электронных облаков связь делят на σ - связь и π – связь (рисунок 4).
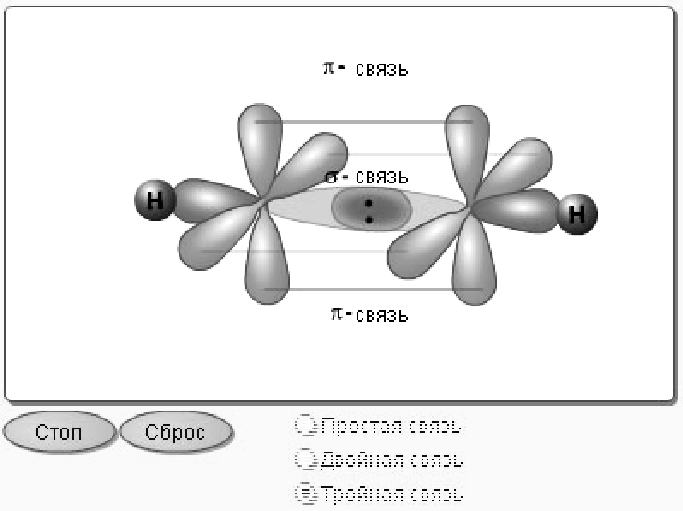
Рисунок
4 – Схема σ - и π - связи
σ – связь образуется за счёт перекрывания электронных облаков по линии, соединяющей центры взаимо–действующих атомов. Она может осуществляться, например, между двумя s– облаками, между двумя p– облаками, между s– и p– облаками или между s– и d– облаками. π – связь образуется за счёт перекрывания электронных облаков по обе стороны от линии, соединяющей центры взаимодействующих атомов (за счёт бокового перекрывания электронных облаков). Она образуется в основном при перекрывании р– орбиталей. σ – связь является более прочной, чем π – связь, поскольку обеспечивает более полное перекрывание и поэтому на её разрыв требуется затратить больше энергии.
Теории, объясняющие химическую связь
В настоящее время используется две теории: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
3.2.1 Метод валентных связей иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что при образовании молекулы атомы сохраняют свои атомные орбитали, но зато образуется повышенная электронная плотность (общая электронная пара), которая принадлежит обоим атомам. В отличие от ММО, в котором простейшая химическая связь может быть как двух–, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая.
Отметим, что электроны в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны (поскольку магнитные свойства обуславливаются наличием свободных электронов). Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
3.2.2 Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. То есть, при образовании молекулы атомные орбитали как таковые исчезают, а вместо них возникают новые молекулярные орбитали. Причём число молекулярных орбиталей равно сумме исходных атомных, но часть молекулярных орбиталей по энергии ниже (связывающие МО), а часть по энергии выше (разрыхляющие МО), чем исходные атомные.
Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО. Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым. А так как в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO может быть переобозначена как σсв и σ* и названа соответственно связывающей (σсв) и разрыхляющей (σ*) молекулярными орбиталями.
Переход двух электронов на МО σсв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H–H. То есть заселение электронами связывающей МО σсв стабилизирует систему, а заселение разрыхляющих – дестабилизирует ее.
Согласно методу МО порядок (кратность) связи n определяется полуразностью числа связывающих Nсв и разрыхляющих Nраз электронов
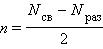
Чем больше кратность связи, тем более прочная связь в молекуле. При нулевой кратности связи молекула не образуется.
Рассмотрим некоторые случаи строения молекул по ММО.
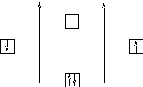
Молекула Н2 образуется из двух атомов Н, атомная валентная зона которого представлена одним электроном на 1s– подуровне. При чём необходимо, чтобы электроны имели противоположные спины. Изобразим строение молекулы Н2 на следующей энергетической диаграмме (рисунок 5). При заполнении этой диаграммы следует учитывать принципы заполнения электронных орбиталей (принцип Паули, принцип Гунда, принцип минимальной энергии).
|
AO |
МО (Н2) σ* |
E AO |
|
Н
1s1 |
|
H
1s1 |
|
|
σсв |
|
|
Рисунок 5 – Энергетическая схема образования молекулы Н2 | ||
Поскольку в первую очередь заполняются орбитали с меньшей энергией, то электроны пойдут на связывающую орбиталь. А так как по принципу Паули их там может поместиться только два, то электронов для разрыхляющей орбитали уже не остаётся. Кратность связи в этом случае будет равна
n = (2-0)/2 = 1, то есть связь осуществляется одной парой электронов.
Что касается молекулярного иона Н2+, то он образуется из атома Н и протона Н+, у которого нет валентного электрона (рисунок 6).
Кратность связи в этом случае будет равна n = (1-0)/2 = 1/2, то есть связь осуществляется одним электроном. Такое явление МВС объяснить не может.
Аналогичную структуру будет иметь и молекулярный ион Н2–, который образуется из атома Н и атомарного иона Н–, который имеет один лишний валентный электрон (два электрона идут на связывающую орбиталь, а один– на разрыхляющую). Кратность связи в этом случае будет равна n = (2-1)/2 = 1/2, то есть связь так же осуществляется одним электроном. Из всего вышесказанного следует, что более прочной будет молекула Н2 по сравнению с молекулярными ионами, поскольку она характеризуется большей кратностью связи; а сами молекулярные ионы Н2+ и Н2– по прочности абсолютно одинаковы.
|
AO |
МО (Н2+) σ* |
E AO |
|
Н+
1s0 |
|
H
1s1 |
|
|
σсв |
|
|
Рисунок 6 – Энергетическая схема образования молекулярного иона Н2+ | ||
С помощью ММО можно объяснить отсутствие молекул благородных газов. Рассмотрим это на примере молекулы He2, которая должна была бы образовываться из двух атомов Не с АВЗ 1s2 (рисунок 7).
|
AO |
МО (Не2) σ* |
E AO |
|
Не
1s2 |
|
He
1s2 |
|
|
σсв |
|
|
Рисунок 7 – Энергетическая схема образования молекулы Не2 | ||
В этом случае кратность связи будет равна n = (2-2)/2 = 0, то есть связь не осуществляется, поскольку нет общей электронной пары и нет выигрыша в энергии. А при таких условиях молекула не образуется.
За водородом и гелием идут элементы, имеющие более сложное строение электронной оболочки, следовательно, молекулы, образуемые этими веществами, будут иметь соответствующее строение.
Рассмотрим это на примере молекулы О2 (рисунок 8). Она образуется из двух атомов кислорода с АВЗ 2s22р4. Поскольку s– орбитали обладают меньше энергией, чем р– , то на энергетической диаграмме они будут располагаться ниже. Обратите ещё раз внимание на то, что валентные электроны различных атомов имеют антипараллельные спины. Поскольку каждый из атомов предоставляет по одной s- орбитали и по три р– орбитали, то общее количество молекулярных орбиталей будет равно восьми. Из двух атомных s– орбиталей образуются две молекулярные: σs– связывающая и σs– разрыхляющая (так как перекрывание электронных облаков происходит по линии, соединяющей центры атомов).
Из шести р– орбиталей образуется три связывающие и три разрыхляющие орбитали. В силу того, что одна пара электронных облаков перекрывается по линии, соединяющей центры атомов, между ними образуются σр– связывающая и σр– разрыхляющая молекулярные орбитали. Между оставшимися двумя парами р– орбиталей будет наблюдаться боковое перекрывание, поэтому образуются две р- связывающие орбитали, одинаковые по энергии, и две р– разрыхляющие, так же одинаковые по энергии. На энергетической диаграмме σр– связывающая орбиталь расположена ниже р– связывающих, так как при образовании σ– связи выделяется больше энергии, следовательно сама связь будет обладать меньшим запасом энергии. Заполнение диаграммы электронами (12 электронов у обоих атомов) происходит по мере увеличения энергии молекулярных орбиталей (снизу вверх). На разрыхляющих орбиталях два электрона находятся в разных ячейках, так как в этом случае суммарный спин системы будет максимальным. Кратность связи в этом случае будет равна n = (8-4)/2 = 2, то есть связь так же осуществляется двумя парами электронов.
|
|
Е |
|
МО |
|
Е |
|
|
АО |
|
|
О2 |
|
|
АО |
|
О |
|
σ*р |
|
|
|
О |
|
2р4 |
π*р |
|
|
|
π*р |
2р4 |
|
|
|
|
|
|
|
|
|
|
πсвр |
|
|
|
πсвр |
|
|
|
|
σсвр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
σ*s |
|
|
|
|
|
2s2 |
|
|
|
|
|
2s2 |
|
|
|
σсвs |
|
|
|
|
|
Рисунок 8 – Энергетическая схема образования молекулы О2 | ||||||
Строение молекулярного иона О2+ или О22+ будет отличаться отсутствием одного или двух электронов соответственно на разрыхляющих орбиталях. Кратность связи при этом будет повышаться (n = (8-3) / 2 = 2,5 и n = (8-2) / 2 = 3) и прочность ионов по сравнению с прочностью молекулы О2 будет увеличиваться. То есть удаление электрона со связывающей орбитали уменьшает энергию связи в молекулярном ионе, а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе в сравнении с молекулой.
ММО позволяет объяснить существование электронодефицитных соединения (B2H6, NO) и соединений благородных газов; магнетизм и окраску вещества; устойчивость молекулярных ионов и атомов в сравнении с молекулами.

 E
E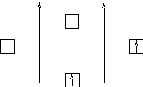 E
E Е
Е