
- •Із принципу Ле Шательє - Брауна випливає:
- •а) у разі збільшення концентрації однієї з реагуючих речовин рівновага зміщується у бік витрачання цієї речовини, а в разі зменшення концентрації – у бік її утворення;
- •в) під час підвищення температури рівновага зміщується у бік перебігу ендотермічної реакції, під час зниження температури – екзотермічної реакції.
- •Чинники, що впливають на швидкість хімічної реакції:
- •Загальна характеристика галогенів
- •Методи синтезу гідрогенгалогенідів
Na2O *CaO *6SiO2 + 28HF(газ) = 2NaF + СaF2 + 6SiF4 + 14H2O, Na2O.*CaO *6SiO2 + 36HF(р-н) = Na2SiF6 + CaSiF6 + 4H2SiF6 + 14H2O.
Тому під час роботи з ними використовують посуд, виготовлений із тефлону.
Відновні властивості гідрогенгалогенідів. Із зростанням розмірів і зменшенням енергії іонізації атома галогену відновна зданість у ряді HF–HCl–HBr–HI зростає. Наприклад, плавикова HF і соляна HCl кислоти з концентрованою сірчаною кислотою не взаємодіють, а HBr та HI нею окиснюються:
2HBr + H2SO4(конц) = Br2 + SO2 + 2H2O,
8HI + H2SO4(конц) = 4I2 + H2S + 4H2O.
Методи синтезу гідрогенгалогенідів
Відомі три основні методи синтезу галогеноводнів.
1. Прямий синтез із елементів. Фтор і хлор реагують з воднем із вибухом, що свідчить про ланцюговий механізм реакції. Однак при певних співвідношеннях тисків водню (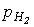 ) і
) і
хлору (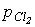 ) водень згоряє в атмосфері хлору без вибуху. Згоряння хлору з воднем є основним промисловим способом отримання HCl. Бром і йод реагують з воднем більш спокійно, однак вихід невеликий, оскільки рівновага Н2 + Х2 = 2НХ (Х = Br, I) зміщена ліворуч.
) водень згоряє в атмосфері хлору без вибуху. Згоряння хлору з воднем є основним промисловим способом отримання HCl. Бром і йод реагують з воднем більш спокійно, однак вихід невеликий, оскільки рівновага Н2 + Х2 = 2НХ (Х = Br, I) зміщена ліворуч.
2. Витіснення із солей. Газоподібні НХ виділяються під дією нелетких сильних кислот на тверді іонні галогеніди металів (на практиці використовують 70–85%-й розчин сульфатної кислоти, оскільки реакція відбувається на поверхні кристалів солі). Якщо брати концентровану кислоту, осаджується NaHSO4. У разі використання розбавленої сульфатної кислоти значна частина HCl залишається в розчині. Хлороводень, що виділився, просушують над концентрованою сульфатною кислотою. P4O10 для цього не використовують, оскільки він взаємодіє з HCl:
P4O10 + 12HCl = 4POCl3 + 6H2O;
CaF2 + H2SO4(конц) = CaSO4  + 2HF
+ 2HF  ;
;
NaCl + H2SO4(конц) = NaHSO4 + HCl  .
.
У процесі одержання HBr і HI, що мають сильні відновні властивості, використовують нелеткі кислоти-неокисники, наприклад H3РO4:
KX + H3РO4(конц) 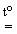 KH2РO4 + HX
KH2РO4 + HX , X = Cl, Br, I.
, X = Cl, Br, I.
3.ОРГАНІЧНА ХІМІЯ
ЗМ 3.1. Теоретичні основи органічної хімії
Вуглеводні – це органічні сполуки, молекули яких складаються з атомів двох елементів: Карбону та Гідрогену. Від вуглеводнів походять різноманітні класи органічних сполук. Вуглеводні можуть відрізнятись між собою за будовою Карбонового ланцюга. Завдяки здатності атомів Карбону утворювати цикли і ланцюги різних розмірів і форм, а також різні типи хімічного зв’язку можливе існування величезної кількості вуглеводнів. Вуглеводні
різних типів відрізняються між собою ступенем насиченості їх атомами Гідрогену. А тому атоми Карбону, утворюючи ланцюг, можуть зв’язуватись між собою за допомогою простих (одинарних), подвійних або потрійних зв’язків.
Залежно від хімічної будови і пов’язаних із цим властивостей вуглеводні поділяють на групи, або ряди, головними серед яких є насичені вуглеводні, ненасичені та ароматичні вуглеводні.
Насиченими називають вуглеводні з відкритим (незамкненим) Карбоновим ланцюгом, загальна формула яких CnH2n + 2. У цих вуглеводнів усі чотири валентності атома Карбону максимально насичені атомами Гідрогену. Тому такі вуглеводні називають насиченими.
Відповідно до сучасної номенклатури насичені вуглеводні називають алканами. Молекули алканів містять лише прості (одинарні) σ- зв’язки між атомами та вступають лише у реакції заміщення. Вони не знебарвлюють розчин калій перманганату KMnO4, бромну воду, не окиснюються розчинами кислот і лугів, не вступають у реакції приєднання.
Ненасиченими називають вуглеводні з подвійними і потрійними зв’язками між атомами Карбону у молекулах. У цих вуглеводнів не всі валентності атома Карбону максимально насичені атомами Гідрогену. Тому такі вуглеводні називають ненасиченими.
Залежно від кількості та характеру кратних зв’язків ненасичені вуглеводні класифікують на такі ряди: етиленові (алкени) – CnH2n, дієнові (алкадієни) – CnH2n-2, ацетиленові (алкіни) –
CnH2n-2.
Молекули етиленових вуглеводнів містять один подвійний або σ-, π-зв’язки. Молекули дієнових вуглеводнів містять два подвійних зв’язки. А молекули ацетиленових вуглеводнів містять один потрійний зв’язок.
Для ненасичених вуглеводнів характерні реакції приєднання. Вони можуть приєднувати водень (гідрування), хлор, бром тощо (галогенування), гідроген галогени HCl, HBr, воду (це реакція гідратації). Також вони вступають у реакції полімеризації, знебарвлюють розчин калій перманганату, бромну воду, окиснюються розчинами кислот і лугів.
Ароматичними називають вуглеводні циклічної (замкненої) будови, загальна формула яких CnH2n-6. У молекулах ароматичних вуглеводнів немає простих і подвійних зв’язків. Електронна густина розподілена рівномірно, а тому всі зв’язки між атомами Карбону у молекулі рівні. Найточніше це відображає структурна формула у вигляді правильного шестикутника з колом усередині. Це формула найпростішого представника класу аренів
(ароматичних вуглеводнів) бензену: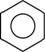 .
.
Для ароматичних вуглеводнів характерні й реакції заміщення (легше вступають), і реакції приєднання.
Ізомери – це речовини, які мають однаковий якісний і кількісний склад молекул, але різну будову, а тому різні фізичні та хімічні властивості.
Розрізняють кілька видів ізомерії:
1)Ізомерія Карбонового ланцюга. Наприклад, нормальний бутан CH3–CH2–CH2–CH3 має нерозгалужену будову молекули, а його ізомер 2-метилпропан має розгалужену будову.
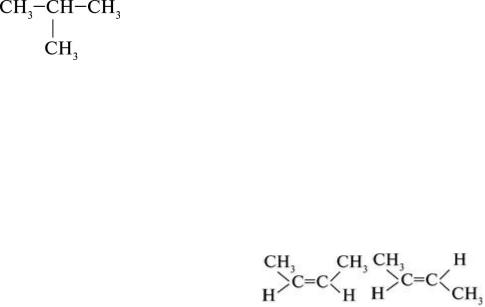
2)Ізомерія кратного (подвійного чи потрійного) зв’язку. Наприклад, 1-бутен CH3=CH– CH2–CH3 і 2-бутен CH3–CH=CH–CH3.
3)Ізомерія функціональної групи. Наприклад, 1-пропанол CH3–CH2–CH2–OH і 2-пропанол
CH3–CH–CH3.
4) Міжкласова ізомерія. Наприклад, однакову молекулярну формулу C2H6O мають і спирт етанол C2H5OH і диметиловий етер CH3–O–CH3.
Для алкенів характерною є ще просторова, або стереоізомерія. Стереоізомери мають однаковий порядок хімічних зв’язків, але різне розміщення атомів або груп атомів у просторі. При цьому утворюються цис-, трансізомери.
цис-бут – 2 - ен транс-бут- 2 -ен Гомологи – це сполуки, які подібні за будовою та хімічними властивостями, але
відрізняються за складом молекул на одну або кілька груп CH2, яка називається
гомологічною різницею.
Гомологи утворюють гомологічні ряди. Гомологічний ряд – це ряд сполук, подібних за своєю будовою та хімічними властивостями, які відрізняються одна від одної за складом молекул на одну або кілька гомологічних різниць CH2.
ЗМ 3.2. Вуглеводні
Промислові методи добування:
1. У промислових умовах насичені вуглеводні з довжиною ланцюга до одинадцяти атомів Карбону отримують зазвичай такими методами, як:
•фракційна перегонка нафти;
•переробка природного газу;
•гідрогенізація вугілля:
 . 2. Синтез Фішера – Тропша:
. 2. Синтез Фішера – Тропша:
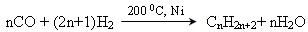 . Лабораторні методи
. Лабораторні методи
1.Гідроліз карбіду алюмінію: Al4C3 +12H2O → 4Al(OH)3+3CH4.
2.Декарбоксилювання(реакція Дюма):
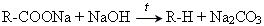 . Синтез Вюрца:
. Синтез Вюрца:
2СН3Сl+2Na → C2H6+2NaCl; 2R–Br+2Na → R–R+2NaBr.
3. Гідрування (гідрогенізація) алкенів:
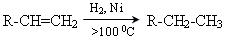 .
.
Хімічні властивості 1. Реакції окиснення. Горіння:
CnH2n+2 + (3n+1)/2O2 = nCO2 + (n+1) H2O. Отримання синтез-газу (промисловий метод):
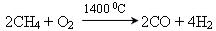 .
.
Добування формальдегіду:
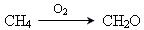 . 2. Піроліз метану.
. 2. Піроліз метану.
Промисловий метод отримання сажі та водню:
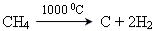 .
.
Промисловий метод добування ацетилену:
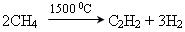 .
.
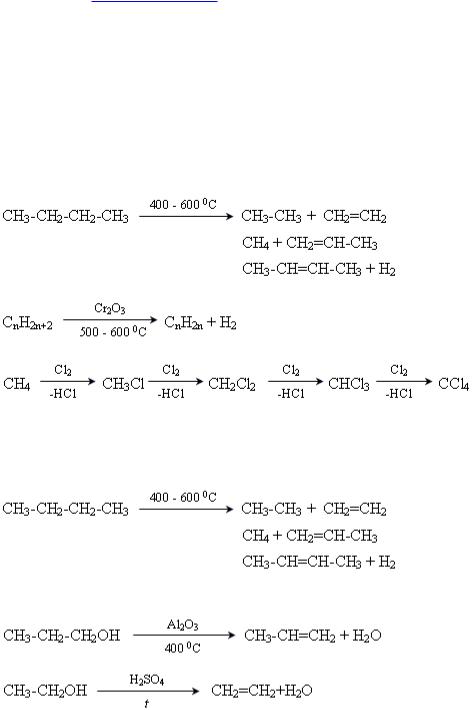
3.Крекінг алканів.
4.Дегідрогенізація (дегідрування) алканів.
5.Галогенування (Cl2, Br2).
Добування
Промислові методи 1. Крекінг алканів нафти.
Лабораторні методи 1. Дегідратація спиртів.
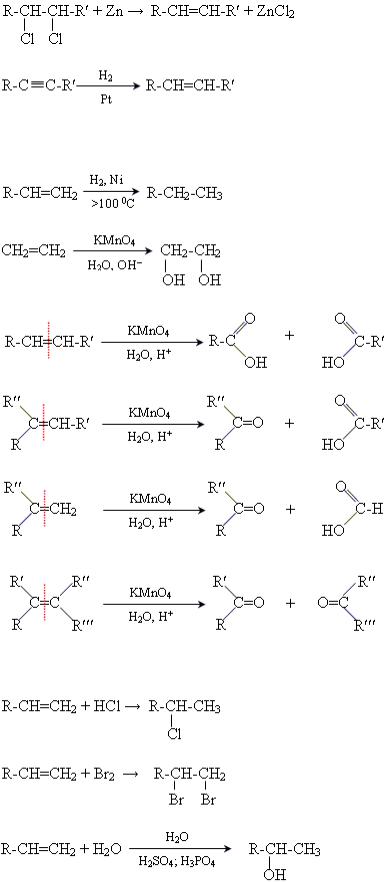
2.Відщеплення галогенів (Cl, Br).
3.Гідрування алкінів.
Хімічні властивості
1.Реакція гідрування.
2.Реакція Вагнера (окиснення перманганатом Калію у лужному середовищі).
3.Реакції окиснення калій перманганатом в кислому середовищі.
4. Реакції приєднання HBr і HCl.
Правило Марковникова: У результаті приєднання галогеноводнів до несиметричних алкенів Гідроген приєднується до найбільш гідрогенізованого атома Карбону.
5.Реакції приєднання Br2 і Cl2.
6.Реакції приєднання води (за правилом Марковникова).
7. Реакції полімеризації.
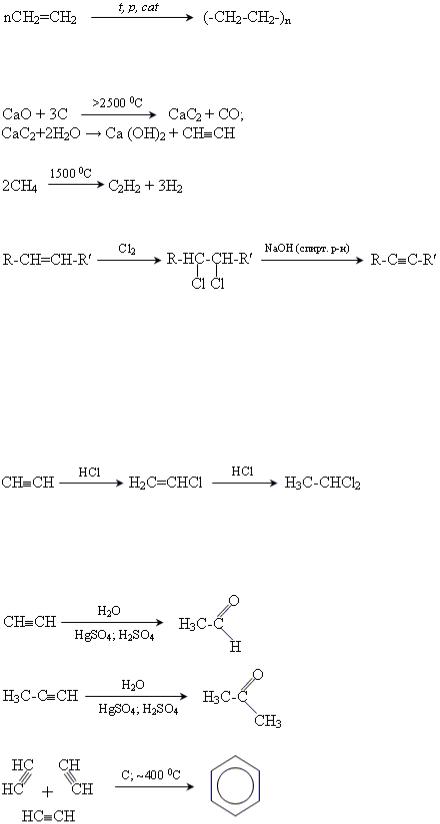
Добування
Промислові методи отримання ацетилену
1.Гідроліз ацетиленіду (карбіду) кальцію.
2.Піроліз метану.
Лабораторні методи
1.Отримання через галогенопохідні.
2.Отримання через галогенопохідні та натрій ацетиленід. R–Cl + NaC≡CH → R-C≡CH + NaCl
Хімічні властивості
1.Приєднання галогенів (Cl2, Br2): HCºCH + Cl2 → ClCH=CHCl; ClCH=CHCl + Cl2 → Cl2CH-CHCl2.
2.Приєднання галогеноводнів (HCl, HBr) за правилом Марковникова:
.
3. Гідрогенізація: 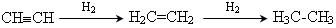 .
.
4.Реакція Кучерова (реакція приєднання води).
5.Реакція Реппе (тримеризація ацетилену).
6. Реакції утворення ацетиленідів.
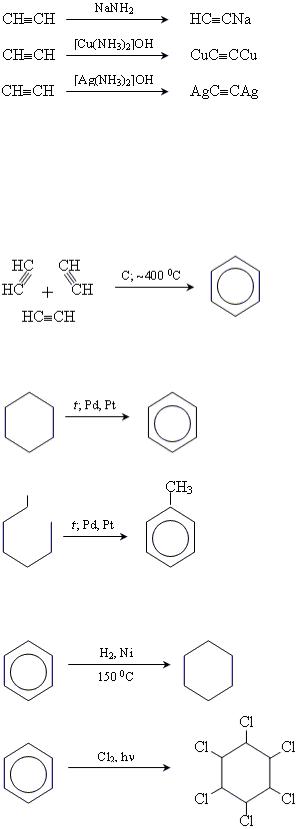
7. Димеризація ацетилену з утворенням вінілацетилену:
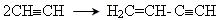 .
.
Промислові методи отримання бензену та його гомологів
1.Перегонка кам’яновугільної смоли.
2.Каталітичний риформінг нафти.
3.Реакція Берло(історичний спосіб)
Лабораторні методи
1.Дегідрогенізація циклогексану.
2.Дегідроциклізація гептану.
Хімічні властивості бензену 1. Реакції приєднання.
2. Реакції заміщення:
• реакція нітрування;
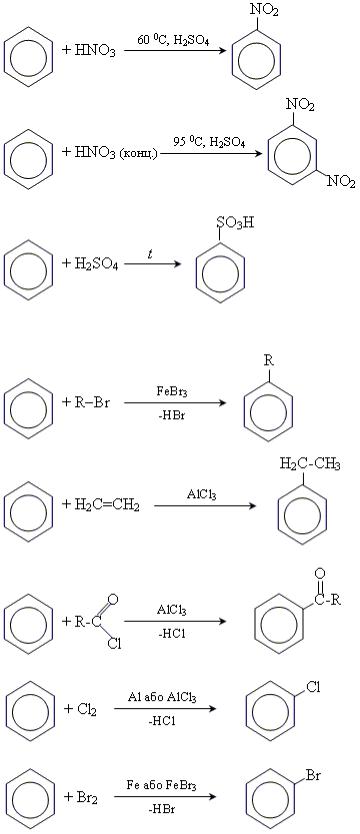
•реакція сульфування;
•реакція Фриделя-Крафса. •• алкілування
•• ацилювання
• реакції галогенування (Cl, Br)
Хімічні властивості толуену 1. Реакції заміщення
Реакції заміщення протікають значно легше, ніж у випадку бензолу, оскільки метильна група
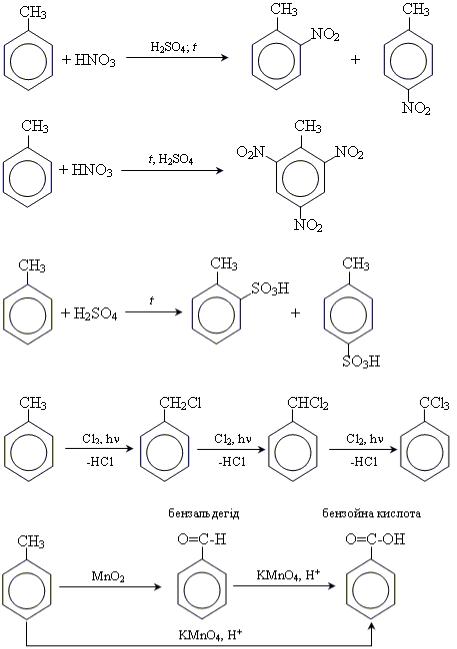
суттєво активує бензеновий цикл.
• реакція нітрування;
•реакція сульфування;
•галогенування за вільнорадикальним механізмом (Cl2 або Br2);
2. Реакції окиснення толуену.
ЗМ 3.3 Оксигеновмісні органічні сполуки
Спирти – це органічні сполуки, у молекулах яких містяться одна або кілька функціональних гідроксильних груп, сполучених із вуглеводневим радикалом.
Їх можна розглядати як похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені гідроксильними групами. Зокрема, насичені одноатомні спирти походять від насичених вуглеводнів, у яких один атом Гідрогену заміщений гідроксильною групою. Загальна формула насичених вуглеводнів – CnH2n+2, а загальна формула насичених одноатомних спиртів – CnH2n+1OH.
Якщо вуглеводневий радикал позначити літерою R, загальна формула спиртів позначається як R–OH.
Типовими представниками насичених одноатомних спиртів є метанол CH3OH і етанол C2H5OH. Оскільки до складу молекул наведених спиртів входить одна гідроксильна група OH, такі спирти належать до одноатомних.
Гідроксильна група OH є функціональною групою, тобто такою, що зумовлює хімічні властивості спиртів.
Насичені одноатомні спирти утворюють гомологічний ряд. Загальна формула спиртів цього ряду – CnH2n+1OH. Очолює гомологічний ряд насичених одноатомних спиртів метанол (або метиловий спирт) CH3OH. Другий член гомологічного ряду насичених одноатомних спиртів
– етанол (або етиловий спирт) C2H5OH. Наступні за ним – пропанол (або пропіловий спирт) C3H7OH, бутанол (або бутиловий спирт) C4H9OH і т. д.
За номенклатурою, що склалась історично, назва одноатомного спирта походить від назви радикала, з яким сполучена гідроксильна група. Наприклад, метиловий спирт CH3OH, пропіловий спирт C3H7OH тощо.
Спирти, як і всі органічні сполуки, горять. Метанол та етанол миттєво спалахують при підпалюванні й горять синюватим, майже непомітним полум’ям із виділенням великої кількості теплоти. Відбувається реакція повного окиснення, продуктами якої є CO2 та H2O: 2CH3OH + 3O2 → 2CO2 + 4H2O.
Завдяки тому, що електронна густина зв’язку OH зміщена до атома Оксисену, атом Гідрогену набуває більшої рухливості й легше відщеплюється. Під дією активних металів, таких як натрій, калій, магній, алюміній, відбувається заміщення атома Гідрогену на атом металу. Наприклад, у пробірку з етанолом покладемо шматочки натрію. Одразу відбувається реакція з виділенням газу. Це водень. Другим продуктом реакції є натрій етилат C2H5ONa:
2C2H5OH + 2Na → 2C2H5ONa + H2.
Реакції спиртів можуть відбуватись і з відщепленням гідроксильної групи OH. Так спирти
взаємодіють з галогеноводнями. Наприклад: C2H5OH + HCl конц.→ C2H5Cl + H2O.
Спирти вступають у реакції дегідратації (відщеплення води). Так, якщо етанол нагріти вище 170 °С з участю концентрованої сульфатної кислоти, відбувається реакція внутрішньомолекулярної дегідратації. Спирт перетворюється на ненасичений вуглеводень етилен: C2H5OH → CH2=CH2 + H2O. Якщо етанол нагріти лише до температури 140 °С у присутності концентрованої сульфатної кислоти, як каталізатора, відбувається реакція міжмолекулярної дегідратації. У результаті утворюються діетиловий етер та вода:
C2H5OH + HOC2H5 → C2H5 – O – C2H5 + H2O.
Гліцерол – представник трьохатомних спиртів. За систематичною номенклатурою, гліцерол має назву пропантріол. У його молекулі кожний атом Карбону пов’язаний із гідроксильною групою. Молекулярна формула гліцеролу – C3H8O3. Його структурна формула – СН2(ОН) – СН(ОН) – СН2ОН.
За фізичними властивостями гліцерол – це густа сиропоподібна рідина без запаху і кольору, солодка на смак, добре розчинна у воді. Властивості гліцеролу відображає його назва «олійний цукор», вживана у VIII ст., коли гліцерол було вперше добуто з маслинової олії. Гліцерол має високу температуру кипіння 290 °С, неотруйний.
Гліцерол вступає у реакції, характерні для одноатомних спиртів. Він горить з утворенням
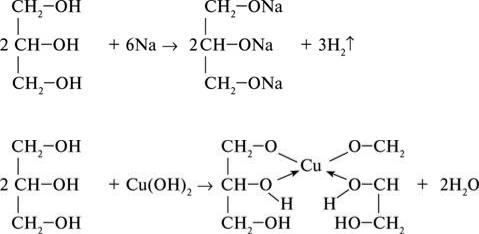
CO2 і води, реагує з активними металами з виділенням водню:
2 СН2(ОNa) – СН(ОNa) – СН2ОNa + 6Na → 2 СН2(ОNa) – СН(ОNa) – СН2ОNa + 3H2. Гліцерол вступає у реакцію з галогеноводнями:
CH2OH–CHOH–CH2OH + HCl → CH2OH–CHOH–CH2Cl + H2O, а також із нітратною кислотою.
Під час взаємодії гліцеролу з нітратною кислотою утворюється важка масляниста, сильно вибухова речовина – тринітратгліцеролу.
Характерною реакцією гліцеролу є утворення синього розчину під час взаємодії з купрум(ІІ) гідроксидом Cu(OH)2.
Гліцерол має широке застосування. Завдяки гігроскопічності він використовується у парфумерії та фармації як пом’якшувальний засіб, основа для мазей, добавка до мила. У харчовій промисловості – як добавка до напоїв. У шкіряному виробництві та текстильній промисловості гліцерол використовують для обробки пряжі та шкіри, щоб надати їм м’якості, еластичності.
Гліцерол застосовують для виробництва синтетичних смол і вибухових речовин, наприклад нітрогліцеролу. Нітратгліцеролу використовується для виготовлення динаміту. Спиртовий розчин нітрогліцеролу має судинорозширювальну дію. Його використовують як ліки у випадках серцевих захворювань.
Феноли – це органічні сполуки, у молекулах яких гідроксильні групи безпосередньо пов’язані з бензеновим циклом.
Найпростішим представником фенолів є гідроксибензен, або фенол. Молекулярна формула фенолу – C6H5OH.
Фенол – безбарвна кристалічна речовина з характерним запахом. Під час зберігання він поступово окиснюється киснем повітря та набуває рожевого забарвлення. Фенол плавиться за температури 43 °С. Добре розчиняється у гарячій воді.
Фенол отруйний, при потраплянні на шкіру викликає опіки. Він всмоктується через шкіру й може викликати отруєння.
За наявністю у молекулі фенолу гідроксильної групи можна припустити подібність між фенолом і спиртами, а за наявністю бензенового кільця – до бензену.
Як і спирти, фенол вступає у реакцію заміщення з металічним натрієм. При цьому утворюється натрій фенолят і виділяється водень: 2C6H5OH + 2Na → 2C6H5ONa + H2.
Але на відміну від спиртів фенол реагує за звичайних умов з лугами. При цьому знову утворюється фенолят і вода.
C6H5OH + NaОН → C6H5ONa + H2О. У цій реакції фенол виявляє кислотні властивості, тому
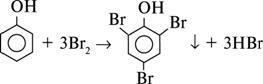
за ним і зберігається стара назва – карболова кислота. У водному розчині він дисоціює за рівнянням: C6H5OH → 2C6H5O– + H+.
Фенол легко вступає у реакцію з бромною водою. Якщо додати бромну воду до розчину фенолу, то швидко утворюється білий осад 2,4,6-трибромфенолу, який здатен розчинятися у надлишку брому..
Характерною реакцією фенолу, за якою його можна виявити серед інших речовин, є реакція з розчином ферум (ІІІ) хлориду. Унаслідок зливання розчинів речовин утворюється сполука фіолетового кольору.
Фенол – сильний антисептик, тому використовується як дезінфікуюча речовина у медицині. Особливо багато його витрачають у виробництві пластмас – фенопластів, а також барвників, лікарських речовин, фотографічних проявників.
Але треба зважати на те, що фенол вбиває не лише шкідливі мікроорганізми. Потрапляючи у довкілля, він згубно діє на флору та фауну. Тому його виробництво і промислове використання тісно пов’язані з питаннями екології, з охороною природи від промислових відходів, що містять фенол. З цією метою застосовують різні методи: гази, що містять фенол, піддають каталітичному окисненню, видаляють фенол розчинниками тощо. Ведеться постійна робота з удосконалення цих методів. Так, великого значення набуває біохімічний метод, який забезпечує глибоке очищення стічних вод від фенолу. Перспективним є також обробка їх озоном. Запровадження таких методів очищення дає можливість перейти до замкнутих безвідходних технологій з багаторазовим використанням промислових вод.
Альдегідами називають органічні речовини, молекули яких містять функціональну групу
атомів 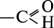 , сполучену з вуглеводневим радикалом.
, сполучену з вуглеводневим радикалом.
Загальна формула речовин цього класу – CnH2n+1COН або R–COН, у якій R – це атом Гідрогену (у випадку з мурашиним альдегідом), або вуглеводневий радикал.
Група атомів 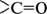 називається карбонільною групою, або карбонілом.
називається карбонільною групою, або карбонілом.
Порівняно зі спиртами у складі молекул альдегідів на два атоми Гідрогену менше. Це відбивається у назві «альдегіди», що походить від слів «алкоголь» і «дегідрування», тобто «дегідрований алкоголь».
Перший член гомологічного ряду альдегідів – метаналь, або формальдегід, або мурашиний
альдегід. Він має формулу 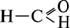 .
.
Наступний за ним – етаналь, або ацетальдегід, або оцтовий альдегід. Його формула –
 .
.
За номенклатурою, що історично склалась, назви альдегідів походять від назв тих кислот, на які вони перетворюються при окисненні. Наприклад, мурашиний альдегід – від мурашиної кислоти, оцтовий альдегід – від оцтової кислоти і т. д. За систематичною номенклатурою, назви альдегідів утворюють від назв відповідних насичених вуглеводнів шляхом додавання суфікса -аль: метаналь, етаналь, пропаналь тощо.
Для альдегідів в основному характерні два типи реакцій: окиснення та відновлення.
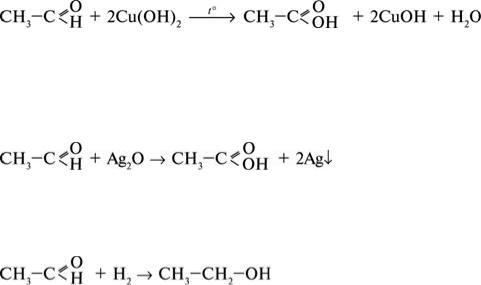
Під час повного окиснення альдегіду утворюється вуглекислий газ і вода: 2CH3COH + 5O2 → 4CO2 + 4H2O.
Часткове окиснення альдегіду можна провести за допомогою купрум(ІІ) гідроксиду Cu(OH)2 під час нагрівання або за допомогою реакції «срібного дзеркала». Продукти реакції в обох випадках однакові – утворюється відповідна кислота. А от ознаки реакцій різні. У разі окиснення альдегіду купрум(ІІ) гідроксидом під час нагрівання утворюється червоний осад Cu2O:
оцтовий альдегід |
оцтова кислота |
2CuOH  Cu2O + H2O.
Cu2O + H2O.
Якщо альдегід вступає у реакцію «срібного дзеркала» з аміачним розчином аргентум(І) оксиду Ag2O, то в результаті на стінках посуду випадає осад металічного срібла, що вкриває стінки блискучим шаром. Через це реакція називається реакцією «срібного дзеркала».
Наведені реакції є якісними на клас альдегідів.
Реакції відновлення альдегідів – це приєднання водню до молекули альдегіду. Продуктом такої реакції є відповідний спирт. Тобто, при відновленні метаналю утворюється метанол, при відновленні етаналю – етанол тощо.
етаналь етанол Оцтовий альдегід застосовують головним чином для добування оцтової кислоти, а також у деяких органічних синтезах.
Карбоновими кислотами називаються органічні речовини, молекули яких містять одну або
кілька карбоксильних груп  , сполучених з вуглеводневим радикалом.
, сполучених з вуглеводневим радикалом.
Ми розглянемо карбонові кислоти, у молекулах яких міститься одна карбоксильна група і насичений вуглеводневий радикал. Такі кислоти називаються насиченими одноосновними. Загальна формула сполук цього ряду – CnH2n+1COOH або R–COOH.
Найпростіша з карбонових кислот – мурашина. Її формула 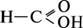 .
.
Далі в гомологічному ряду йде оцтова кислота 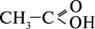 .
.
Для найпоширеніших карбонових кислот часто використовують такі історичні назви, як: муашрина, масляна, валеріанова тощо. Ці назви пов’язані переважно з тими джерелами, з яких була виділена та чи інша кислота: мурашина – з мурашок, оцтова – з оцту, масляна – з масла. За систематичною номенклатурою, назву кислот утворюють із назв відповідних насичених вуглеводнів, додаючи до них суфікс і закінчення -ова та слово кислота.
Оцтова (або етанова) кислота – це безбарвна рідина, летка, має різкий специфічний запах, змішується з водою у будь-яких пропорціях, розчин кислий на смак. Під дією температури, нижчої за +17 °С, вона твердіє у вигляді кристалів, схожих на лід, через що дістала назву льодяної оцтової кислоти.
За хімічними властивостями оцтова кислота подібна до мінеральних кислот. У водних розчинах вона дисоціює на іони: CH3COOH → CH3COO– + H+.
Подібно до неорганічних кислот оцтова кислота взаємодіє з металами, лугами, основними оксидами, солями. Наприклад, у результаті взаємодії оцтової кислоти з магнієм утворюються водень і сіль (магній ацетат). Ацетати – загальна назва солей оцтової кислоти.
2CH3COOH + Mg → Mg(CH3COO)2 + H2.
Як представник класу карбонових кислот оцтова кислота має свої специфічні властивості. Вона реагує зі спиртами з утворенням естерів.
І вступає у реакцію галогенування, наприклад хлорування. У результаті реакції утворюється хлороцтова кислота і хлороводень:
CH3COOH + Cl2 → hν CH2ClCOOH + HCl.
Застосування оцтової кислоти досить різноманітне. У хімічній промисловості з неї виробляють пластичні маси, різні барвники, лікарські речовини, штучне волокно (ацетатний шовк), незаймисту кіноплівку та багато інших речовин. Солі оцтової кислоти – ацетати алюмінію, хрому, феруму – застосовують як протраву у процесі фарбування тканин.
Оцтова кислота має широке застосування і як розчинник. У харчовій промисловості застосовується як консервувальний засіб та смакова приправа.
Естери утворюються в результаті взаємодії карбонових кислот зі спиртами.
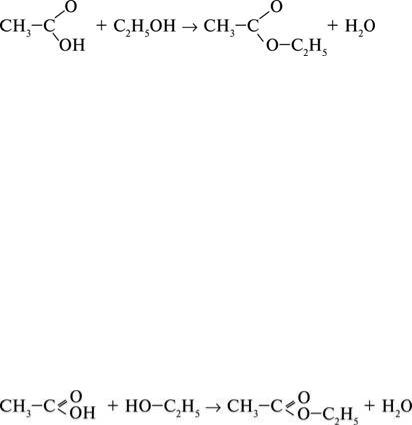
Реакції утворення естера з кислоти і спирта називаються реакціями естерифікації. Ці реакції відбуваються з малою швидкістю, тому їх часто проводять за наявності сильних неорганічних кислот. При цьому іони Гідрогену діють як каталізатори.
Експериментально доведено, що під час реакції естерифікації від молекули карбонової кислоти відщеплюється гідроксильна група, а від молекули спирта – атом Гідрогену.
Назви естерів походять від назв карбонової кислоти і спирта, з яких вони утворились. Наприклад, НСООСН3 має назву муринометиловий естер, СН3СООС2Н5 – оцтовоетиловий естер.
Естери карбонових кислот – леткі рідини, мають приємний фруктовий запах. Так, муриноаміловий естер має запах вишень, муриноетиловий – рому, оцтовоаміловий – бананів, масляноетиловий – абрикосів тощо.
Найважливішою хімічною властивістю естерів є реакція з водою – гідроліз. Під час нагрівання естера з участю розчину лугу естер взаємодіє з водою, знову перетворюючись на кислоту і спирт.
Багато естерів застосовують як розчинники органічних речовин. Їх використовують для виготовлення фруктових есенцій. Деякі естери застосовують у медицині.
Живі організми потребують енергію для свого існування, росту і відтворення. Важливими сполуками, у формі яких організм зберігає основні енергетичні запаси, є жири.
Жири – це естери трьохатомного спирта гліцеролу та вищих карбонових кислот. Загальна назва таких сполук – тригліцериди.
Склад і будову жирів можна зобразити загальною формулою естера, в якому залишки
карбонових кислот позначені радикалами R1, R2, R3. CH2–O–CO–R1
|
CH–O–CO–R2
|
CH2–O–CO–R3.
Найчастіше до складу молекул жирів входять радикали таких вищих карбонових кислот: пальмітинової C15H31COOH, стеаринової C17H35COOH, олеїнової C17H33COOH.
Усі жири легші за воду і в ній не розчиняються. Вони добре розчиняються в органічних розчинниках. Жири можуть бути твердими та рідкими. Тваринні жири (яловичий, баранячий) – тверді й містять в основному залишки насичених кислот. Рослинні жири – олії
– рідкі та містять переважно залишки ненасичених кислот.
Найважливішою властивістю жирів, як і всіх естерів, є їх гідроліз, в результаті якого вони розщеплюються на гліцерол та відповідні карбонові кислоти.
CH2–O–CO–R HOH |
|
CH2–OH |
|
| |
|
| |
|
CH–O–CO–R + HOH |
→ |
CH–OH |
+ 3RCOOH |
| |
|
| |
|
CH2–O–CO–R HOH |
|
CH2–OH |
|
Цей процес відбувається в організмі: жири, що входять до складу їжі, під впливом ферментів підшлункового та кишкового соку піддаються гідролізу. Продукти гідролізу – гліцерол і карбонові кислоти всмоктуються у кишечнику та знову утворюють жир, необхідний організму.
Якщо проводити гідроліз жиру з участю лугу, то утворюється мило. Ця реакція називається
омиленням жирів.
Гідрування жирів – це процес приєднання атомів Гідрогену. У результаті цієї реакції ненасичена сполука перетворюється на насичену, а рідкий жир – на твердий: Наприклад, при гідруванні триолеїну (рідкий жир) утворюється тристеарин (твердий жир).
CH2–O–CO–C17H33 |
CH2–O–CO– C17H35 |
| |
| |
CH–O–CO–C17H33 + 3H2 → |
CH– O–CO– C17H35 |
| |
| |
CH2–O–CO–C17H33 |
CH2– O–CO– C17H35 |
триолеїн |
тристеарин |
Процес гідрування жирів лежить в основі виробництва маргарину. Негідровані жири гіркнуть, окиснюючись за подвійними зв’язками, у них з’являється неприємний запах і смак. Гідрування уповільнює ці процеси, крім того, дає змогу з дешевих олій добувати більш цінні тверді жири.
Жири разом із білками та вуглеводами належать до біологічно активних речовин. Вони входять до складу клітин рослинних і тваринних організмів та є для них джерелом енергії. У результаті окиснення 1 г жиру виділяється 37,7 кДж енергії, що удвічі більше, ніж під час окиснення 1 г білка чи вуглеводу.
Основна кількість жирів, що споживаються людиною, міститься у м’ясі, рибі, молочних і
зернових продуктах. У разі, коли в організм людини надходить більше енергії, ніж витрачається нею, утворюються жироподібні речовини, що відкладаються у тканинах організму. Таким чином організм акумулює енергію.
Згідно з даними сучасної медицини, вживання тваринних жирів може призвести до накопичення речовин, що ускладнюють рух крові в артеріях. Тому кориснішими для вживання є рідкі жири, тобто олії.
До складу мила входять натрієві та калієві солі вищих карбонових кислот: стеаринової та пальмітинової. Натрієві солі вищих карбонових кислот є основною складовою частиною твердого мила, калієві солі – рідкого мила.
У промисловості мило добувають лужним гідролізом жирів. Цей процес ще називають омиленням жирів. Для омилення жирів замість лугу можна використовувати соду Na2CO3. Мило, добуте внаслідок цієї реакції, називається ядровим милом і відоме як господарське мило. Туалетне мило відрізняється від господарського наявністю добавок: барвників, запашних речовин, антисептиків тощо.
Мийна дія мила – складний фізико-хімічний процес. Мило є посередником між полярними молекулами води і неполярними частинками бруду, нерозчиненого у воді. Умовно склад мила можна позначити формулою R–COONa, де R – вуглеводневий радикал, до складу якого можуть входити 12–17 атомів Карбону. За хімічною природою мило – це сіль, іонна сполука. Вона містить полярний залишок –COO– + Na+ та неполярний радикал R. Під час миття молекули мила так орієнтуються на забрудненій поверхні, що полярні групи –COONa звернені до полярних молекул води, а неполярні вуглеводневі радикали – до неполярних часток бруду. Таким чином, частинки бруду ніби потрапляють в оточення молекул мила і легко змиваються з поверхні водою.
У твердій воді мило втрачає свою мийну дію, тому що утворюються нерозчинні магнієві та кальцієві солі вищих карбонових кислот. У зв’язку з цим широко розвивається виробництво синтетичних мийних засобів. Вони мають добру мийну дію і не втрачають її у твердій воді. До ефективних синтетичних мийних засобів належать алкілсульфати. Це натрієві солі моноестерів сульфатної кислоти з вищими спиртами RO–SO2ONa, де R – насичений вуглеводневий радикал. Молекули цих солей містять 12–14 атомів Карбону і мають дуже добрі мийні властивості. Їх кальцієві та магнієві солі розчинні у воді, а тому такі мийні засоби миють і в твердій воді. Вони входять до складу поширених пральних порошків.
Мило і синтетичні мийні засоби належать до так званих поверхнево-активних речовин (ПАР). Їхнє широке застосування часто пов’язують із забрудненням водойм, довкілля. Річ у тім, що до мийних засобів додають фосфати, які у водоймах перетворюються на речовини, які живлять мікроорганізми. Вони починають швидко розмножуватись. А це спричиняє заболочення водойм. Через це сучасні мийні засоби повинні хімічно чи біологічно розкладатися на нешкідливі речовини, що не забруднюють стоки.
Вуглеводи – природні сполуки, які відіграють важливу роль у житті людини, тварин і рослин. До вуглеводів належать: глюкоза, фруктоза, сахароза, крохмаль, целюлоза тощо. Назва вуглеводи склалась історично, оскільки перші з вивчених сполук цього класу крім атомів Карбону (вуглецю) містили у молекулах атоми Гідрогену та Оксигену у співвідношенні 2 до 1, тобто як у воді (звідси й назва «вуглеводи»).
Вуглеводи поділяються на моносахариди, дисахариди, полісахариди. Найпростішим
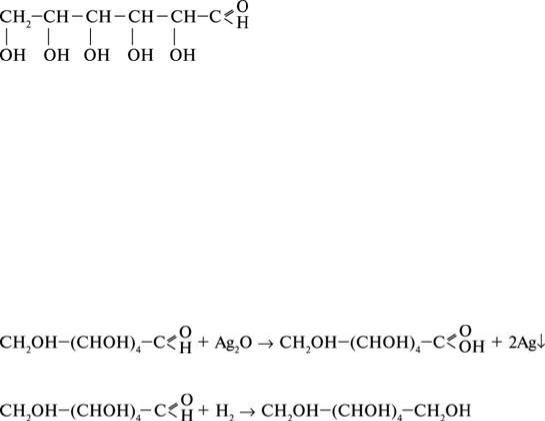
представником моносахаридів є глюкоза. Молекулярна формула глюкози – C6H12O6. Структурна формула глюкози показує, що в її молекулі містяться п’ять гідроксильних груп та одна карбонільна.
Отже, глюкоза є одночасно і багатоатомним спиртом, і альдегідом, тобто альдегідоспиртом. Глюкоза поширена у природі. Вона міститься у великих кількостях у виноградному соку (тому глюкозу ще називають виноградним цукром), входить до складу меду, дозрілих фруктів, ягід. Це біла кристалічна речовина, добре розчинна у воді, солодка на смак. У природі утворюється внаслідок реакції фотосинтезу:
6CO2 + 6H2O 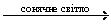 C6H12O6 + 6O2.
C6H12O6 + 6O2.
Молекула глюкози є альдегідоспиртом. Тому глюкоза вступає у реакції, характерні для багатоатомних спиртів та альдегідів.
Як багатоатомний спирт глюкоза реагує з купрум(ІІ) гідроксидом, утворюючи розчин синього кольору.
Як альдегід глюкоза окиснюється (наприклад, у реакції «срібного дзеркала») до глюконової кислоти
глюконова кислота
і відновлюється воднем до шестиатомного спирту сорбіту
сорбіт.
Велике значення мають процеси бродіння глюкози, що відбуваються під дією органічних каталізаторів-ферментів. Відомо кілька видів бродіння. Спиртове бродіння відбувається під дією ферментів дріжджів. Продуктами є етиловий спирт С2H5OH і вуглекислий газ: СO2 :
C6H12O6 2C2H5OH + 2CO2.
Молочнокисле бродіння глюкози відбувається під дією молочнокислих бактерій: C6H12O6CH3–CHOH–COOH
молочна кислота. При цьому утворюється молочна кислота.
Найважливішою сполукою з дисахаридів є сахароза. Її молекулярна формула – C12H22O11. Сахароза – це безбарвна кристалічна речовина, солодка на смак, добре розчинна у воді. Під час нагрівання до 190–200 °С її кристали плавляться, утворюючи карамель.
У великих кількостях сахароза міститься у цукрових буряках, стеблах цукрової тростини, а також у березовому та кленовому соках, у багатьох плодах.
Важлива хімічна властивість сахарози – здатність до гідролізу під час нагрівання у кислому середовищі. При цьому з однієї молекули сахарози утворюється молекула глюкози і
молекула фруктози (ізомери): C12H22O11 + H2O → C6H12O6 + C6H12O6.
Сахарозу добувають з природної сировини – цукрового буряку, цукрової тростини. Спочатку цукровий буряк, наприклад, миють, коренеплоди подрібнюють. Потім цю масу обробляють гарячою водою. Як добре розчинна у воді сполука сахароза переходить у
розчин. Розчин сахарози очищують, поступово обробляючи його вапняним молоком і вуглекислим газом. Далі розчин випарюють, сахароза кристалізується – утворюється цукровий пісок. Шляхом повторного розчинення та кристалізації утворюють цукор-рафінад. Крохмаль – це представник групи полісахаридів. Склад молекули крохмалю виражається формулою (C6H10O5)n. Це природний полімер, що синтезується в рослинах із глюкози:
nC6H12O6 → (C6H10O5)n + nH2O.
Полімерні ланцюги крохмалю неоднорідні. Серед них є лінійні та розгалужені, довгі й короткі. Число ланок у полімері коливається від кількох сотень до п’яти тисяч і більше. Крохмаль поширений у природі. Для різних рослин він запасний поживний матеріал і міститься в них у вигляді крохмальних зерен. Масова частка його у бульбах картоплі становить приблизно 20%, у зернах пшениці – близько 70%, рису – близько 80%.
Крохмаль – білий порошок, що не розчиняється в холодній воді. У гарячій воді він набрякає, утворюючи клейстер. Характерною реакцією на крохмаль є утворення синього забарвлення під час взаємодії з розчином йоду.
Найважливіша хімічна властивість крохмалю – його гідроліз. Кінцевим продуктом гідролізу
є глюкоза: (C6H10O5)n + nH2O → nC6H12O6.
Проміжні продукти гідролізу крохмалю – суміш декстринів та глюкози (патоку) використовують у кондитерській промисловості для виготовлення цукерок, додають у тісто для випікання пряників. Крохмаль є сировиною для виробництва етилового спирта. У текстильній промисловості крохмаль використовують для проклеювання тканин, у паперовій
– для склеювання паперу і картону, у медицині – для виготовлення присипок, паст, капсул для лікарських препаратів.
ЗМ 3.4. Нітрогеновмісні органічні сполуки
Класифікація
•Класифікація за кількістю вуглеводневих радикалів, що заміщують атоми Гідрогену у молекулі амоніаку:
RNH2 первинні аміни, наприклад, метиламін; R2NH вторинні аміни, наприклад, диметиламін; R3N третинні аміни, наприклад, триметиламін.
Використання
•Виробництво барвників.
•Виробництво ПАР (поверхнево – активних речовин), мийних засобів.
•Виробництво лікарських препаратів:
2NН3 + СН3Br → СН3NН2 + NН4Br;
СН3NН2 + CН3Br + NН3 → (СН3)2NН + NН4Br; (СН3)2NН + CН3Br + NН3 → (СН3)3N + NН4Br. Добування ароматичних амінів за реакцією Зініна.
Хімічні властивості
Основні властивості амінів
СН3NН2 + H2O = [СН3NН3]OH = [СН3NН3] + + OH- СН3NН2 + HCl = [СН3NН3]Cl
Аміни є більш слабкими основами, ніж аміак. Зі збільшенням величини вуглеводневого радикала основні властивості послаблюються. Ароматичні аміни є більш слабкими основами, ніж аліфатичні аміни.
Горіння амінів:
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2.
Загальна характеристика
Поширення у природі
У природі поширені лише L - амінокислоти, що є структурними елементами білків та інших біологічно активних речовин.
Класифікація
Залежно від положення аміногрупи розрізняють α, β, ε - амінокислоти тощо. У загальному вигляді формулу α - амінокислоти можна представити наступним чином:
RCH(NH2)COOH
• Класифікація за хімічною природою положення замісника: H2N-CH2COOH - аліфатичні, наприклад: гліцин, аланін;
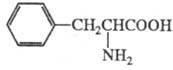 - ароматичні, наприклад: фенілаланін;
- ароматичні, наприклад: фенілаланін;
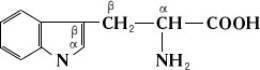 - гетероциклічні, наприклад: триптофан. Використання
- гетероциклічні, наприклад: триптофан. Використання
•Виробництво лікарських препаратів.
•Виробництво харчових і кормових добавок.
Добування та хімічні властивості амінокислот
Добування
1.Гідроліз природних білків.
2.Синтез з використанням галогенозаміщених карбонових кислот.
3.Мікробіологічний синтез.
Хімічні властивості 1. Кислотно-основні властивості.
Амінокислоти виявляють амфотерні властивості, оскільки вміщують як основну групу –NH2, так і кислотну групу –СООН. Амфотерність амінокислот виявляється, наприклад, у процесі утворення внутрішніх солей, так званих біполярних іонів:
H2N–CH2–COOH → H3N+–CH2–COO-
Амінокислоти реагують як із лугами, так і з кислотами. 2. Реакції поліконденсації.
Амінокислоти під час взаємодії між собою утворюють аміди, які називають пептидами. Зв’язок називається пептидним.
Так, наприклад, під час взаємодії гліцину й аланіну утворюється дипептид гліцилаланін. Реакції утворення пептидів з амінокислот відносяться до реакцій поліконденсації. Амінокислотами називають органічні сполуки, молекули яких містять карбоксильну групу
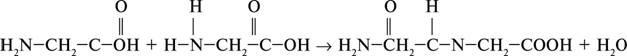
–COOH і аміногрупу –NH2.
Їх можна розглядати як похідні карбонових кислот, які утворюються заміщенням одного чи кількох атомів Гідрогену у вуглеводневому радикалі аміногрупою. Наприклад, оцтова кислота має формулу CH3COOH, амінооцтова кислота – H2N–CH2COOH.
Амінокислоти часто називають за назвою відповідної карбонової кислоти, до якої додають слово аміно-. Положення аміногрупи відносно карбоксильної позначають грецькими буквами α (альфа), β (бета) тощо.
CH3–CH(NH2)–COOH – амінопропіонова кислота.
Для багатьох амінокислот збереглися й історичні назви: амінооцтова кислота – гліцин, α – амінопропіонова – аланін тощо.
За фізичними властивостями амінокислоти – безбарвні кристалічні речовини з високими температурами плавлення, більшість із них добре розчинні у воді.
Карбоксильна й аміногрупа протилежні за хімічним характером: перша є носієм кислотних властивостей, друга – основних. Отже, амінокислоти – амфотерні сполуки.
Найважливішою особливістю амінокислот є взаємодія молекул між собою. У реакцію вступають протилежні за функціями групи: карбоксильна група однієї молекули й аміногрупа іншої. Унаслідок реакції утворюються ди-, три-, поліпептиди і виділяється вода.
Зв’язок між залишками амінокислот називається пептидним, а група CO–NH – пептидною групою.
Білки – це полімери, які складаються з великої кількості залишків α -амінокислот. Кожен білок має набір амінокислот, сполучених у певній властивій тільки йому послідовності. Будова молекул білків дуже складна. Розрізняють первинну структуру білка – це послідовність чергування залишків амінокислот у поліпептидному ланцюзі. Вторинна структура – це форма поліпептидного ланцюга у просторі, яка може бути витягнутою в нитку, згорнутою в клубок або скрученою в спіраль. Третинна структура – це просторове розміщення поліпептидних ланцюгів, що визначає його конфігурацію. Четвертинна структура – розміщення у просторі кількох поліпептидних ланцюгів у макромолекулі білка. Білки дуже відрізняються між собою за властивостями. Це залежить від наявності в їхньому складі амінокислот із різними функціональними групами, здатними вступати у характерні для них реакції.
Найважливішими властивостями білків є денатурація, гідроліз, кольорові реакції. Денатурація – це руйнування четвертинної, третинної, вторинної структури білка під дією високої температури, радіації, хімічних реагентів.
Кольорові реакції білків використовуються для їх аналітичного визначення. Так, взаємодією білків з концентрованою нітратною кислотою визначається наявність бензенових циклів у структурі білка, а взаємодією з купрум (ІІ) гідроксидом – наявність пептидних зв’язків.
Під час гідролізу білок розщеплюється на окремі амінокислоти, з яких він побудований.
ЗМ 3.5. Синтетичні високомолекулярні речовини та полімерні матеріали на їх основі
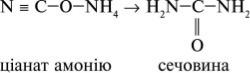
Поняття про штучні волокна. Усі волокна за своєю природою можна поділити на природні (натуральні) та хімічні. До натуральних волокон належать льон, вовна, бавовна. Хімічні волокна ще поділяються на штучні та синтетичні. Відмінність між ними полягає в тому, що штучні волокна виготовляють із природної сировини шляхом її хімічної переробки, а синтетичні волокна – із синтетичних полімерів.
Прикладами штучних волокон є ацетатний шовк, віскоза. Тканини, виготовлені з таких волокон, не проводять тепло, легко фарбуються, але є термічно нестійкими, електризуються. Синтетичні волокна виготовляються із синтетичних полімерів. Якщо бавовна – полімерний матеріал, мономером якого є целюлоза, то вовна і шовк – полімери білкової природи, молекули яких утворюються шляхом сполучення амінокислот, подібну структуру має полімер амінокапронової кислоти складу H2N–(CH2)5–COOH.
Волокно, вироблене з полімеру амінокапронової кислоти, називається капроном.
Капрон має високу міцність, стійкий до стирання та дії багаторазових деформацій. Капронові волокна не вбирають вологи, тому не втрачають міцності у вологому стані. Треба знати й про недоліки капронового волокна: воно малостійке до дії кислот. Під час нагрівання міцність його знижується, а при температурі 215°С полімер плавиться. Ось чому не можна прасувати речі з капрону гарячою праскою.
ЗМ 3.6. Узагальнення знань про органічні сполуки
Речовинний світ природи надзвичайно різноманітний, і разом з тим усі речовини взаємопов’язані. Генетичний зв’язок між органічними та неорганічними речовинами полягає, перш за все, у тому, що органічні речовини можна добути з неорганічних. Наприклад, під час нагрівання неорганічної речовини ціанату амонію NH4 - CO – NH4 утворюється органічна речовина – сечовина (карбамід) - (NH2)2CO.
Яскравим доказом існування генетичного зв’язку між органічними та неорганічними речовинами є також колообіг біогенних елементів у природі.
Отже, всі речовини генетично пов’язані між собою. Генетичний зв’язок полягає у тому, що кожна речовина може хімічно взаємодіяти з речовинами інших класів. Органічні речовини можуть взаємодіяти з неорганічними.
