
- •Із принципу Ле Шательє - Брауна випливає:
- •а) у разі збільшення концентрації однієї з реагуючих речовин рівновага зміщується у бік витрачання цієї речовини, а в разі зменшення концентрації – у бік її утворення;
- •в) під час підвищення температури рівновага зміщується у бік перебігу ендотермічної реакції, під час зниження температури – екзотермічної реакції.
- •Чинники, що впливають на швидкість хімічної реакції:
- •Загальна характеристика галогенів
- •Методи синтезу гідрогенгалогенідів
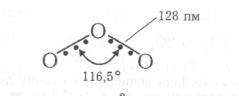
1,5. Величина валентного кута (116,5°) вказує на sр2-гібридизацію валентних орбіталей центрального атома кисню. Наведені дані свідчать про наявність у молекулі О3 делокалізованого трицентрового π-зв’язку.
При цьому центральний sр2-гібридизований атом Оксигену утворює два σ-зв’язки з крайніми атомами, а його негібридизована 2рz-орбіталь, яка розміщена під прямим кутом до площини трьох атомів, та аналогічно спрямовані 2рz-орбіталі крайніх атомів Оксигену утворюють трицентровий нелокалізований π-зв’язок.
Озон – ендотермічна сполука ( Н= 142,3 кДж/моль, G°298 = 162,7 кДж/моль). Він легко розкладається з утворенням вільних атомів Оксигену, що зумовлює його високу окиснювальну здатність:
О3 = О2 + О.
Про значно більшу хімічну активність О3 порівняно з О2 свідчать стандартні електродні потенціали озону у водних розчинах:
нейтральне середовище |
О3 + Н2О + 2е- = О2 + 2ОН-, Е° = 1,24 В; |
|
|
О2 |
+ 2Н2О + 4е- = 4ОН-, Е° = 0,401 В; |
кисле середовище |
О3 + 2Н+ + 2е- = О2 + Н2О, Е° = 2,07 В; |
|
|
О2 |
+ 4Н+ + 4е- = 2Н2О, Е° = 1,23 В. |
Озон легко окиснює різноманітні сполуки з утворенням іона О2- та молекули О2:
2Аg + O3 = Аg2O + O2; РbS + 4O3 = РbSO4 + 4O2;
2КІ + О3 + Н2О = І2 + О2 + 2КОН.
Останню реакцію використовують для виявлення та кількісного визначення озону.
Іноді продуктами реакцій за участю озону є озоніди (спорідненість О3 до електрона становить 180 кДж/моль), наприклад:
К + О3 = КО3; 4КОН + 4О3 = 4КО3 + О2 + 2Н2О.
Такі сполуки вміщують молекулярний іон О3-. На відміну від озону Оз, іон О3- має неспарений електрон, який зумовлює його парамагнетизм. Озоніди лужних металів мають червоне забарвлення, вони дуже сильні окисники.
Загальна характеристика галогенів
До елементів VII головної підгрупи належать флуор (F), хлор (Cl), бром (Br), йод (I), астат (At). Назва цих елементів – галогени (з грецьк. «ті, що народжують солі») – зумовлена тим, що більшість їх сполук із металами є типовими солями (KCl, NaCl і т. д.).
Таблиця 1. Деякі характеристики атомів галогенів
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Атом |
|
Електронна |
|
Орбіталь- |
|
Еср |
|
|
Eион |
|
ЕН |
|
Стійкі |
ступені |
|
|
|
|
конфігурація |
|
ний |
|
Спорідне- |
|
Перша |
|
Електро- |
|
окиснення |
|
|
|
|
|
|
|
|
атомний |
|
ність |
до |
|
енергія |
|
негатив- |
|
|
|
|
|
|
|
|
|
радіус, |
|
електрона, |
|
іонізації, |
|
ність* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( ) |
|
еВ |
|
еВ |
|
|
|
|
|
|
|
|
|
|
|
(кДж/моль) |
|
(кДж/моль) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9F |
|
[He]2s22p5 |
|
0.39 |
|
3.45(333) |
|
17.42(1682) |
|
4.1 |
|
-1; 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17Cl |
|
[Ne]3s23p53d0 |
|
0.73 |
|
3.7 (348) |
|
12.97(1255) |
|
2.9 |
|
-1;0;+1;+3;(+4); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+5; (+6); +7. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
35Br |
|
[Ar]3d104s24p54d0 |
|
0.85 |
|
3.4(325) |
|
11.81(1143) |
|
2.8 |
|
-1; 0; +1; +3; (+4); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+5; +7. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
53I |
|
[Kr]4d105s25p55d0 |
|
1.04 |
|
3.1(295) |
|
10.47(1012) |
|
2.2 |
|
-1; 0; +1;+3; +5; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+7. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В основному стані атоми галогенів мають електронну конфігурацію ns2np5. Порівняно з атомами інших галогенів у атомів Флуору 2s2 и 2p5 електрони слабо екрановані від ядра, що призводить до високої питомої (на одиницю об’єму) електронної густини і, відповідно, меншого радіуса, великих значень енергії іонізації та електронегативності. При переході від Флуору до Йоду, вздовж групи, розмір атомів і можливі координаційні числа збільшуються, енергії іонізації та електронегативності (ЕН) зменшуються.
Властивості Флуору, як і інших елементів другого періоду (Li-F), відрізняються від властивостей більш важких елементів відповідних груп. Наприклад, спорідненість до електрона у Флуору менше, ніж у Хлору. Це пов’язано з високою електронною густиною і сильним міжелектронним відштовхуванням. При переході від Хлору до Йоду спорідненість до електрона зменшується із-за збільшення радіуса атома галогену. До особливостей Флуору належить також висока електронегативність, а це веде до того, що для Флуору зі всіх можливих ступенів окиснення -1, 0, +1, +3, +5, +7 характерні тільки дві перші. Слід також зазначити високі (порівняно з іншими галогенами) ентальпії утворення іонних і ковалентних
фторидів. У випадку іонних фторидів це зумовлено невеликим розміром йона  , сильною кулонівською взаємодією і, відповідно, високою енергією кристалічної ґратки. Висока ентальпія утворення ковалентних фторидів пов’язана з малим радіусом атома фтору, з великим (порівняно з іншими галогенами) перекриттям атомних орбіталей та, отже, з більш міцним ковалентним зв’язком. Наприклад, у молекулах NF3 і NCl3 енергії зв’язку N-X становлять 272 і 193 кДж/моль відповідно.
, сильною кулонівською взаємодією і, відповідно, високою енергією кристалічної ґратки. Висока ентальпія утворення ковалентних фторидів пов’язана з малим радіусом атома фтору, з великим (порівняно з іншими галогенами) перекриттям атомних орбіталей та, отже, з більш міцним ковалентним зв’язком. Наприклад, у молекулах NF3 і NCl3 енергії зв’язку N-X становлять 272 і 193 кДж/моль відповідно.
Галогени виявляють позитивні ступені окиснення у сполуках з більш електронегативними елементами (наприклад, із фтором (ClF7, IF7) і киснем). Сполуки, в яких атом галогену виступав би як одновалентний катіон Х+, невідомі, оскільки енергетичні витрати на іонізацію (табл.1) не компенсуються енергією кристалічної ґратки і сольватації. Однак для йоду та
брому відомі комплексні сполуки (наприклад, 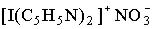 (з піридином)), в яких атом галогену знаходиться у позитивному ступені окиснення +1, +3.
(з піридином)), в яких атом галогену знаходиться у позитивному ступені окиснення +1, +3.
Астат за своїми властивостями нагадує йод. Наприклад, ідентифіковані сполуки HAt, CH3At, BiAt, Ba(AtO3)2. Однак сполуки у вищому ступені окиснення At (VII) не одержані.

Таблиця 3. Хімічні властивості простих речовин
Неметали |
|
Фтор |
|
|
Хлор |
|
|
Бром |
|
|
Йод |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He, Ne, Ar |
|
|
|
|
Не взаємодіють. |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Kr, Xe |
|
ЕFn , n = 2,4,6. |
|
|
Не взаємодіють. |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
XF (X=Cl,Br,I); |
BrCl, ICl, |
BrCl, IBr |
ICl, IBr |
||||||
Галогени |
|
XF3 (X=Cl,Br,I); |
|
|
I2Cl6 |
|
|
|
I2Cl6 |
||
|
XF5(X=Cl,Br,I) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
XF7 (X=I) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О2
S
N2
P
H2
F2O2 |
|
Не взаємодіють. |
|
|
|
|
|
(в електр. розряді) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SF6, S2F10 |
|
S2Cl2, SCl2,SCl4 |
|
S2Br2 |
|
|
Не реагує. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Не взаємодіють. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PХ3 и РХ5 |
|
|
|
|
|
|
PI3, P2I4,PI5(?) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
З вибухом у темряві |
|
З вибухом при |
|
Реагує |
при |
|
Рівновага |
|
|
світлі. |
|
температурі |
|
|
H2+Г2=2НГ |
|
|
|
|
понад 2000С, |
|
|
зміщена вліво. |
|
|
|
|
Pt-каталізатор |
|
|
|
|
|
|
|
|
|
|
|
Метали |
|
Загоряються. |
|
Реагують під час нагрівання. |
|
|
|
|
|
За хімічними властивостями галогени – найактивніші неметали. Через низьку енергію
дисоціації та високу енергію гідратації іона 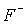 найбільш реакційноздатним із галогенів є фтор. Він взаємодіє безпосередньо зі всіма елементами Періодичної таблиці
найбільш реакційноздатним із галогенів є фтор. Він взаємодіє безпосередньо зі всіма елементами Періодичної таблиці
Д. І.Менделєєва, крім He, Ne, Ar. В атмосфері фтору згоряють вода (2H2O + 2F2 = 4HF + O2) і скляна вата (SiO2 + 2F2 = SiF4 + O2).
Якщо ж елемент може проявляти декілька ступенів окиснення, то, як правило, утворюються вищі можливі флуориди (SF6 , VF5, XeF6).
Взаємодія фтору з деякими перехідними металами, наприклад, нікелем, проходить край повільно через утворення на їх поверхні тонкої захисної плівки відповідного фториду металу.
Взаємодія галогенів з водою – складний процес, що включає розчинення, утворення сольватів і диспропорціонування.
Розчинність (моль/л) хлору, брому та йоду у воді незначна, причому зі збільшенням температури для хлору вона зменшується, для брому – практично не змінюється, а для йоду
– збільшується.
Можна відзначити два типи взаємодії молекул води з молекулами галогенів. До першого належить процес утворення клатратів, наприклад: 8Cl2×46H2O (у процесі кристалізації розчинів при зниженій температурі). Молекули галогену в клатратах займають вільні
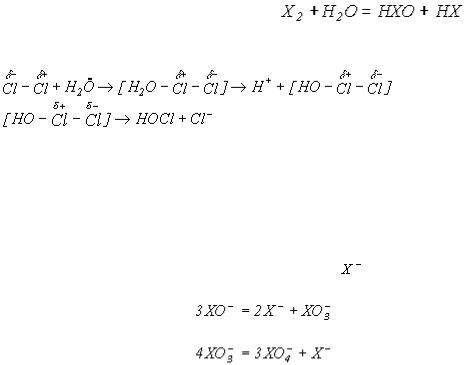
порожнини у каркасі з молекул H2O, пов’язаних між собою водневими зв’язками.
До другого типу можна віднести гетеролітичний розпад та окисно-відновне диспропорціонування (реакція 2):
Механізм реакції диспропорціонування включає поляризацію молекули хлору молекулою H2O, утворення проміжної сполуки і наступну її дисоціацію з утворенням Cl:
Таблиця 3. Константи рівноваги реакцій (25 °С)
|
|
|
|
|
|
|
|
|
|
|
|
№ |
|
Рівновага |
|
Хлор |
|
Бром |
|
Йод |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
X2(газ,р.,тв.)=X2(р-н) |
|
0.06 |
|
0.21 |
|
0.0013 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
+ |
|
3.9 10-4 |
|
7.2 10-9 |
|
2 10-13 |
|
|
|
|
X2(р-н)+H2O = HOX + H + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
1027 |
|
1015 |
|
1020 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
1029 |
|
10-33 |
|
10-53 |
|
|
|
|
|
|
|
|
|
|
|
|
Константи цієї рівноваги для Х = Cl, Br, I малі (табл.3), особливо для Х = Br, I , тому бром і йод при розчиненні у воді залишаються в основному у молекулярній формі Br2 і I2.
Склад продуктів взаємодії галогенів з водою залежить від рН, можливості виведення зі сфери реакції кінцевих чи вихідних речовин, констант рівноваги і швидкостей реакції диспропорцінування гіпогалогенітів.
Рівновагу (табл.3) можна змістити праворуч додаванням лужних реагентів, наприклад,
Na2CO3:
Cl2 + Na2CO3 + H2O = NaHCO3 + NaCl + HClO ,
Cl2 + NaOH = NaCl + NClO + H2O,
а також додаванням суспензій оксидів ртуті (II) чи бісмуту Bi2O3 для переведення в осад хлорид-іонів:
Cl2 + 2HgO + H2O = HgO . HgСl2 ↓+ 2HClO, 2 Cl2 + Bi2O3 + H2O = 2BiOCl ↓+ 2HClO.
Наведені реакції використовують для одержання HClO, HBrO, HIO.
Швидкість реакції взаємодії хлору з водою сильно залежить від температури. Так під час дії хлору на охолоджений розчин лугу утворюються гіпохлорити, наприклад, щавелева вода:
2NaOH + Cl2 NaClO + NaCl +H2O.
Під час взаємодії хлору з неохолодженим розчином лугу відбувається розігрів розчину та утворюються хлорати, наприклад бертолетова сіль KClO3:
6KOH + 3Cl2 KClO3 +5KCl + 3H2O.
Таким чином, сукупність термодинамічних і кінетичних факторів зумовлює наступний склад

продуктів взаємодії у системі Cl2+H2O: розчинений у воді хлор (його найбільше), HCl, HClO, HClO3. У процесі насичення хлором холодної води (0–20 оС) частина молекул Cl2 диспропорціонує:
Cl2 + H2O = HCl + HClO,
при цьому кислотність розчину поступово зростає. Комбінуючи потенціали Ео реакції Cl2 + 2e → 2Cl- , E = 1,36B;
O2 + 4H+ + 4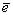 = 2H2O;
= 2H2O; 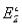 = 1.23 В, можна оцінити й потенціал процесу:
= 1.23 В, можна оцінити й потенціал процесу:
Cl2 + H2O = 2HCl + О2; 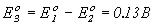 .
.
Тому під час зберігання водного розчину хлору на холоді з нього повільно виділяється кисень, а концентрація HClO зменшується, причому сонячне світло прискорює розкладання. У процесі насичення хлором гарячої води (>20 оС) розчинність хлору істотно зменшується, а замість HClO у розчині накопичується хлорнувата кислота HClO3.
Бром і йод взаємодіють з водою аналогічно хлору. Однак збільшення розмірів атома
галогену та аніона 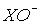 веде до підвищення швидкості диспропорціонування. Тому, незважаючи на велике значення константи рівноваги реакції 3 (табл.3), її швидкість під час
веде до підвищення швидкості диспропорціонування. Тому, незважаючи на велике значення константи рівноваги реакції 3 (табл.3), її швидкість під час
переходу від хлору до брому та йоду істотно збільшується. У результаті іон  в розчинах можна виявити лише при температурі нижче 0 °С. Швидкість диспропорціонування іона
в розчинах можна виявити лише при температурі нижче 0 °С. Швидкість диспропорціонування іона
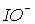 велика при будь-якій температурі, тому в розчинах він не існує. Крім того, поява HХ підвищує кислотність і зміщує рівновагу 2 (табл.3) ліворуч. Таким чином, бром та йод під час розчинення у воді залишаються у формі Br2 і I2.
велика при будь-якій температурі, тому в розчинах він не існує. Крім того, поява HХ підвищує кислотність і зміщує рівновагу 2 (табл.3) ліворуч. Таким чином, бром та йод під час розчинення у воді залишаються у формі Br2 і I2.
Від фтору до йоду окисна здатність зменшується, а відновна – збільшується. Як приклад розглянемо процеси, що перебігають під час пропускання хлору у водний розчин йодиду калію KI. Спочатку хлор, як більш сильний окисник, витісняє йод із йодиду калію, що веде до появи забарвлення:
2KI + Cl2 = I2 + 2KCl.
Далі надлишок хлору окиснює йод, і розчин при цьому знебарвлюється:
I2 + Cl2 +6H2O = 2HIO3 + 10HCl.
Другим прикладом відновних властивостей йоду може бути утворення йодноватої кислоти
HIO3:
3I2(тв.) + 10HNO3(конц) = 6HIO3 + 10NO2 + 2H2O.
Фізичні властивості гідрогенгалогенідів
Розглянемо фізичні властивості гідрогенгалогенідів, використовуючи табл.4. У міру зростання розмірів атомів галогенів міжатомна відстань Н–Х збільшується, енергія зв’язку Н–Х зменшується. Зменшення енергії зв’язку Н–Х веде до підвищення значень ентальпій утворення в ряді HF–HI, наприклад: HI у стандартних умовах утворюється з простих речовини вже з поглинанням тепла (табл.4).
Таблиця 4. Властивості гідрогенгалогенідів
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Межатомна |
|
Езв’язку |
|
fHo298 |
|
Дипольний |
|
рКа |
|
Тпл,оС |
|
Ткип,оС |
|
|
|
|
відстань |
|
кДж/моль |
|
кДж/моль |
|
момент, D |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
rе ( |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HF |
|
0.92 |
|
|
565 |
|
-271 |
|
1.91 |
|
3.2 |
|
-83.4 |
|
+19.7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
1.28 |
|
|
431 |
|
-92 |
|
1.03 |
|
-7.0 |
|
-114.3 |
|
-85.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HBr |
|
1.41 |
|
|
364 |
|
-36 |
|
0.79 |
|
-9.5 |
|
-86.9 |
|
-66.8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HI |
|
1.60 |
|
|
297 |
|
+27 |
|
0.42 |
|
-10 |
|
-50.9 |
|
-35.4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Молекули HХ полярні. Дипольні моменти зменшуються в ряді HF–HI.
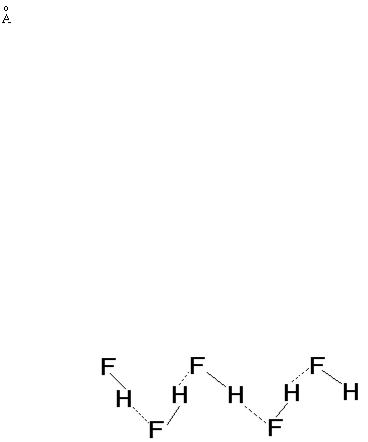
У стандартних умовах гідрогенгалогеніди – гази. З ростом маси та розмірів молекул посилюється міжмолекулярна взаємодія і, як наслідок, підвищуються температури плавлення (Тпл) та кипіння (Ткип). Однак для HF величини Тпл і Ткип, утворені екстраполяцією в ряді однотипних сполук HF–HCl–HBr–HI, будуть істотно нижче, ніж експериментальні (табл.4). Аномально високі температури плавлення та кипіння пояснюються посиленням міжмолекулярної взаємодії за рахунок утворення водневих зв’язків між молекулами HF.
Твердий HF складається із зигзагоподібних полімерних ланцюгів. У рідкому та газоподібному HF, майже до 60 оС, присутні полімери від (HF)2 до (HF)6. Для HCl, HBr, HI утворення водневих зв’язків не є характерним через меншу електронегативність атома галогену.
Хімічні властивості гідрогенгалогенідів
Розчинність у воді. Завдяки високій полярності газоподібні НХ добре розчинні у воді, наприклад: в 1 об’ємі води при 0 оС розчиняються 507 об’ємів HCl чи 612 об’ємів HBr. Під час охолодження з водних розчинів виділені кристалічні гідрати HF, H2O, HCl, 2H2O та ін.,
які побудовані з відповідних галогенідів оксонію, наприклад: 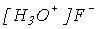 .
.
Кислотні властивості. У водних розчинах НХ встановлюється протолітична рівновага:
HX + HOH = 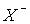 + H3O+ (X = F, Cl, Br, I), (1). Таким чином ці розчини є кислотами.
+ H3O+ (X = F, Cl, Br, I), (1). Таким чином ці розчини є кислотами.
У ряді HCl – HBr – HI ступінь протолізу, тобто сила кислот зростає (див. показники рКa у табл.4), що пов’язано з ростом розмірів аніона 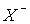 і зменшенням енергії гетеролітичного
і зменшенням енергії гетеролітичного
розпаду НХ(р-р)= Н+(р-р) + 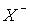 (р-р). Водні розчини HCl, HBr і HI поводять себе як сильні кислоти. У розбавлених водних розчинах HF є слабкою кислотою (рКа = 3.2), що пов’язано з високою енергією зв’язку H–F порівняно з енергією зв’язку H–О у молекулі води. Однак у разі підвищення концентрації HF понад 1 моль/л сила кислоти зростає. За рахунок утворення водневого зв’язку утворюються іони HF-2:
(р-р). Водні розчини HCl, HBr і HI поводять себе як сильні кислоти. У розбавлених водних розчинах HF є слабкою кислотою (рКа = 3.2), що пов’язано з високою енергією зв’язку H–F порівняно з енергією зв’язку H–О у молекулі води. Однак у разі підвищення концентрації HF понад 1 моль/л сила кислоти зростає. За рахунок утворення водневого зв’язку утворюються іони HF-2:
HF + F - → HF-2; К = 3.86 (25 оС) і тому рівновага (1) зміщується праворуч. Особливістю гідроген фториду та плавикової кислоти є здатність роз’їдати скло:
