
- •Із принципу Ле Шательє - Брауна випливає:
- •а) у разі збільшення концентрації однієї з реагуючих речовин рівновага зміщується у бік витрачання цієї речовини, а в разі зменшення концентрації – у бік її утворення;
- •в) під час підвищення температури рівновага зміщується у бік перебігу ендотермічної реакції, під час зниження температури – екзотермічної реакції.
- •Чинники, що впливають на швидкість хімічної реакції:
- •Загальна характеристика галогенів
- •Методи синтезу гідрогенгалогенідів
1. ЗАГАЛЬНА ХІМІЯ
ЗМ 1.1. Основні хімічні поняття. Речовина
Усі предмети, що нас оточують, називаються тілами. Тіла можуть мати природне походження (наприклад, камінь, сніжинка) або можуть бути створені людиною (зошит, літак). Те, з чого складається тіло, називають речовиною. Наприклад, склянка складається зі скла, дріт – із міді, ложка – з алюмінію. Скло, мідь, алюміній – це речовини.
Зараз відомо понад двадцять мільйонів речовин. Усі речовини вивчаються, класифікуються та одержують власну назву. У широкому розумінні речовина – це будь-який вид матерії, що має власну масу, наприклад, елементарні частинки. У хімії поняття речовини є більш вузьким, а саме: речовина – це будь-яка сукупність атомів і молекул. Речовини, які використовують у хімічних експериментах, називають хімічними реактивами. Термін матеріал має практичний відтінок. Матеріал – це речовина або суміш речовин, що використовуються для виготовлення предметів. Матеріали можуть бути природного походження, наприклад, пісок, деревина, мармур, а також можуть бути створені людиною (цемент, скло, чавун, поліетилен).
Кожній індивідуальній речовині притаманні певні фізичні та хімічні властивості. До найважливіших фізичних властивостей належать запах, колір, смак, твердість, температури кипіння та плавлення, густина, розчинність у воді, ковкість, пластичність, здатність проводити тепло та електричний струм. Під час вимірювання чи спостереження фізичних властивостей речовин не відбувається зміни хімічного складу речовин.
При описанні речовин зазначають умови, за яких були виміряні їх фізичні властивості. Агрегатний стан речовини – це якісно відмінні стани даної речовини. Відмінність зумовлюється будовою речовини. Розрізняють три основні агрегатні стани речовини:
твердий, рідкий і газоподібний.
Усі хімічні речовини складаються з частинок, класифікація яких у хімії є досить складною. Хімічні перетворення пов’язують насамперед із такими частинками як атом, молекула, ядро, електрон, протон, нейтрон, йон.
Вважають, що атом є найменшою хімічною частинкою речовини. Атом – це електронейтральна система взаємодіючих елементарних частинок, що складається з позитивно зарядженого ядра та негативно заряджених електронів. Ядро атома утворене протонами, які мають позитивний заряд, та нейтронами, які не мають заряду. Експериментально встановлено, що атом є електронейтральним, оскільки позитивний заряд усіх протонів компенсує негативний заряд усіх електронів у атомі. Отже, кількість електронів у атомі дорівнює кількості протонів у його ядрі. Величина заряду ядра атома дорівнює кількості протонів у атомі.
Наприклад, в атомі Оксигену вісім протонів. Отже, величина заряду ядра його атома плюс вісім. А навколо ядра розташовано вісім електронів.
Усі речовини можна поділити на речовини молекулярної й немолеклярної будови. Атоми можуть з’єднуватись між собою, утворюючи при цьому молекули. Молекула – це електронейтральна найменша сукупність атомів, що утворюють певну структуру за допомогою хімічних зв’язків. Молекули можуть складатися з атомів як тільки одного хімічного елемента, так і різних хімічних елементів. Наприклад, молекула водню Н2
складається з двох атомів Гідрогену, а молекула води Н2О складається з двох атомів Гідрогену та одного атома Оксигену.
Окрім електронейтральних атомів і молекул, існують одноабо багатоатомні заряджені частинки, які називають іонами. Позитивно заряджені іони утворюються з атома, якщо він втрачає певне число електронів. Негативно заряджені іони утворюються з атома, якщо він приєднує певне число електронів. Позитивно заряджені іони називають катіонами, а негативно заряджені – аніонами. Наприклад, якщо атом Калія втрачає один електрон, він перетворюється на катіон K+, а якщо атом Флуору приєднує один електрон, він перетворюється на аніон F-. Знак і величину заряду іона позначають правим верхнім індексом.
Хімічний елемент – це певний тип атомів, що характеризується однаковим зарядом ядра. Кожний хімічний елемент має власну назву та власний символ. Найменування та символи елементів – це хімічна азбука, що дозволяє описати склад будь-якої речовини хімічною формулою. У Стародавньому Єгипті деякі речовини мали символічні зображення, які виражали цілі слова або поняття. У середні віки нараховувалось декілька тисяч алхімічних символів. Згодом англійський хімік Дж. Дальтон замінив алхімічні символи хімічними знаками. Він позначив атом кожного елемента кружечком, а на полі зображення позначав або крапки та рисочки, або початкові літери англійських назв елементів. Це виявилось незручним для друкування, тому в 1814 році шведський учений Й. Я. Берцеліус увів тільки літерну систему знаків. Знаки хімічних елементів було складено з першої літери або з першої та якоїсь із наступних літер їх латинських назв.
Сучасні українські назви хімічних елементів є власними, тому їх пишуть із великої літери. Нині відомо понад 112 хімічних елементів. Усі вони увійшли до періодичної системи хімічних елементів Д. І. Менделєєва.
Валентність – це властивість атома хімічного елемента утворювати певне число хімічних зв’язків. Валентність завжди дорівнює певному цілому числу (від одного до восьми) та записується римськими цифрами. Атоми хімічних елементів можуть мати як сталі валентності, так і змінні. Атоми таких хімічних елементів, як Гідроген, Натрій, Калій, Флуор, виявляють сталу валентність один. Атоми Оксигену, Берилію, Магнію, Кальцію, Барію, Цинку виявляють сталу валентність два. Атоми Алюмінію та Бору виявляють сталу валентність три. Атоми інших хімічних елементів виявляють змінну валентність.
Валентність хімічних елементів можна визначити за таблицею Д. І. Менделєєва. Максимальна валентність хімічного елемента збігається з номером групи, в якій розташований хімічний елемент. Номер групи позначається римською цифрою над відповідним вертикальним стовпчиком періодичної системи. Наприклад, хімічний елемент Карбон знаходиться в четвертій групі, а Хлор – у сьомій. Отже, вища валентність Карбону чотири, а Хлору – сім. Але для деяких елементів це правило не виконується. Наприклад, незважаючи на номер групи, вища валентність Нітрогену – чотири, Оксиген має сталу валентність два, Флуор – один.
Валентність неметалічного елемента у сполуці з Гідрогеном або з металічним елементом дорівнює різниці між числом вісім і номером групи, в якій розташований цей неметалічний елемент. Наприклад, у сполуці РН3, Фосфор, який знаходиться в п’ятій групі, виявляє валентність три (вісім мінус п’ять дорівнює три).
За відомим значенням валентності одного хімічного елемента у бінарній сполуці можна визначити валентність іншого хімічного елемента. Для цього треба пам’ятати, що сумарна валентність атомів одного хімічного елемента дорівнює сумарній валентності атомів іншого хімічного елемента. Тобто добуток валентності хімічного елемента на його індекс у формулі для кожного елемента, що входить до неї, має однакове значення. Наприклад, визначимо валентність Карбону в сполуці СО2. Пам’ятаючи, що Оксиген двовалентний, знаходимо сумарну валентність атомів Оксигену, помноживши його валентність на індекс: два помножити на два дорівнює чотири. Поділимо сумарну валентність Оксигену на кількість атомів Карбону: чотири поділити на один дорівнює чотири. Одержане число чотири і є значенням валентності Карбону. Пам’ятаємо, що валентність позначається римською цифрою над символом елемента.
Під час складання формул бінарних сполук за валентністю елемента необхідно послідовно дотримуватись таких правил:
1.Записати складові частини формули хімічними символами.
2.Позначити валентності хімічних елементів римськими цифрами над їх символами.
3.Знайти найменше спільне кратне для значень валентностей заданих хімічних елементів. Записати його значення арабською цифрою зверху між значеннями валентностей.
4.Поділити найменше спільне кратне на валентності кожного з елементів та записати одержані чисельні значення нижніми індексами біля символів елементів праворуч.
5.Перевірити правильність складання формули сполуки, користуючись тим, що сумарна валентність атомів одного хімічного елемента дорівнює сумарній валентності атомів іншого хімічного елемента.
Наприклад, складемо формулу Феруму з Оксигеном, у якій Ферум виявляє валентність три.
1.Записуємо хімічні символи Феруму та Оксигену.
2.Позначаємо над Ферумом валентність три, над Оксигеном – значення сталої валентності два.
3.Знаходимо найменше спільне кратне для чисел три та два. Одержуємо число шість та записуємо його арабською цифрою зверху між значеннями валентностей елементів.
4.Поділимо шість на три (валентність Феруму) та одержимо число два. Запишемо його нижнім індексом біля символу Fe. Поділимо шість на два (валентність Оксигену) та одержимо число три. Запишемо його нижнім індексом біля символу О.
5. Перевіримо правильність складання формули сполуки, помноживши індекси на валентності відповідних елементів. Порівняємо одержані добутки: два помножити на три дорівнює шість (для Феруму) та три помножити на два дорівнює шість (для Оксигену). Отже, формулу Fe2O3 складено правильно.
Фізичними явищами називають такі перетворення речовин, унаслідок яких не утворюються нові сполуки. До фізичних явищ належать: зміна агрегатного стану речовини (плавлення, кипіння, кристалізація), утворення звуку (під час вибуху), зміна кольору речовини, виділення теплоти, появу світла.
Хімічними називають такі явища, внаслідок яких відбувається зміна хімічного складу вихідних речовин. Хімічні явища називаються хімічними перетвореннями, або хімічними реакціями. У ході хімічних реакцій вихідні речовини перетворюються на інші речовини, які виявляють інші властивості. Хімічні реакції можуть супроводжуватись зовнішніми
ефектами. До таких зовнішніх ефектів належать: виділення теплоти (іноді – світла), зміна забарвлення, поява запаху, утворення осаду, виділення газу.
Наприклад, під час кипіння води відбувається зміна агрегатного стану води (із рідкого на газоподібний), тому кипіння води є фізичним явищем. Під час скисання молока відбувається біохімічний процес перетворення лактози за допомого бактерій на молочну кислоту, тому скисання молока є хімічним явищем. Під час горіння свічки відбувається процес взаємодії парафіну (хімічна речовина, з якої виготовляють свічки) з киснем, тому горіння свічки належить до хімічних явищ. Проте горіння (світіння) лампочки є фізичним явищем.
В описі хімічних реакцій використовують такі поняття як реагенти та продукти реакції. Реагенти – вихідні речовини, які вступають у хімічну реакцію. Продукти реакції – речовини, які утворюються внаслідок взаємодії реагентів. Суть хімічних реакцій полягає в перегрупуванні атомів, які входять до складу реагуючих речовин. Наприклад, при горінні сірки атоми Сульфуру, з яких складається молекула сірки, об’єднуються з атомами Оксигену, з яких складається молекула кисню, і утворюється нова речовина – сірчистий газ SO2.
ЗМ 1.2. Хімічна реакція
Закон збереження маси речовин був сформульований у вигляді загальної концепції російським ученим М. В. Ломоносовим у 1748 році й підтверджений експериментально ним самим у 1756 році, а також незалежно від нього А. Лавуазьє у 1789 році. Досліди зі спалювання речовин, які проводились до Ломоносова, приводили до висновків, що маса речовин у процесі реакції не зберігається. Ломоносов провів простий дослід, який довів, що горіння металу є реакцією приєднання, а зростання маси металу відбувається за рахунок приєднання частини повітря. Він прожарював метали у запаяній скляній посудині та виявив, що маса посудини не змінюється, хоча хімічна реакція відбулась. Після того як посудину було відкрито, туди потрапило повітря, і маса посудини збільшилась. Отже, під час вимірювання мас усіх учасників реакції з’ясовується, що маса речовин у ході хімічної реакції зберігається. Сучасне формулювання закону збереження маси таке: маса речовин, які вступили у хімічну реакцію, дорівнює масі речовин, які утворились внаслідок реакції.
Закон є формою наукових знань. Дослідники на підставі виявлених закономірностей формулюють закон – їх словесний або математичний вираз. Закон збереження маси мав велике значення для подальшого розвитку хімічної науки. Він підтвердив, що атоми є неподільними та під час хімічних реакцій не змінюються. Молекули під час реакцій обмінюються атомами, але загальне число атомів кожного виду не змінюється, тому загальна маса речовин у процесі реакції зберігається.
Закон збереження маси речовин у хімічних реакціях ілюструють хімічні рівняння. Хімічним рівнянням називають умовний запис хімічної реакції за допомогою хімічних формул, математичних знаків і коефіцієнтів. Коефіцієнти записують перед формулами речовин. Призначення коефіцієнтів полягає у тому, щоб збільшувати число атомів кожного елемента для зрівнювання їх в обох частинах хімічного рівняння. Складати рівняння хімічних реакцій необхідно у певній послідовності. Як приклад розглянемо хімічне рівняння синтезу амоніаку NH3.
1.Складаємо схему взаємодії: ліворуч записуємо формули вихідних речовин (реагентів), ставлячи між ними знак «плюс». Праворуч записуємо формулу продукту реакції. Між лівою та правою частинами схеми ставимо знак «стрілка».
N2+H2 → NH3.
2.Зрівняємо кількість атомів Нітрогену, поставивши коефіцієнт два перед формулою NH3:
N2+H2 → 2NH3.
3. Зрівняємо кількість атомів Гідрогену, поставивши коефіцієнт три перед формулою H2. Порівняємо кількості атомів кожного елемента у лівій і правій частинах схеми. Оскільки вони однакові, замість знаку «стрілка» поставимо знак «дорівнює»:
N2+3H2 = 2NH3.
Треба пам’ятати, що під час перетворення схеми хімічної реакції на рівняння індекси у формулах як реагуючих речовин, так і продуктів реакцій змінювати не можна. Перетворення речовин, що супроводжуються зміною їхнього складу і (або) будови, називаються хімічними реакціями.
У хімічних реакціях з одних речовин виходять інші. Вихідні речовини, що вступають у хімічну реакцію, називаються реагентами, а нові, що утворюються внаслідок такої реакції, – продуктами реакції.
Хімічні реакції завжди супроводжуються фізичними ефектами, які називаються ознаками хімічної реакції.
Ознаки хімічних реакцій, що зустрічаються найчастіше:
–поглинання або виділення теплоти;
–зміна забарвлення реакційної суміші;
–утворення або розчинення осаду;
–виділення або поглинання газу;
–поява або зникнення запаху.
Умови виникнення й перебігу хімічних реакцій:
–контакт між реагуючими речовинами (реагентами);
–підтримка певного температурного режиму;
–здрібнення та перемішування реагентів у твердому стані;
–підвищення тиску реагентів у газоподібному стані;
–опромінення реагентів видимим світлом або ультрафіолетовими променями.
Зворотні реакції не відбуваються до кінця і закінчуються встановленням хімічної рівноваги
– такого стану системи реагуючих речовин, за якого швидкості прямої та зворотної реакцій однакові.
Стан хімічної рівноваги можна змістити в той або інший бік зміною зовнішніх умов: температури, тиску, концентрації речовин, що беруть участь у реакції. Ці зміни визначаються принципом динамічної рівноваги – принципом Ле Шательє -
Брауна: зовнішня дія на рівноважну систему зміщує рівновагу в напрямі ослаблення ефекту цієї дії.
Із принципу Ле Шательє - Брауна випливає:
а) у разі збільшення концентрації однієї з реагуючих речовин рівновага зміщується у бік витрачання цієї речовини, а в разі зменшення концентрації – у бік її утворення;
б) зміна тиску зміщує рівновагу тільки в газових системах. Зі збільшенням тиску рівновага зміщується у бік зменшення об’єму (кількості речовини) газоподібних речовин, із зменшенням тиску – у бік збільшення об’єму (кількості речовини) газоподібних речовин. Якщо реакція проходить без зміни числа молекул (кількості речовини) газоподібних речовин, то тиск не впливає на стан рівноваги;
в) під час підвищення температури рівновага зміщується у бік перебігу ендотермічної реакції, під час зниження температури – екзотермічної реакції.
Чинники, що впливають на швидкість хімічної реакції:
1)природа реагуючих речовин;
2)агрегатний стан реагуючих речовин;
3)концентрація реагуючих речовин.
Каталізатори – це речовини, що змінюють швидкість хімічної реакції. Каталізатор у процесі реакції не витрачається і до складу кінцевих продуктів не входить. Позитивний каталіз – прискорення реакції. Негативний каталіз (або інгібування) – уповільнення реакції.
ЗМ 1.3. Періодичний закон і Періодична система хімічних елементів Д. І. Менделєєва
Періодична система хімічних елементів – це класифікація хімічних елементів, яка заснована на певних особливостях будови їх атомів. Її було складено на основі Періодичного закону, відкритого у 1869 році Д. І. Менделєєвим. У той час Періодична система містила 63 хімічних елементи й за виглядом відрізнялась від сучасної. Нині до Періодичної системи входять близько ста двадцяти хімічних елементів.
Періодичну систему складено у вигляді таблиці, в якій хімічні елементи розташовані у певному порядку: за зростанням їх атомних мас. Зараз існує багато видів зображення Періодичної системи. Найбільш поширеним є зображення у вигляді таблиці з розташуванням елементів зліва направо. Усі хімічні елементи у Періодичній системі об’єднані у періоди та групи. Періодична система включає сім періодів і вісім груп.
Періодами називають горизонтальні ряди хімічних елементів. Вертикальні стовпчики хімічних елементів утворюють групи хімічних елементів. Перший, другий і третій періоди називають малими, оскільки вони містять невелику кількість елементів (перший – два
елементи, другий і третій – по вісім елементів). Усі інші періоди називають великими (четвертий та п’ятий містять по вісімнадцять елементів, шостий та сьомий – по тридцять два елементи). У нижній частині таблиці Д. І. Менделєєва розташовані хімічні елементи, що утворюють родину лантаноїдів і родину актиноїдів. Усі ці елементи формально входять до складу третьої групи та йдуть після хімічних елементів Лантану (номер 57) і Актинію (номер 89). Кожна група таблиці Д. І. Менделєєва складається з двох підгруп: головної та побічної. До складу головних підгруп входять елементи як малих, так і великих періодів, тобто головні підгрупи починаються або з першого, або з другого періоду. До складу побічних підгруп входять елементи лише великих періодів, тобто побічні підгрупи починаються лише з четвертого періоду.
Кожна клітина таблиці Д. І. Менделєєва з хімічним символом містить інформацію, яка характеризує будову атома хімічного елемента. Ціле число у клітині з символом хімічного елемента в таблиці Д. І. Менделєєва – це порядковий номер хімічного елемента. Символ хімічного елемента та його порядковий номер завжди записуються в одному з верхніх кутів клітини.
Порядковий номер хімічного елемента показує число протонів у ядрі атому та, відповідно, значення заряду ядра атома цього елемента. У цьому полягає його фізичний зміст. Число електронів у атомі дорівнює числу протонів, оскільки атом у цілому є електронейтральним.
Знайдемо у періодичній системі хімічний елемент Натрій. Із запису у клітині визначаємо, що порядковий номер дорівнює 11. Отже, заряд ядра атома Натрію дорівнює плюс 11. Ядро атома містить 11 протонів. Простір навколо ядра заповнюють 11 електронів.
Історичні відомості про спроби класифікації елементів. Поняття про лужні, інертні елементи, галогени
У 60-х XIX століття було відомо 63 хімічних елементи. До їх числа входили такі відомі здавна елементи, як Аурум, Аргентум, Оксиген, Гідроген, Сульфур та інші. Перші спроби класифікації хімічних елементів були засновані на різко виражених протилежних властивостях простих речовин (металів і неметалів), утворених хімічними елементами.
Пізніше було з’ясовано, що існують групи споріднених за властивостями елементів, які було названо природними групами. Наприклад, в одну з природних груп були об’єднані такі хімічні елементи, як Літій - Li, Натрій - Na та Калій - K, а пізніше ще й Рубідій - Rb та Цезій - Cs. Ці хімічні елементи утворюють прості речовини – метали, які є м’якими, пластичними, мають металічний блиск, дуже добре проводять тепло та електричний струм. Ці метали у порівнянні з усіма іншими металами відрізняються найбільшою хімічною активністю. Оксиди цих металів (Li2O, Na2O, K2O, Rb2O, Cs2O) виявляють яскраво виражені основні властивості. Цим оксидам відповідають розчинні у воді основи – луги (LiOH, NaOH, KOH, RbOH, CsOH). Ці метали, об’єднані в одну природну групу, отримали назву лужних металів.
В іншу природну групу споріднених за властивостями елементів було включено Хлор Cl, Бром Br, Йод I, а пізніше Флуор F. Ці хімічні елементи утворюють прості речовини – неметали. За звичайних умов прості речовини фтор та хлор є газами, бром – рідиною, йод – кристалічною речовиною. Ці неметали порівняно з усіма іншими неметалами відрізняються найбільшою хімічною активністю. Під час взаємодії з металами вони утворюють солі (натрій
хлорид NaCl, магній бромід MgBr2, калій йодид KI). Ці неметали, об’єднані в одну природну групу, здобули назву галогенів (з грецької «ті, що народжують солі»).
Крім лужних металів і галогенів, була відома ще група інертних елементів, які у вигляді простих речовин утворюють благородні гази. До цієї групи належать хімічні елементи Гелій He, Неон Ne, Аргон Ar, Криптон Kr, Ксенон Xe, Радон Rn. Елементи цієї групи є межею між галогенами та лужними металами.
Знаходження природних груп подібних за властивостями елементів було важливим етапом класифікації елементів. Проте це не вирішувало головного завдання – природної класифікації всіх елементів, як схожих, так і несхожих за властивостями. До кінця 60-х XIX століття було зроблено понад 50 спроб класифікації хімічних елементів. Найближче до відкриття періодичного закону підійшов Л. Мейєр. Він опублікував у 1864 році таблицю, в якій розмістив 44 із 63 відомих елементів у шести групах відповідно до зростання атомних мас і за їх вищою валентністю у сполуках з Гідрогеном, а в 1868 році опублікував свою таблицю елементів, у якій уперше вказав періоди. Головними недоліками робіт Л. Меєра були відсутність наукової основи класифікації елементів і відсутність причини періодичної зміни властивостей елементів та їх сполук.
Дмитро Іванович Менделєєв, як і його попередники, основною характеристикою елемента вибрав його атомну масу (атомну вагу). Але на відміну від попередників, Д. І. Менделєєв шукав закономірність у зміні атомних мас не лише у схожих елементів, а й у несхожих. Мета його пошуків полягала у знаходженні закономірності, яка б об’єднувала усі елементи в єдину систему. Учений прийшов до відкриття Періодичного закону внаслідок зіставлення властивостей та відносних атомних мас елементів різних природних груп, таких як лужні метали, лужноземельні метали, галогени, група Оксигену, група Нітрогену, група Карбону. Д. І. Менделєєв розташовував природні групи так, щоб елементи кожної з двох сусідніх груп мали близькі значення відносних атомних мас. У результаті він оформив таблицю, яка стала прообразом сучасної періодичної таблиці елементів. Потім природні групи елементів були покладені в основу періодичної таблиці, а ряди елементів, які розташовані у порядку поступового зростання значень відносних атомних мас, – в основу періодів таблиці.
Порівнюючи хімічні властивості відомих на той час галогенів, лужних і лужноземельних металів, Д. І. Менделєєв зробив висновок, згідно з яким у разі збільшення атомних мас елементів із переходом від галогенів до лужних металів, а потім від лужних до лужноземельних, хімічні властивості простих речовин кожного разу закономірно змінюються від неметалічних (у галогенів) до виражених металічних (у лужних металів). Під час переходу від лужних до лужноземельних металів металічні властивості зменшуються. Отже, Д. І. Менделєєв довів, що у разі збільшення атомних мас хімічні властивості елементів та їх сполук, а також хімічні властивості відповідних простих речовин змінюються закономірно, періодично повторюючись через певне число елементів.
У 1869 році Д. І. Менделєєв сформулював Періодичний закон, згідно з яким властивості простих тіл, а також форми та властивості сполук елементів знаходяться у періодичній залежності від величини атомних мас елементів.
На основі відкриття Періодичного закону і створення Періодичної системи Д. І. Менделєєв передбачив існування шести невідомих елементів та описав їх властивості. Згодом ці елементи було відкрито: спочатку відкрили Скандій, Галій та Германій, потім Технецій,
Реній та Полоній. Властивості цих елементів і властивості сполук, які вони утворюють, були дуже близькі до властивостей описаних Д. І. Менделєєвим. Відкриття Періодичного закону сприяло подальшому бурхливому розвитку хімії: за наступні тридцять років було відкрито 20 нових хімічних елементів. Періодичний закон сприяв подальшому вивченню будови атома, внаслідок якого було встановлено взаємозв’язок будови атомів з періодичною зміною їх властивостей. Періодичний закон Д. І. Менделєєва має загальнонаукове значення та є фундаментальним законом природи.
Особливу схожість властивостей проявляють елементи, що знаходяться всередині великих періодів, наприкінці кожного парного ряду. Це так звані тріади: Ферум – Кобальт – Нікол, яка утворює родину Феруму; Рутеній – Родій – Палладій та Осмій – Іридій – Платина, які утворюють родину платинових металічних елементів (платиноїдів).
У нижній частині таблиці Д. І. Менделєєва розташовані хімічні елементи, які утворюють родину лантаноїдів та родину актиноїдів. Усі ці елементи формально входять до складу третьої групи та розташовані після хімічних елементів Лантану (номер 57) і Актинію (номер 89). Періодична система елементів містить десять рядів. Малі періоди (перший, другий і третій) складаються з одного ряду, великі періоди (четвертий, п’ятий та шостий) містять по два ряди кожний. У сьомому періоді знаходиться один ряд.
Кожний великий період складається з парного й непарного рядів. У парних рядах містяться елементи-метали, у непарних рядах властивості елементів змінюються від металічних до виражених неметалічних. Кожна група таблиці Д. І. Менделєєва складається з двох підгруп: головної та побічної. До складу головних підгруп входять елементи як малих, так і великих періодів, тобто головні підгрупи починаються або з першого, або з другого періоду. До складу побічних підгруп входять елементи лише великих періодів, тобто побічні підгрупи починаються лише з четвертого періоду.
Характеристика хімічних елементів малих періодів за їх місцем у Періодичній системі та будовою атома
Знаючи формулювання Періодичного закону і використовуючи Періодичну систему елементів Д. І. Менделєєва, можна дати характеристику будь-якого хімічного елемента і його сполук. Таку характеристику хімічного елемента зручно складати за планом.
I. Символ хімічного елемента і його назва.
II. Положення хімічного елемента у Періодичній системі елементів Д. І. Менделєєва:
1)порядковий номер;
2)номер періоду;
3)номер групи;
4)підгрупа (головна чи побічна).
III. Будова атома хімічного елемента:
1)заряд ядра атома;
2)відносна атомна маса хімічного елемента;
3)число протонів;
4)число електронів;
5)число нейтронів;
6)число електронних рівнів у атомі.
IV. Електронна та електронно-графічна формули атома, його валентні електрони. V. Тип хімічного елемента (метал чи неметал, s-, p-, d- або f-елемент).
VI. Формули вищого оксиду та гідроксиду хімічного елемента, характеристика їх властивостей (основні, кислотні чи амфотерні).
VII. Порівняння металічних чи неметалічних властивостей хімічного елемента з властивостями елементів-сусідів за періодом та підгрупою.
VIII. Максимальний та мінімальний ступінь окиснення атома.
Наприклад, дамо характеристику хімічного елемента з порядковим номером 15 та його сполук за положенням у Періодичній системі елементів Д. І. Менделєєва і будовою атома.
I. Знаходимо у таблиці Д. І. Менделєєва клітину з номером хімічного елемента, записуємо його символ і назву.
Хімічний елемент номер 15 – Фосфор. Його символ Р .
II. Охарактеризуємо положення елемента у таблиці Д. І. Менделєєва (номер періоду, групи, тип підгрупи).
Фосфор знаходиться у головній підгрупі V групи, в 3 періоді.
III. Дамо загальну характеристику складу атома хімічного елемента (заряд ядра, атомна маса, число протонів, нейтронів, електронів та електронних рівнів).
Заряд ядра атома Фосфору дорівнює +15. Відносна атомна маса Фосфору дорівнює 31. Ядро атома містить 15 протонів і 16 нейтронів (31 – 15 = 16). Атом Фосфору має три енергетичних рівні, на яких знаходяться 15 електронів.
IV. Складаємо електронну та електронно-графічну формули атома, зазначаємо його валентні електрони.
Електронна формула атома Фосфору: 15P 1s2 2s2 2p6 3s2 3p3.
Електронно-графічна формула зовнішнього рівня атома Фосфору: на третьому енергетичному рівні на 3s-підрівні знаходяться два електрони (в одній клітині записуються дві стрілки, що мають протилежний напрям), на три 3р-підрівні знаходяться три електрони (в кожній з трьох клітин записуються по одній стрілці, що мають однаковий напрям).
Валентними електронами є електрони зовнішнього рівня, тобто 3s2 3p3 електрони. V. Визначаємо тип хімічного елемента (метал чи неметал, s-, p-, d- або f-елемент).
Фосфор – неметал. Оскільки останнім підрівнем в атомі Фосфору, який заповнюється електронами, є p-підрівень, Фосфор належить до родини p-елементів.
VI. Складаємо формули вищого оксиду й гідроксиду Фосфору та характеризуємо їх властивості (основні, кислотні чи амфотерні).
Вищий оксид Фосфору P2O5 виявляє властивості кислотного оксиду. Гідроксид H3PO4, який відповідає вищому оксиду, виявляє властивості кислоти. Підтвердимо зазначені властивості рівняннями відповідних хімічних реакцій:
P2O5 + 3 Na2O = 2Na3PO4;
H3PO4 + 3NaOH = Na3PO4 + 3H2O.
VII. Порівняємо неметалічні властивості Фосфору з властивостями елементів-сусідів за періодом та підгрупою.
Сусідом Фосфору за підгрупою є Нітроген. Сусідами Фосфору за періодом є Силіцій та Сульфур. Неметалічні властивості атомів хімічних елементів головних підгруп зі зростанням порядкового номеру зростають у періодах і знижуються у групах. Тому неметалічні
властивості Фосфору більш виражені, ніж у Силіцію, та менш виражені, ніж у Нітрогену і Сульфуру.
VIII. Визначаємо максимальний та мінімальний ступінь окиснення атома Фосфору. Максимальний позитивний ступінь окиснення для хімічних елементів головних підгруп дорівнює номеру групи. Фосфор знаходиться у головній підгрупі п’ятої групи, тому максимальний ступінь окиснення Фосфору +5. Мінімальний ступінь окиснення для неметалів у більшості випадків дорівнює різниці між номером групи та числом вісім. Отже, мінімальний ступінь окиснення Фосфору –3 .
ЗМ 1.4. Будова атома
Будова атома (ядро та електронна оболонка). Склад атомних ядер (протони і нейтрони). Протонне число. Нуклонне число
Після відкриття Періодичного закону довгий час залишалось незрозумілим, чому властивості елементів знаходяться у періодичній залежності від їхньої відносної атомної маси. Була незрозумілою сама причина періодичності. Необхідно було з’ясувати фізичний зміст Періодичного закону. Це стало можливим після встановлення будови атома. Тривалий час у науці панувало уявлення про те, що атоми є неподіленими частинками. Однак наприкінці ХІХ століття було зафіксовано факти, які свідчили про складну будову атома. Особливу роль відіграло відкриття радіоактивності (самодовільного розпаду атомів деяких елементів).
У1896 році французький фізик А. Беккерель визначив, що матеріали, які містять Уран, засвітлюють у темряві фотопластинку, іонізують гази, викликають свічення речовин. Потім з’ясувалося, що цю здатність має не лише Уран. Польський хімік М. Склодовська-Кюрі разом із фізиком П. Кюрі відкрили два нових радіоактивних елементи: Полоній та Радій. Згодом англійський фізик Е. Резерфорд з’ясував, що радіоактивне випромінювання є неоднорідним та під впливом електричного поля розділяється на α-, β- та γ-промені. α -частинками є ядра атомів Гелію, β-частинки є електронами, а γ-частинки – електромагнітними хвилями. Вивчення радіоактивності підтвердило складність будови атома.
У1911 році Е. Резерфорд під час дослідів з α-частинками з’ясував, що крім електронів кожний атом містить іншу частинку, яку називають ядром атома. Він запропонував ядерну (планетарну) модель атома, згідно з якою атом складається з позитивно зарядженого ядра, дуже малого за розмірами, в якому зосереджена майже вся його маса. Навколо ядра обертаються електрони, як планети навколо Сонця.
Експериментальні факти підтвердили складність будови атома і показали, що атом складається з негативно заряджених частинок – електронів та позитивно зарядженого ядра.
У1932 році російські фізики Д. Д. Іваненко та Є. М. Гапон і, незалежно від них, німецький фізик Гейзенберг запропонували протонно-нейтронну будову атома. Відповідно до цієї теорії атомне ядро складається з протонів і нейтронів. Ці частинки мають спільну назву – нуклони. Протони, нейтрони, так само як і електрони, належать до елементарних частинок. Протон p – це частинка з відносною масою приблизно рівною одиниці та відносним
зарядом +1. Нейтрон n – це електронейтральна частинка з відносною масою приблизно рівною одиниці.
Численні експериментальні дослідження показали, що заряд ядра атома у відносних одиницях дорівнює порядковому номеру елемента у Періодичній системі. Це є фізичним змістом порядкового номера. Число протонів у ядрі Z визначає позитивний заряд ядра, який дорівнює порядковому номеру елемента. Тому порядковий номер елемента називається його протонним числом. Відносна маса ядра складається з маси протонів, яка також дорівнює Z, і маси нейтронів, яка у відносних одиницях дорівнює числу нейтронів N. Оскільки практично вся маса атома зосереджена в ядрі (маса протона практично дорівнює масі нейтрона та в 1836 разів перевищує масу електрона), можна вважати, що відносна атомна маса дорівнює сумі мас протонів і нейтронів: Ar = Z + N
|
|
|
|
|
Ізотопи |
|
|
Ізобари (59 пар) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
Р = const , n – різна |
|
|
|
A = const , n,p – різне |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
3919K, |
4019K |
|
|
|
|
|
|
9638Sr, 9639 Y, 9640Zr |
|||
|
|
|
|
|
|
|
|
|
|
|
|
23992U, |
|
23592 U, |
23892 |
U, |
|
23692 U |
4019K, 4018 Ar, 4020Ca |
||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1Hпротій, |
2 |
1Hдейтерій, |
3 |
1Hтритій, |
4 |
1H (1963p) |
Ізотони |
|||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
n = const, A – різне |
|
|
|
|
|
|
|
|
|
|
|
146C, |
157 N, 168 O |
13856Ba, 13957 La
Оскільки протони та нейтрони мають спільну назву – нуклони, відносна атомна маса визначається загальним числом протонів та нейтронів і називається нуклонним числом. Нуклонне число (відносна атомна маса) та протонне число (порядковий номер) позначаються відповідно верхнім і нижнім індексами зліва від символу елемента. Наприклад, із запису 168 O, визначаємо, що протонне число Оксигену дорівнює восьми, а нуклонне – шістнадцяти.
З’ясуємо, як, користуючись положенням хімічного елемента у Періодичній системі, можна визначити число елементарних частинок (електронів, протонів і нейтронів) у атомі. Знайдемо у Періодичній системі хімічний елемент Алюміній. Із запису в клітині визначаємо, що порядковий номер Алюмінію дорівнює 13, а відносна атомна маса – 27. Отже, заряд ядра атома Алюмінію дорівнює +13. Ядро атома Алюмінію містить 13 протонів та 14 (27 – 13 = 14) нейтронів. Простір навколо ядра заповнюють 13 електронів.
Дослідження будови атома довели, що найстійкішою та найважливішою характеристикою атома є позитивний заряд ядра. Тому згідно із сучасним формулюванням Періодичного закону Д. І. Менделєєва властивості хімічних елементів та їх сполук перебувають у періодичній залежності від зарядів ядер атомів елементів. Таким чином, дослідження будови атомів створили наукову основу Періодичного закону. Нукліди одного елемента – це ізотопи. Більшість хімічних елементів, які зустрічаються у природі, складаються з кількох
нуклідів. Різновиди атомів одного хімічного елемента, які мають однакове протонне число, але відрізняються один від одного числом нейтронів, і, відповідно, нуклонним числом (масою ядра), називають ізотопами. Наприклад, хімічний елемент Гідроген має три ізотопи: протій H (у ядрі один протон і немає нейтронів), дейтерій H або D (в ядрі один протон та один нейтрон) і тритій H або T (в ядрі один протон та два нейтрони). Багато елементів у природі мають по декілька ізотопів. Тому відносна атомна маса елемента вираховується значеннями відносних атомних мас ізотопів з урахуванням їх масової частки у природі.
Наприклад, визначимо середню атомну масу природного Хлору, який знаходиться у вигляді двох ізотопів: 35Cl з масовою часткою 75,5% та 37Cl з масовою часткою 24,5% . Для цього скористаємось формулою:
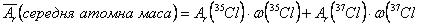 ;
;
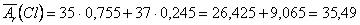 .
.
Усі ізотопи поділяються на стабільні та радіоактивні. Стабільні ізотопи не підлягають радіоактивному розпаду, тому вони зберігаються у природних умовах. Стабільні ізотопи зустрічаються у всіх «парних» елементів і у більшості «непарних» з порядковим номером меншим або рівним вісімдесяти трьом. У елементів, розташованих у Періодичній системі після Бісмуту, всі нукліди є радіоактивними. Радіоактивні ізотопи поділяються, в свою чергу, на природні та штучні. І природні, і штучні ізотопи самодовільно розпадаються, випромінюючи при цьому α- чи β-частинки доти, поки не утвориться стабільний ізотоп. Хімічні властивості всіх ізотопів в основному однакові. Ці властивості визначаються зарядом ядра, а не його масою.
Існує кілька видів радіоактивного розпаду:
- α-розпад – радіоактивний розпад ядер атомів, що супроводжується виділенням α-частинок,
які є ядрами атомів Гелію 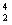 He;
He;
- β-розпад – радіоактивний розпад ядер атомів, що супроводжується випусканням β-
частинок, які є електронами  β; - γ-розпад – розпад атомних ядер, що супроводжується виділенням γ-частинок (електромагнітних хвиль).
β; - γ-розпад – розпад атомних ядер, що супроводжується виділенням γ-частинок (електромагнітних хвиль).
Стійкість кожного радіоактивного ізотопу характеризується періодом напіврозпаду, тобто проміжком часу, протягом якого розпадається половина початкової кількості даного
радіоактивного ізотопу. Період напіврозпаду позначають T або t
або t . Для різних елементів період напіврозпаду може змінюватись від мільйонних часток секунди до мільярдів років. Наприклад, період напіврозпаду Полонію 218Po – три хвилини, Радію 226Ra – тисяча шістсот двадцять років, Урану 238U – майже чотири з половиною мільярдів років. Величина періоду напіврозпаду радіонуклідів – нестійких радіоактивних ізотопів – змінюється для більшості ізотопів від 30 секунд до 10 днів.
. Для різних елементів період напіврозпаду може змінюватись від мільйонних часток секунди до мільярдів років. Наприклад, період напіврозпаду Полонію 218Po – три хвилини, Радію 226Ra – тисяча шістсот двадцять років, Урану 238U – майже чотири з половиною мільярдів років. Величина періоду напіврозпаду радіонуклідів – нестійких радіоактивних ізотопів – змінюється для більшості ізотопів від 30 секунд до 10 днів.
Радіоактивне випромінювання (радіація) небезпечно тим, що воно є невидимим, не має ні запаху, ні смаку, тому людина його ніяк не відчуває. Проте радіоактивне випромінювання (особливо γ-випромінювання) має значну проникаючу здатність. Потрапляючи всередину живих організмів, радіація викликає іонізацію молекул біологічної системи, руйнує клітинні мембрани, вражає клітини кісткового мозку та інше. Це призводить до порушення імунної
системи, зниження здатності організму протистояти різним хворобам. Щоб зменшити вплив радіації на організм людини, не можна застосовувати продукти харчування та питну воду, забруднені радіонуклідами, слід частіше вживати в їжу продукти, здатні поглинати і «виводити» радіонукліди з організму, а саме – яблука, лимони, які містять пектини.
Радіоактивні ізотопи застосовують у медицині для встановлення діагнозу та лікування деяких хвороб. Для діагностики ракових пухлин використовують препарати, в молекулах яких знаходяться атоми радіоактивних елементів, що поглинаються тканиною пухлини. Потім визначають місце локалізації радіоактивного елемента в організмі та знаходження пухлини. Наприклад, для діагностики ракових пухлин застосовують розчин натрій ортофосфату, позначений 32P.
Уявлення про будову атома пройшли складний шлях розвитку. Дуже важливу роль у розвитку теорії будови атома відіграла планетарна модель атома Резерфорда. Проте ця модель не дозволяє пояснити багато властивостей хімічних елементів. Сучасна модель атома базується на уявленнях про мікросвіт – світ частинок мікроскопічних розмірів, які не піддаються законам макросвіту. Тому з’ясувалось, що неможливо простежити рух електрона в атомі, у нього відсутня траєкторія руху. Можна лише говорити про ймовірність знаходження електрона в тому чи іншому місці від ядра. Подібна модель руху електрона дозволяє скласти уявлення про електронну хмару. Простір поблизу ядра, в якому досить велика ймовірність перебування електрона (приблизно 90%), називається орбіталлю. Цей простір обмежується поверхнею, тобто є об’ємною геометричною фігурою. Орбіталі (електронні хмари) відрізняються як розмірами, так і формою. Теоретичні розрахунки довели, що вони можуть мати форму сфери, гантелі та інші форми складнішої будови. Орбіталі, що мають сферичну форму, позначають буквою s, а р - орбіталі, що мають форму гантелі, – буквою p, для більш складних форм позначають буквами d, f тощо. Орбіталі часто зображують квадратом (клітиною). Електрон зображують стрілкою. Крім обертання навколо ядра, для електрона характерний ще рух навколо власної осі – спін. Якщо два електрони мають однакові напрямки обертання, то їх називають електронами з паралельними спінами. Якщо, навпаки, напрямки обертання двох електронів протилежні, то це електрони з антипаралельними спінами. Згідно з принципом Паулі на одній орбіталі може перебувати тільки два електрони, що мають антипаралельні спіни. Схематично ці два електрони зображують в одній клітині двома стрілками, що мають протилежні напрямки.
Електрони електронної оболонки атома розрізняються енергією. Електронні хмари з близькою енергією становлять в атомі електронний шар (енергетичний рівень). Електрони першого, найближчого до ядра шару притягуються до ядра сильніше, ніж електрони другого шару. Відповідно, електрони третього шару притягуються до ядра слабше, ніж електрони другого шару. Кожний електронний шар складається з певного числа обіталей певної форми (електронних підшарів або енергетичних підрівнів), а саме:
∙перший шар складається з однієї  орбіталі, її позначають 1s;
орбіталі, її позначають 1s;
∙другий шар складається з чотирьох орбіталей: однієї s та трьох p орбіталей, їх позначають 2s і 2p;
∙третій шар складається з дев’яти орбіталей: однієї s, трьох p та п’яти d орбіталей, їх позначають відповідно 3s, 3p і 3d.
Оскільки на одній орбіталі може знаходитись тільки два електрони, можна визначити загальне число електронів, що знаходяться на певному енергетичному рівні. Для цього треба скористатися формулою: N = 2 · n2, де N – загальне число електронів на енергетичному рівні, n – номер рівня. Отже, на першому енергетичному рівні може перебувати два електрони, на другому – вісім електронів, на третьому – вісімнадцять електронів.
Знаючи будову електронних шарів, можна уявити структуру всієї електронної оболонки атома. Для цього необхідно користуватися такими правилами:
∙заповнювати електронні шари електронами необхідно від першого шару до наступних згідно з порядком послаблення їх притягування до ядра;
∙заповнювати орбіталі електронами необхідно також у порядку послаблення їх зв’язку з ядром: спочатку необхідно заповнити s - орбіталі, потім p- орбіталі, а потім d - орбіталі;
∙на кожній з орбіталі можна розмістити лише два електрони;
∙на кожній з орбіталі спочатку знаходиться по одному електрону, а потім розміщують по другому електрону, при цьому утворюються електронні пари.
Будова електронної оболонки атома зображується електронною формулою, яка показує розподіл електронів за енергетичними рівнями та підрівнями. У цих формулах енергетичні рівні позначаються цифрами 1, 2, 3, 4,…, а підрівні – буквами s, p, d, f. Число електронів на підрівні позначається цифрою, яка записується справа вгорі від букви, що показує підрівень. Складемо електронні формули атомів хімічних елементів першого періоду. Наприклад, атом Гідрогену має один електрон, який розміщений на s-підрівні першого енергетичного рівня. Електронна формула атома Гідрогену: 1H 1s1.
Електронна формула атома Гелію, що містить два електрони: 2H 1s2.
Перший електронний шар в атомі Гелію є завершеним, оскільки на першому енергетичному рівні може перебувати лише два електрони.
Складемо електронні формули атомів деяких хімічних елементів другого періоду. Після заповнення першого енергетичного рівня електрони заповнюють другий рівень, на якому може розміщуватись не більше восьми електронів. На другому рівні спочатку електрони заповнюють s-підрівень, а потім p-підрівень. Наприклад, електронна формула Нітрогену: 7N
1s2 2s2 2p3. Електронна формула Неону: 10N 1s2 2s2 2p6.
На останньому (другому) енергетичному рівні атома не може знаходитись більше восьми електронів, тому другий енергетичний рівень атома Неону є завершеним.
Складемо електронні формули атомів деяких хімічних елементів третього періоду. В атомах елементів третього періоду формується третій енергетичний рівень, на якому розміщуються до вісімнадцяти електронів. Спочатку електрони заповнюють s-підрівень, потім p-підрівень, заповнення d-підрівня не відбувається. Наприклад, електронна формула Силіцію: 14Si 1s2 2s2
2p6 3s2 3p2. Електронна формула Аргону: 18Ar 1s2 2s2 2p6 3s2 3p6. В атомі Аргону останній енергетичний рівень є завершеним.
У перших двох елементів четвертого періоду починає заповнюватись четвертий енергетичний рівень. Електронна формула Калію: 19K 1s2 2s2 2p6 3s2 3p6 4s1. Електронна формула Кальцію: 20Ca 1s2 2s2 2p6 3s2 3p6 4s2. Починаючи з елемента Скандію (порядковий номер 21) відбувається заповнення електронами d-підрівня третього енергетичного рівня. Електронна формула Скандію: 21Sc 1s2 2s2 2p6 3s2 3p6 4s2 3d1.
Часто користуються скороченими електронними формулами. Наприклад, скорочена електронна формула Сульфуру: 16S [Ne] 3s2 3p4, де [Ne] означає завершену електронну оболонку Неону.
Скорочена електронна формула дозволяє виділити «валентні» електрони, які не входять до оболонки інертного газу. Підрівень, що заповнюється електронами останнім, є ознакою, за якою всі хімічні елементи діляться на чотири сімейства: s-, p-, d- та f-елементи. Наприклад, Калій належить до s-елементів, Силіцій –до p-елементів, а Скандій – до d-елементів.
Електронні формули часто зображують графічно (квантові комірки), використовуючи графічні позначення орбіталей (квадрат або клітина) та електронів (стрілка). Електроннографічні формули показують розподіл електронів не тільки за рівнями і підрівнями, а й за орбіталями. Записують знизу вгору, починаючи з першого енергетичного рівня, на якому знаходиться одна клітина (одна 1s - орбіталь), потім зображують другий енергетичний рівень, який містить чотири клітини (одна 2s-орбіталь та три 2p-орбіталі), а потім – третій енергетичний рівень, який містить дев’ять клітин (одна 3s-орбіталь, три 3p-орбіталі та п’ять 3d-орбіталей). Часто записують не всю графічну формулу, а лише її закінчення, тобто підрівні, на яких розміщені валентні електрони.
Знаючи положення елемента у Періодичній системі, можна визначити його електронну конфігурацію та скласти електронну формулу. Для цього треба пам’ятати наступні закономірності:
∙номер періоду дорівнює числу електронних шарів (енергетичних рівнів) в атомі;
∙номер групи дорівнює числу валентних електронів (електронів зовнішнього рівня);
∙для елементів побічних підгруп ІІІ–VІІ груп номер групи також дорівнює числу валентних електронів, які розташовані як на зовнішньому, так і на внутрішньому електронному шарі.
Розглянемо взаємозв’язок між положенням елементів у Періодичній системі й такими властивостями хімічних елементів, як атомний радіус, електронегативність, металічні та неметалічні властивості.
Атомний радіус є величиною, що показує розмір електронної оболонки атома. Це дуже важлива величина, від якої залежать властивості атомів хімічних елементів. У головних підгрупах зі збільшенням заряду ядра атома відбувається збільшення числа електронних рівнів, тому атомний радіус зі збільшенням порядкового номера в головних підгрупах збільшується. У періодах відбувається збільшення заряду ядра атома хімічного елемента, що призводить до підсилення взаємодії зовнішніх електронів до ядра. Крім того, зі збільшенням заряду ядра збільшується число електронів на зовнішньому рівні, проте число електронних рівнів не збільшується. Зазначені закономірності призводять до стиснення електронної оболонки навколо ядра. Тому атомний радіус зі збільшенням порядкового номера у періодах зменшується.
Наприклад, розташуємо хімічні елементи O (Оксиген), C (Карбон), Li (Літій), F (Флуор), N (Нітроген) у порядку зменшення атомних радіусів. Наведені хімічні елементи знаходяться в другому періоді. У періоді атомні радіуси зі збільшенням порядкового номеру зменшуються. Отже, зазначені хімічні елементи треба записати у порядку зростання їх порядкових номерів: Li, C, N, O, F (Літій, Карбон, Нітроген, Оксиген, Флуор)
Електронегативність – це здатність атома в сполуках притягувати до себе валентні електрони, тобто ті електрони, за допомогою яких утворюються хімічні зв’язки між атомами. Електронегативність залежить від здатності атомного ядра притягувати електрони зовнішнього енергетичного рівня. Чим це притягування є сильнішим, тим електронегативність більша. Сила притягування електронів зовнішнього енергетичного рівня тим більша, чим менший атомний радіус. Отже, зміна електронегативності у періодах та головних підгрупах буде протилежна зміні атомних радіусів. Тому в головних підгрупах електронегативність зі збільшенням порядкового номеру зменшується. У періодах зі збільшенням порядкового номеру електронегативність збільшується.
Наприклад, розташуємо хімічні елементи Br (Бром), F (Флуор), I (Йод), Cl (Хлор) у порядку збільшення електронегативності. Наведені хімічні елементи знаходяться у головній підгрупі сьомої групи. У головних підгрупах електронегативність зі збільшенням порядкового номеру зменшується. Отже, зазначені хімічні елементи треба записати у порядку зменшення їх порядкових номерів: I, Br, Cl, F (Йод, Бром, Хлор, Флуор).
Металічні властивості – це властивості атомів хімічних елементів віддавати електрони. Хімічні елементи, які виявляють металічні властивості, як правило, мають на зовнішньому рівні від одного до трьох електронів. Неметалічні властивості – це властивості атомів хімічних елементів приймати електрони. Хімічні елементи, які виявляють неметалічні властивості, як правило, мають на зовнішньому рівні від чотирьох до восьми електронів. Металічні властивості тим більші та, відповідно, неметалічні властивості тим менші, чим легше віддається електрон із зовнішнього енергетичного рівня. Віддати електрон із зовнішнього енергетичного рівня тим легше, чим більший атомний радіус – завдяки тому, що сила притягування ядра та електронів зменшується зі зростанням відстані між ними. Отже, зміна металічних властивостей хімічних елементів буде аналогічна зміні їх атомних радіусів. Тому в головних підгрупах металічні властивості зі збільшенням порядкового номеру збільшуються, а у періодах зі збільшенням порядкового номера металічні властивості зменшуються. Неметалічні властивості, навпаки, у головних підгрупах зі збільшенням порядкового номера зменшуються, а у періодах зі збільшенням порядкового номера збільшуються.
Наприклад, розташуємо хімічні елементи Al, S, Mg, Cl, Na у порядку збільшення неметалічних властивостей. Наведені хімічні елементи знаходяться у третьому періоді. У періодах неметалічні властивості зі збільшенням порядкового номера збільшуються. Отже, зазначені хімічні елементи треба записати у порядку збільшення їх порядкових номерів: Na, Mg, Al, S, Cl. Розглянемо взаємозв’язок між положенням хімічних елементів у Періодичній системі та властивостями оксидів і відповідних гідроксидів, які утворюють ці хімічні елементи, на прикладі елементів третього періоду. До третього періоду належать хімічні елементи: Na, Mg, Al, Si, P, S, Cl, Ar.
Ці елементи утворюють вищі оксиди наступного складу (інертний хімічний елемент Аргон оксид не утворює): Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Натрій оксид і магній оксид виявляють властивості основних оксидів, алюміній оксид є амфотерним оксидом, усі інші оксиди (силіцій (IV) оксид, фосфор (V) оксид, сульфур (VI) оксид, хлор (VII) оксид) виявляють властивості кислотних оксидів. Крім того, в ряді Na2O –
MgO основні властивості послаблюються, а в ряді SiO2 – P2O5 – SO3 – Cl2O7 кислотні властивості посилюються.
Так само можна проаналізувати характер зміни у періоді властивостей гідроксидів, які відповідають вищим оксидам: NaOH, Mg(OH)2, Al(OH)3, H2SiO3, H3PO4, H2SO4, HclO4. Натрій гідроксид і магній гідроксид виявляють властивості основ, алюміній гідроксид є амфотерним гідроксидом, усі інші гідроксиди виявляють властивості кислот: силікатна кислота, ортофосфатна кислота, сульфатна кислота, хлорна кислота. Крім того, в ряду NaOH – Mg(OH)2 основні властивості послаблюються, а в ряду H2SiO3 – H3PO4 – H2SO4 – HСlO4 кислотні властивості посилюються.
Отже, в ряду елементів певного періоду послаблюються властивості основних оксидів та відповідних їм гідроксидів, а кислотні властивості в тому самому напрямку посилюються. Перехід від основних до кислотних оксидів, і, відповідно, від основ до кислот здійснюється у періоді через амфотерний оксид або гідроксид. Така закономірність є справедливою для другого й третього Періодів періодичної системи. Для елементів великих періодів спостерігаються складніші закономірності.
ЗМ 1.5. Хімічний зв’язок
Електронна природа хімічного зв’язку
Лише деякі хімічні елементи (благородні гази) за звичайних умов знаходяться в стані одноатомного газу. Атоми інших елементів, навпаки, в індивідуальному вигляді не існують, а входять до складу молекул або кристалічних ґраток, утворених сукупністю атомів. Отже, існує причина, за якою атоми зв’язуються один з іншим. Цією причиною є хімічний зв’язок, який зумовлений тим, що між атомами діють певні електростатичні сили, здатні утримувати атоми один біля одного. Доведено, що в утворенні хімічного зв’язку між атомами головна роль належить валентним електронам (електронам зовнішнього рівня, які найслабше зв’язані з ядром).
Згідно з теорією хімічного зв’язку найбільшу міцність мають зовнішні оболонки, які складаються з двох або восьми електронів. Благородні гази мають такі електронні оболонки. Це і є причиною того, що благородні гази за звичайних умов не вступають у хімічні реакції з іншими елементами. Атоми, які мають на зовнішньому рівні менше восьми (або двох) електронів, намагаються набути структури благородних газів. Тому під час утворення молекули в ході хімічної реакції атоми намагаються набути стійку електронну конфігурацію. Утворення стійкої електронної конфігурації може відбуватися декількома способами та спричиняти утворення молекул або йонів різної будови. Унаслідок цього розрізняють ковалентний та йонний типи хімічного зв’язку. Крім цих існують інші типи хімічного зв’язку: металічний та водневий (міжмолекулярний).
Ковалентний зв’язок – це хімічний зв’язок, який утворюється за рахунок спільних електронних пар.
Розглянемо механізм утворення ковалентного зв’язку на прикладі молекули водню H2. Атоми Гідрогену мають електронну формулу: 1H 1s1.
Під час зближення двох атомів Гідрогену відбувається взаємодія двох електронів з антипаралельними спінами (позначаються електрони стрілками з різними напрямками) з формуванням спільної (поділеної) електронної пари.
Схему утворення ковалентного зв’язку можна також подати, позначаючи неспарений електрон зовнішнього рівня однією крапкою, а спільну електронну пару – двома крапками. Спільну електронну пару, тобто ковалентний зв’язок, часто позначають рискою. Спільна електронна пара утворюється внаслідок перекривання s-орбіталей атомів Гідрогену, при цьому в області перекривання орбіталей створюється підвищена електронна густина.
Розглянемо утворення ковалентного зв’язку в молекулі хлору Cl2. Атоми Хлору мають
електронну формулу: 17Cl 1s2 2s2 2p6 3s2 3p5.
Атом Хлору має сім електронів на зовнішньому енергетичному рівні, причому на 3p – підрівні перебуває один неспарений електрон. При взаємодії двох атомів Хлору відбувається перекривання орбіталей з неспареними електронами та утворення спільної електронної пари. У кожного атома Хлору в молекулі Cl2 зберігаються три неподілені електронні пари (такі, що належать одному атому).
У молекулі водню H2, як і в молекулі хлору Cl2, утворюється простий (одинарний) зв’язок. Існують молекули, в яких між двома атомами виникають дві або три електронні пари. Такі ковалентні зв’язки називають, відповідно, подвійними або потрійними. Загальна назва подвійних та потрійних зв’язків – кратні зв’язки.
Наприклад, розглянемо утворення ковалентного зв’язку в молекулі кисню O2. Атоми Оксигену мають електронну формулу: 8O 1s2 2s2 2p4.
Атом Оксигену має шість електронів на зовнішньому енергетичному рівні, причому на 2p- підрівні перебуває два неспарених електрони. В утворенні хімічного зв’язку в молекулі O2 беруть участь по два електрони кожного атома Оксигену. У даному випадку утворюються дві спільні електронні пари (подвійний зв’язок). У кожного атома Оксигену в молекулі O2 зберігаються дві неподілені електронні пари.
Уразі ковалентного зв’язку в молекулі водню кожний з атомів Гідрогену набуває стійкої двохелектронної конфігурації за рахунок утворення спільної електронної пари. В інших випадках у разі утворення ковалентного зв’язку, наприклад у молекулах хлору та кисню, кожний із атомів набуває стійкої конфігурації, яка складається з восьми електронів.
Увипадку всіх трьох розглянутих молекул (водню, хлору та кисню) ковалентний зв’язок утворювався між атомами з однаковою електронегативністю. Така взаємодія спостерігається під час утворення простих речовин-неметалів, молекули яких складаються з двох однакових атомів. У цьому випадку спільні електронні пари розміщуються симетрично між ядрами атомів, що з’єднуються. Унаслідок цього утворюються молекули, в яких центри позитивних і негативних зарядів збігаються.
Отже, ковалентний зв’язок, який утворюється між атомами з однаковою електронегативністю за рахунок спільних електронних пар, називають ковалентним неполярним зв’язком. Треба запам’ятати, що такий тип хімічного зв’язку утворюється в
простих речовинах-неметалах. Як приклади речовин з ковалентним неполярним типом зв’язку можна назвати Фтор F2, Бром Br2, Йод I2, Азот N2.
Якщо атоми, які взаємодіють, мають різну електронегативність (атоми різних хімічних елементів), то спільна електронна пара буде зміщуватись до атома з більшою
електронегативністю. При цьому на атомі з більшою електронегативністю формується частковий негативний заряд 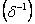 , а на атомі з меншою електронегативністю – частковий
, а на атомі з меншою електронегативністю – частковий
позитивний заряд  . Ці часткові заряди за абсолютним значенням менші за одиницю. Наприклад, під час утворення молекули гідроген хлориду HCl відбувається перекривання s- орбіталі атома Гідрогену та p-орбіталі атома Хлору. Спільна електронна пара розміщена несиметрично відносно центрів атомів, що взаємодіють. Вона зміщується до більш електронегативного Хлору. На атомі Хлору формується частковий негативний заряд, а на атомі Гідрогену – частковий позитивний заряд. У цьому випадку в молекулі центри позитивних і негативних зарядів не співпадають. Такі молекули називають полярними, або диполями. Диполь – це система з двох зарядів, які є однаковими за величиною, але протилежними за знаком.
. Ці часткові заряди за абсолютним значенням менші за одиницю. Наприклад, під час утворення молекули гідроген хлориду HCl відбувається перекривання s- орбіталі атома Гідрогену та p-орбіталі атома Хлору. Спільна електронна пара розміщена несиметрично відносно центрів атомів, що взаємодіють. Вона зміщується до більш електронегативного Хлору. На атомі Хлору формується частковий негативний заряд, а на атомі Гідрогену – частковий позитивний заряд. У цьому випадку в молекулі центри позитивних і негативних зарядів не співпадають. Такі молекули називають полярними, або диполями. Диполь – це система з двох зарядів, які є однаковими за величиною, але протилежними за знаком.
Отже, ковалентний зв’язок, який утворюється між атомами, електронегативності яких відрізняються, але незначно, називають ковалентним полярним зв’язком. Треба запам’ятати, що такий тип хімічного зв’язку утворюється в складних речовинах, утворених атомами неметалів. Як приклади речовин з ковалентним полярним типом зв’язку можна назвати фтороводень HF, воду H2O, амоніак NH3, метан CH4, карбон (IV) оксид CO2.
Для молекули з ковалентним типом хімічного зв’язку можна записати електронну та структурну (графічну) формулу. Електронна формула складається із символів хімічних елементів, навколо яких крапками позначені електрони зовнішнього рівня, а між атомами – спільні електронні пари. У структурній (графічній) формулі кожна спільна електронна пара зображується рискою. Як електронна, так і структурна формули показують порядок сполучення атомів у молекулі, їх взаємозв’язок.
Іонний зв’язок – це хімічний зв’язок, який утворюється за рахунок електростатичної взаємодії між іонами із зарядами протилежного знака.
Іонний зв’язок утворюється внаслідок повного переносу одного чи декількох електронів від одного атома до іншого. Такий тип зв’язку можливий тільки між атомами елементів, електронегативності яких значно відрізняються. При цьому відбувається перехід електрона від атома з меншою електронегативністю до атома з більшою електронегативністю. Треба запам’ятати, що такий тип хімічного зв’язку утворюється між атомами металів і неметалів. Наприклад, елементи першої та другої групи головних підгруп Періодичної системи (типові метали) безпосередньо з’єднуються з елементами шостої та сьомої групи головних підгруп Періодичної системи (типові неметали).
Розглянемо механізм утворення іонного зв’язку в сполуці калій хлорид. Атом Калію містить один валентний електрон (визначаємо за номером групи, в якій знаходиться Калій). Атом Хлору містить сім валентних електронів (визначаємо за номером групи, в якій знаходиться Хлор). Під час взаємодії атомів Калію з атомами Хлору валентний електрон атома Калію повністю переходить на зовнішній рівень атома Хлору, добудовуючи його до стійкої електронної структури. При цьому атом Калію, втрачаючи електрон, набуває позитивного заряду +1 та перетворюється на катіон K+, а атом Хлору, приєднуючи електрон, набуває негативного заряду –1 та перетворюється на аніон Cl-. Різнойменно заряджені іони притягуються завдяки електростатичним силам та утворюється сполука калій хлорид. Цей
процес можна зобразити схематично:  ;
;  ;
; 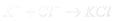 .
.
Іонний зв’язок є крайнім випадком ковалентного полярного зв’язку. Сполуки з іонним зв’язком називають іонними. Як приклади речовин з іонним типом зв’язку можна назвати магній сульфід MgS, алюміній хлорид AlCl3, натрій бромід NaBr. Іонний зв’язок також існує в солях оксигеновмісних кислот і в лугах між атомами металів і атомами Оксигену.
Ступінь окиснення елемента – це умовний заряд на атомі в речовині, обчислений із припущенням, що вона складається з іонів. Для визначення ступеня окиснення елементів необхідно запам’ятати такі правила:
1.Ступінь окиснення може бути позитивним, негативним або дорівнювати нулю. Він позначається арабською цифрою зі знаком «плюс» або «мінус» над символом елемента.
2.При визначенні ступенів окиснення виходять з електронегативності речовини: сума ступенів окиснення всіх атомів у сполуці дорівнює нулю.
3.Якщо сполука утворена атомами одного елемента (у простій речовині), то ступінь окиснення цих атомів дорівнює нулю.
4.Атомам деяких хімічних елементів зазвичай приписують сталі ступені окиснення. Наприклад, ступінь окиснення Флуору в сполуках завжди дорівнює –1; Літію, Натрію, Калію, Рубідію і Цезію – +1; Магнію, Кальцію, Стронцію, Барію і Цинку – +2, Алюмінію – +3.
5.Ступінь окиснення Гідрогену у більшості сполук +1, і лише в сполуках з деякими металами він дорівнює –1 (KH, BaH2).
6.Ступінь окиснення Оксигену у більшості сполук становить –2, і лише у деяких сполуках він має ступінь окиснення –1 (H2O2, Na2O2 або +2 (OF2).
7.Атоми багатьох хімічних елементів виявляють змінні ступені окиснення.
8.Ступінь окиснення атома металу в сполуках позитивний і чисельно дорівнює його валентності.
9.Максимальний позитивний ступінь окиснення елемента, як правило, дорівнює номеру групи у Періодичній системі, в якій знаходиться елемент.
10.Мінімальний ступінь окиснення для металів дорівнює нулю. Для неметалів у більшості випадків нижчий від’ємний ступінь окиснення дорівнює різниці між номером групи та цифрою вісім.
11.Ступінь окиснення атома, який утворює простий іон (складається з одного атома), дорівнює заряду цього іона.
Користуючись наведеними правилами, визначимо ступені окиснення хімічних елементів у
сполуці H2SO4. Це складна речовина, яка складається з трьох хімічних елементів – Гідрогену Н, Сульфуру S та Оксигену О. Зазначимо ступені окиснення тих елементів, для яких вони є
сталими. У нашому випадку це Гідроген Н та Оксиген О:
 .
.
Визначимо невідомий ступінь окиснення Сульфуру. Нехай ступінь окиснення Сульфуру в
цій сполуці дорівнює х:  .
.
Складемо рівняння, помноживши для кожного елемента його індекс на ступінь окиснення та добуту суму прирівняємо до нуля: 2 · (+1) + x + 4 · (-2) = 0
+2 + x – 8 = 0 x = +8 – 2 = +6
Отже, ступінь окиснення Сульфуру дорівнює плюс шість:  .
.
У наступному прикладі з’ясуємо, як можна скласти формулу сполуки за відомими ступенями окиснення атомів елементів. Складемо формулу ферум(III) оксиду. Слово «оксид» означає, що справа від символу Феруму треба записати символ Оксигену: FeO.
Зазначимо ступені окиснення хімічних елементів над їх символами. Ступінь окиснення Феруму вказана в назві у дужках (III), отже, дорівнює +3, ступінь окиснення Оксигену в
оксидах –2 :  .
.
Знайдемо найменше спільне кратне для чисел 3 та 2, це число 6. Розділимо число 6 на 3, одержимо число 2 – це індекс для Феруму. Розділимо число 6 на 2, одержимо число 3 – це
індекс для Оксигену:  .
.
У наступному прикладі з’ясуємо, як можна скласти формулу сполуки за відомими ступенями окиснення атомів елементів та зарядами іонів. Складемо формулу кальцій ортофосфату. Слово «ортофосфат» означає, що справа від символу Кальцію треба записати кислотний залишок ортофосфатної кислоти: CaPO4.
Зазначимо ступінь окиснення Кальцію (правило номер чотири) та заряд кислотного залишку
(за таблицею розчинності):  .
.
Знайдемо найменше спільне кратне для чисел 2 та 3, це число 6. Розділимо число 6 на 2, одержимо число 3 – це індекс для Кальцію. Розділимо число 6 на 3, одержимо число 2 – це
індекс для кислотного залишку:  .
.
ЗМ 1.6. Суміші речовин. Розчини
Речовини, які мають сталі фізичні властивості, називають чистими (індивідуальними) речовинами. У природі речовини зустрічаються переважно у вигляді сумішей. Суміш – це сукупність різних чистих речовин. Однорідну в усьому своєму об’ємі суміш називають розчином. Прикладом рідкого розчину є розчин оцтової кислоти у воді, прикладом твердого
– сплав металів, прикладом газоподібного – повітря. Неоднорідні суміші, на відміну від однорідних, у своїх різних частинах мають різні властивості. Прикладом неоднорідних сумішей є дим, пил, туман, гірські породи. Про матеріал, який складається головним чином з однієї речовини і містить досить малу кількість інших речовин, говорять як про зразок речовини, що містить певні домішки.
На відміну від індивідуальних речовин, суміші можуть бути розділені на складові частини фізичними методами. Наприклад, неоднорідні суміші можуть бути розділені на складові компоненти відстоюванням (відділення частинок глини від води), фільтруванням (відділення кухонної солі від піску після розчинення у воді), випарюванням (відділення повареної солі від води), дією магніту (відділення частинок заліза від інших речовин). Однорідну суміш двох рідин, які мають різні температури кипіння, можна розділити за допомогою перегонки (дистиляції).
Розділення сумішей засноване на різних властивостях їх компонентів.
Гомогенні (однорідні суміші) – розділення здійснюється наступними методами: випарювання, седиментація (кристалізація), прожарювання, дистиляція, хроматографія, сорбція.
Гетерогенні (неоднорідні) – розділення здійснюється наступними методами: декантація (відстоювання), магнітна сепарація, фільтрування, просіювання, центрифугування, флотація.
Приклади сумішей: бронза, бабіт – сплави у промисловості; кров, слина, молоко – суміші у живих організмах; вапняк, морська та мінеральна вода, мінерали – суміші у природі.
2. НЕОРГАНІЧНА ХІМІЯ
ЗМ 2.1. Класи неорганічних сполук
Неорганічні сполуки – це сполуки, які утворюються всіма хімічними елементами (крім більшості органічних сполук Карбону). За хімічним складом неорганічні речовини поділяються на прості й складні. Прості речовини (утворені атомами одного хімічного елемента) за хімічними властивостями поділяються на метали та неметали. Складні речовини (утворені атомами різних хімічних елементів) за складом та хімічними властивостями поділяються на оксиди, основи, кислоти і солі. Тепер розглянемо більш детально такий клас складних неорганічних сполук, як оксиди.
Оксиди – це складні речовини, що складаються з двох елементів, одним із яких є Оксиген. За сучасною науковою українською номенклатурою, будуючи назву оксиду, спочатку називають катіон, а потім додають назву аніона – оксид. Якщо елемент, який утворює оксид, виявляє змінну валентність, то її обов’язково зазначають у назві оксиду. Атоми таких хімічних елементів, як Гідроген, Літій, Натрій, Калій, Рубідій, Цезій, Флуор, виявляють сталу валентність один. Атоми Берилію, Магнію, Кальцію, Стронцію, Барію, Цинку виявляють сталу валентність два. Атоми Алюмінію та Бору виявляють сталу валентність три. Атоми інших хімічних елементів виявляють змінну валентність.
Оксиди поділяють на дві групи: солетворні та несолетворні. Несолетворними називають оксиди неметалів, яким не відповідають кислоти та які не вступають у хімічні реакції, що супроводжуються утворенням солей. Наприклад, карбон (II) оксид - CO, нітроген (II) оксид - NO, нітроген (I) оксид - N2O. Солетворні оксиди поділяють на три групи: основні, кислотні й амфотерні. До основних належать оксиди типових металів, їм відповідають гідроксиди, що виявляють властивості основ. Наприклад, магній оксид, MgO, натрій оксид Na2O, барій оксид BaO. До кислотних належать оксиди неметалів, їм відповідають гідроксиди, що виявляють властивості кислот. Наприклад, карбон (IV) оксид CO2, фосфор
(V) оксид P2O5, сульфур (VI) оксид SO3. Амфотерними називають оксиди, які мають двоїсту природу: вони одночасно здатні до хімічних реакцій, у які вступають як кислотні, так і основні оксиди. До амфотерних оксидів належать алюміній оксид Al2O3, цинк оксид ZnO, берилій оксид BeO, хром (III) оксид Cr2O3, ферум (III) оксид Fe2O3 та ряд інших.
Оксиди широко розповсюджені у природі. У величезних кількостях зустрічаються гідроген оксид (вода) H2O та силіцій (IV) оксид (кремнезем) SiO2. У природі кремнезем зустрічається у вигляді мінералу кварцу і багатьох його різновидів (кварцовий пісок, гірський кришталь, кремінь, яшма, агат, опал тощо). Багато мінералів є оксидами. Наприклад: гематит Fe2O3, магнетит Fe3O4, каситерит SnO2 та інші.
Фізичні та хімічні властивості оксидів дуже відрізняються. За умов кімнатної температури більшість оксидів є твердими речовинами, наприклад: купрум (II) оксид CuO чорного кольору, кальцій оксид CaO білого кольору, хром (III) оксид Cr2O3 темно-зеленого кольору. Деякі оксиди є рідинами (наприклад, гідроген оксид (вода) H2O та Cl2O7 є безбарвними рідинами), а деякі – газоподібними речовинами (наприклад, карбон (IV) оксид CO2 є газом без кольору, а нітроген (IV) оксид NO2 є бурим газом). Деякі оксиди є речовинами з молекулярною будовою, інші мають іонну будову.
Основні та кислотні оксиди виявляють різні властивості. Основні оксиди під час нагрівання можуть вступати в реакції з кислотними та амфотерними оксидами, з кислотами. З водою безпосередньо реагують оксиди лужних металів (оксиди Літію, Натрію, Калію, Рубідію і Цезію) та оксиди лужноземельних металів (оксиди Кальцію, Стронцію і Барію). Розглянемо приклади рівнянь типових хімічних реакцій, які підтверджують зазначені властивості основних оксидів.
1. Взаємодія основного оксиду з кислотним оксидом з утворенням солі:
CaO + SiO2 CaSiO3.
CaSiO3.
2. Взаємодія основного оксиду з амфотерним оксидом з утворенням солі: Na2O + Al2O3  2NaAlO2.
2NaAlO2.
3.Взаємодія основного оксиду з водою з утворенням основи: BaO + H2O = Ba(OH)2.
4.Взаємодія основного оксиду з кислотою з утворенням солі та води:
MgO + 2HCl = MgCl2 + H2O.
Кислотні оксиди можуть вступати в реакції з основними та амфотерними оксидами, з розчинними у воді основами (лугами). Багато кислотних оксидів взаємодіють із водою
(винятком є силіцій (IV) оксид SiO2. Розглянемо приклади рівнянь типових хімічних реакцій, які підтверджують зазначені властивості кислотних оксидів.
1.Взаємодія кислотного оксиду з основним оксидом з утворенням солі: CO2 + Na2O = Na2CO3.
2.Взаємодія кислотного оксиду з амфотерним оксидом з утворенням солі:
SO3 + ZnO = ZnSO4.
3.Взаємодія кислотного оксиду з водою з утворенням кислоти: P2O5 + 3H2O = 2H3PO4.
4.Взаємодія кислотного оксиду з лугом з утворенням солі та води:
SO2 + 2KOH = K2SO3 + H2O.
Амфотерним оксидам притаманні властивості як основних, так і кислотних оксидів. Тобто вони можуть реагувати як з кислотними, так і з основними оксидами з утворенням солей. Крім того, амфотерні оксиди можуть взаємодіяти як із кислотами, так і з лугами з утворенням солей та води. Наприклад:
ZnO + H2SO4 = ZnSO4 + H2O;
Al2O3 + 2KOH  2KAlO2 + H2O.
2KAlO2 + H2O.
Загальні способи добування оксидів. Використання оксидів
Оксиди добувають двома основними способами: у процесі горіння простих і складних речовин та шляхом розкладання складних речовин (нерозчинних основ, кислот і солей). Розглянемо приклади рівнянь хімічних реакцій, які підтверджують зазначені способи добування оксидів.
1. Горіння:
а) простих речовин: S + O2 → SO2;
б) складних речовин: 2PH3 + 4O2 → P2O5 + 3 H2O. 2. Розкладання:
а) нерозчинних основ: 2Al(OH)3 Al2O3 + 3 H2O; б) кислот: H2SiO3
Al2O3 + 3 H2O; б) кислот: H2SiO3 SiO2 + H2O;
SiO2 + H2O;
в) солей: MgCO3 MgO + CO2.
MgO + CO2.
Велике значення у природі, промисловості й побуті має найважливіший природний оксид – вода H2O. Вода використовується в усіх галузях господарської діяльності людини. Практично неможливо назвати жодний виробничий процес, у якому б не застосовувалась вода.
Широко застосовуються також багато інших оксидів. Оксиди активно використовуються у виробництві будівельних матеріалів, скла, фарфору, фаянсу, магнітних матеріалів. Оксиди металів (Феруму, Ніколу, Алюмінію, Стануму та інших) є сировиною у виробництві металів. Оксиди неметалів (Сульфуру, Фосфору, Нітрогену) застосовуються у виробництві відповідних кислот. Деякі оксиди можуть бути використані як вогнетриви: силіцій (IV) оксид SiO2, магній оксид MgO, алюміній оксид Al2O3; як каталізатори: ванадій (V) оксид V2O5, алюміній оксид Al2O3; як адсорбенти: силікагель SiO2. Із руд, які містять оксиди Феруму Fe2O3 та Fe3O4, добувають чавун і сталь.
Кислотами називають складні речовини, які складаються з атомів Гідрогену, здатних заміщуватись атомами металів, і кислотних залишків. Кислотний залишок може містити окремі атоми чи групи атомів. Валентність кислотного залишку та основність кислоти визначається числом атомів Гідрогену, здатних заміщуватись атомами металів.
За сучасною українською науковою номенклатурою, будуючи назву кислоти, спочатку називають катіон (Гідроген), а потім додають назву аніона. Наприклад, гідроген хлорид HCl, гідроген нітрат HNO3. Оскільки гідроген-катіон вказує на приналежність сполуки до кислоти, назву кислоти можна побудувати, використовуючи назву аніона із закінченням -на замість прикметника, додаючи до нього іменник кислота. Наприклад, хлоридна кислота HCl, нітратна кислота HNO3.
Необхідно запам’ятати назви та формули найважливіших неорганічних кислот:
∙хлоридна кислота HCl;
∙сульфатна кислота H2SO4;
∙сульфітна кислота H2SO3;
∙сульфідна кислота H2S;
∙нітратна кислота HNO3;
∙ортофосфатна кислота H3PO4;
∙карбонатна кислота H2CO3;
∙силікатна кислота H2SiO3.
Кислоти можна класифікувати за такими основними ознаками, як наявність атомів Оксигену та основність (кількість атомів Гідрогену). За наявністю атомів Оксигену кислоти поділяють на оксигеновмісні (H2SO3, H2SiO3) та безоксигенові (HCl, H2S). За основністю кислоти поділяють на одноосновні (HCl, HNO3), двоосновні (H2SO4, H2CO3) та триосновні (H3PO4).
Фізичні та хімічні властивості кислот. Поняття про ряд активності металів. Реакції заміщення й обміну. Реакція нейтралізації. Заходи безпеки під час роботи з кислотами
Багато кислот є безбарвними рідинами (наприклад, сульфатна H2SO4, нітратна HNO3, хлоридна HCl); деякі є твердими речовинами (наприклад, ортофосфатна H3PO4, метафосфатна HPO3, боратна H3BO3). Майже всі кислоти розчинні у воді, крім силікатної H2SiO3. Усі кислоти в індивідуальному стані мають молекулярну будову. Із життєвого досвіду вам відомо, що багато продуктів харчування мають кислий смак. Його надають продуктам кислоти: лимонам – лимонна кислота, яблукам – яблучна, щавлю – щавлева. Усі ці кислоти належать до органічних кислот.
Для кислот характерні певні хімічні властивості. 1. Дія розчинів кислот на розчини індикаторів.
Індикаторами називають речовини, які змінюють своє забарвлення під дією розчину кислоти або лугу. До найбільш розповсюджених індикаторів відносять лакмус, метиловий оранжевий (метилоранж), фенолфталеїн та універсальний індикаторний папір. У розчині кислоти лакмус, метиловий оранжевий та універсальний індикаторний папір матимуть червоне забарвлення, а фенолфталеїн залишиться безбарвним.
2. Взаємодія кислот з металами з утворенням солі та водню.
Російським вченим М. М. Бекетовим на основі експериментальних дослідів був складений витискувальний ряд металів: Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Pt, Au.
У цьому ряді всі метали, що стоять до водню H2, витискують Гідроген H із розчинних кислот (крім нітратної кислоти HNO3). Отже, кислоти (крім HNO3) взаємодіють із металами, які розташовані в ряді напруг до водню, з утворенням солі та водню:
Mg + 2HCl = MgCl2 + H2.
Реакції такого типу, які відбуваються з участю простої та складної речовини і в результаті яких утворюються проста й складна речовина, називаються реакціями заміщення.
3. Взаємодія кислот з основними оксидами з утворенням солі та води:
Na2O + H2SO4 = Na2SO4 + H2O.
Реакції такого типу, які відбуваються з участю двох складних речовин і під час яких речовини, що реагують, обмінюються складовими частинами, називаються реакціями обміну. Треба запам’ятати, що реакції обміну перебігають до кінця у таких трьох випадках:
1)якщо внаслідок реакції утворюється вода;
2)якщо один із продуктів реакції випадає в осад;
3) якщо один із продуктів реакції є леткою (газоподібною) речовиною.
Для того щоб визначити, чи є речовина нерозчинною, треба скористатися таблицею розчинності.
4. Взаємодія кислот з основами з утворенням солі та води:
KOH + HNO3 = KNO3 + H2O.
Окремим випадком реакції обміну є реакція нейтралізації. Реакцією нейтралізації називається реакція між кислотою та основою, внаслідок якої утворюються сіль і вода.
5. Взаємодія кислот із солями з утворенням іншої солі та іншої кислоти:
K2SiO3 + H2SO4 = H2SiO3 ↓ + K2SO4.
Під час роботи з кислотами треба бути дуже обережними. У разі розведення кислот необхідно приливати кислоту у воду невеликими порціями під час перемішування, але не навпаки. У разі потрапляння кислоти на шкіру треба негайно змити її проточною водою до зникнення відчуття печії, потім промити розчином питної соди та звернутись до медпункту.
Загальні способи добування кислот. Використання кислот
Спосіб добування кислоти залежить від того, чи є кислота оксигеновмісною чи безоксигеновою. Оксигеновмісні кислоти (крім силікатної кислоти) можуть бути добуті ході взаємодії кислотних оксидів із водою. Безоксигенові кислоти можуть бути добуті у ході безпосередньої взаємодії неметалів із воднем. Як оксигеновмісні, так і безоксигенові кислоти можна добути реакцією обміну між солями та іншими кислотами. Розглянемо приклади рівнянь хімічних реакцій, які підтверджують зазначені способи добування кислот.
1.Взаємодія неметалів із воднем: H2 + Cl2 = 2HCl.
2.Взаємодія кислотних оксидів з водою: SO3 + H2O = H2SO4.
3.Взаємодія солей з кислотами: Na2SiO3 + 2HCl = H2SiO3 ↓+ 2NaCl.
Кислоти використовують у промисловості й у наукових дослідженнях. Найширше застосовуються такі кислоти, як хлоридна, сульфатна, нітратна. Хлоридна кислота HCl використовується у виробництві неорганічних хлоридів, ліків, барвників, багатьох органічних речовин, що містять хлор. Сульфатна кислота H2SO4 використовується у виробництві мінеральних добрив, барвників, вибухових речовин, пластмас, у металургії – у процесі добування металів. Нітратна кислота HNO3 використовується у виробництві мінеральних добрив, пластмас та штучних волокон, лікарських речовин, для обробки металічних поверхонь.
Основи, їх склад, назви. Класифікація основ
Основами називають складні речовини, до складу яких входять атоми металів, сполучених з однією чи кількома гідроксильними групами OH. Гідроксогрупа є одновалентною. Число гідроксогруп визначається валентністю металу. Склад основ можна виразити загальною формулою:Ме(ОН)n, n – валентність металічного елементу Ме, для амоній – катіону валентність складає І – NH4+.
За сучасною українською науковою номенклатурою назву основи утворюють з назви катіона і слова гідроксид. Якщо метал виявляє змінну валентність, то її обов’язково зазначають у назві основи. Наприклад: натрій гідроксид NaOH, купрум (II) гідроксид Cu(OH)2.
Основи поділяють на розчинні у воді (луги) та нерозчинні у воді. До лугів належать гідроксиди лужних ( літій гідроксид LiOH, натрій гідроксид NaOH, калій гідроксид KOH, рубідій гідроксид RbOH, цезій гідроксид CsOH) та лужноземельних металів (кальцій гідроксид Ca(OH)2, барій гідроксид Ba(OH)2, стронцій гідроксид Sr(OH)2). До нерозчинних основ належать гідроксиди всіх інших металів. Наприклад: купрум (II) гідроксид Cu(OH)2, алюміній гідроксид Al(OH)3 , ферум (III) гідроксид Fe(OH)3.
Фізичні та хімічні властивості основ. Заходи безпеки під час роботи з лугами. Поняття про амфотерні гідроксиди
Розчинні у воді основи (луги) є твердими речовинами білого кольору, добре розчинними у воді. За кімнатної температури низьку розчинність мають Ca(OH)2 та Sr(OH)2. Нерозчинні у воді основи є твердими речовинами, наприклад: Al(OH)3 білого кольору, Cu(OH)2 блакитного кольору, Fe(OH)3 бурого кольору.
Розчинні та нерозчинні основи виявляють ряд спільних та відмінних хімічних властивостей.
1.Дія розчинів лугів на розчини індикаторів (характерна лише для лугів). У розчині лугу лакмус та універсальний індикаторний папір матимуть синє забарвлення, метиловий оранжевий – оранжево-жовте, а фенолфталеїн – малинове.
2.Взаємодія основ із кислотами з утворенням солі та води – реакція нейтралізації (характерна як для розчинних основ, так і для нерозчинних):
KOH + HCl = KCl + H2O.
3.Взаємодія основ з кислотними оксидами з утворенням солі та води (характерна лише для лугів):
2NaOH + CO2 = Na2CO3 + H2O.
4.Взаємодія основ з розчинами солей з утворенням іншої основи та іншої солі (характерна лише для лугів):
2KOH + CuSO4 = K2SO4 + Cu(OH)2.
До складу солі, що вступає в реакцію з розчином лугу, повинен входити метал, який здатний утворювати нерозчинну основу.
5.Розкладання нерозчинних основ під час нагрівання з утворенням оксиду та води (характерне лише для нерозчинних основ):
2Fe (OH)3 Fe2O3 + 3H2O.
Fe2O3 + 3H2O.
Під час роботи з лугами слід бути дуже обережними, оскільки луги є дуже агресивними речовинами. У разі потрапляння розчину лугу на шкіру треба негайно змити її проточною водою до зникнення відчуття милкості, потім промити (нейтралізувати) розчином слабкої кислоти (оцтової чи борної) та звернутись до медпункту.
Ми вже з’ясували, що основи в реакції нейтралізації реагують із кислотами, утворюючи солі. Основи з основами, так само як і кислоти з кислотами у реакцію нейтралізації не вступають. Але існують такі гідроксиди, що взаємодіють як із кислотами, так і з основами, утворюючи солі. Такі гідроксиди називаються амфотерними. Амфотерні гідроксиди у реакціях з кислотами виявляють властивості основ, а в реакціях з основами – властивості кислот. Усі амфотерні гідроксиди погано розчиняються у воді. До них належать цинк гідроксид Zn(OH)2, алюміній гідроксид Al(OH)3, берилій гідроксид Be(OH)2, хром (III) гідроксид
Cr(OH)3, ферум (III) гідроксид Fe(OH)3 та інші. Розглянемо хімічні властивості амфотерних гідроксидів на прикладі цинк гідроксиду.
1.Взаємодія з кислотою з утворенням солі та води: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O.
2.Взаємодія з лугом з утворенням солі та води:
Zn (OH)2 + 2NaOH Na2ZnO2 + 2H2O.
Na2ZnO2 + 2H2O.
Загальні способи добування основ. Використання основ
Спільним способом добування основ є взаємодія лугів з розчинами солей. Луги можуть також бути добуті у ході взаємодії лужних та лужноземельних металів або їх оксидів із водою. Розглянемо приклади рівнянь хімічних реакцій, які підтверджують зазначені способи добування основ.
1.Взаємодія лугів з розчинами солей з утворенням нової основи та нової солі:
3NaOH + AlCl3 = 3NaCl + Al(OH)3; K2CO3 + Ba(OH)2 = BaCO3 + 2KOH.
2.Взаємодія лужних і лужноземельних металів з водою з утворенням лугу та водню: 2Na + 2H2O = 2NaOH + H2.
3.Взаємодія оксидів лужних і лужноземельних металів з водою з утворенням лугу:
BaO + H2O = Ba(OH)2.
Основи широко застосовуються у промисловості та побуті. Наприклад, натрій гідроксид використовують у виробництві різноманітних солей Натрію, розчинного скла, мила, штучних волокон, барвників. Калій гідроксид KOH використовують у виробництві
різноманітних солей Калію, рідкого мила та деяких барвників. Кальцій гідроксид Ca(OH)2 (традиційна назва «гашене вапно») застосовується для приготування вапняного розчину, який використовується у будівництві.
Класифiкація солей. Середні солі, їх склад, назви
Солями називають складні речовини, які утворені атомами металів і кислотних залишків. Сума одиниць валентності металу повинна дорівнювати сумі одиниць валентностей кислотного залишку. Солі за своїм складом поділяються на середні, кислі, основні та
подвійні.
Середні (нормальні).
Утворюються при повному заміщенні атомів Гідрогену в молекулах кислот атомами металів. Наприклад: Na2CO3, BaCl2.
Кислі.
Утворюються при неповному заміщенні атомів Гідрогену в молекулах кислот атомами металів. Наприклад: NaHCO3, KH2PO4.
Основні.
Утворюються при неповному заміщенні гідроксильних груп у молекулах основ кислотними залишками. Наприклад: Mg(OH)Cl, Ba(OH)Br.
Подвійні.
Утворюються при заміщенні атомів Гідрогену в молекулах кислот двома різними металами. Наприклад: KAlSO4, K2NaPO4.
Тепер перейдемо до детальнішого розгляду середніх солей. За сучасною українською науковою номенклатурою назву солі утворюють з назв катіона та аніона. Якщо метал виявляє змінну валентність, то її обов’язково зазначають у назві солі. Назва аніона (кислотного залишку) утворюється від назви відповідної кислоти, виключаючи з назви кислоти закінчення -на. Наприклад: кальцій карбонат CaCO3, купрум (II) нітрат Cu(NO3)2, натрій ортофосфат Na3PO4.
Фізичні та хімічні властивості середніх солей
Солі є крихкими кристалічними речовинами. Вони, як правило, мають високі температури плавлення та різну розчинність у воді. Усі солі мають іонну будову.
Для середніх солей характерні такі хімічні властивості.
1.Взаємодія солі з металом з утворенням іншої солі та іншого металу:
CuSO4 + Fe = FeSO4 + Cu.
Такі реакції перебігають у водних розчинах, тому для них не можна використовувати метали, які за звичайних умов реагують із водою (наприклад, літій, натрій, калій, кальцій, барій та інші активні метали). У ході складання рівнянь таких хімічних реакцій необхідно користуватись рядом напруг металів. Більш активні метали можуть витискувати менш активні з розчинів солей. Чим лівіше розташований метал у ряді напруг, тим він є більш активним.
2.Взаємодія солі з кислотою з утворенням іншої солі та іншої кислоти:
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O.
У процесі реакції обміну утворюється карбонатна кислота, яка є нестійкою та одразу розпадається з утворенням вуглекислого газу та води:
H2CO3 CO2 + H2O.
CO2 + H2O.
3.Взаємодія розчинів солей з лугами з утворенням іншої основи та іншої солі: ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl.
4.Взаємодія солей з солями:
KCl + AgNO3 = AgCl + KNO3.
Реакції такого типу перебігають у розчинах і використовуються для добування практично нерозчинних солей.
Загальні способи добування солей. Поширення солей у природі та їх практичне значення
Розглянемо загальні способи добування солей.
1.Взаємодія металів із неметалами: 2Na + S = Na2S.
2.Взаємодія кислот із металами (розташованими у ряді напруг до водню), основними оксидами та основами:
Mg + 2HCl = MgCl2 + H2; Na2O + H2SO4 = Na2SO4 + H2O;
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O.
3.Взаємодія кислотних оксидів з основними оксидами та лугами:
SO3 + K2O = K2SO4;

N2O5 + Ca(OH)2 = Ca(NO3)2 + H2O.
4. Взаємодія солей з металами, кислотами, лугами та іншими солями: CuSO4 + Fe = FeSO4 + Cu;
FeS + 2HCl = FeCl2 + H2S;
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl;
BaCl2 + Na2SO4 = BaSO4 + 2NaCl.
Солі широко розповсюджені у природі та відіграють важливу роль у процесах обміну речовин у рослинних і тваринних організмах. Солі містяться у клітинному соку живих організмів, входять до складу різних тканей: кісткової, нервової, м’язової та інших. Також солі містяться у питній воді. Солі використовуються у промисловості та побуті. Вони необхідні для добування багатьох металів, мінеральних добрив, скла, мінеральних фарб, мийних засобів. Наприклад, натрій карбонат Na2CO3 використовують у виробництві скла. Природний кальцій ортофосфат Ca3(PO4)2 застосовують для одержання фосфорних добрив. Калій хлорид KCl використовують як калійне добриво та як вихідну речовину для добування інших солей Калію. Натрій хлорид NaCl є вихідною сировиною для добування соди, хлору та інших речовин.
Генетичні зв’язки між класами неорганічних сполук. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакцій
Із речовин одного класу можна добути речовини іншого класу. Такий зв’язок між класами неорганічних сполук називають генетичним. Розглянемо його більш детально. Із простих речовин можна одержати складну речовину, наприклад:
2Ca + O2 = 2CaO.
Зі складної речовини можна одержати прості речовини, наприклад:
2H2O  2H2 + O2.
2H2 + O2.
Із металу під час реакції горіння можна одержати основний оксид, який з водою утворить основу. Під час дії на основу кислотою в ході реакції нейтралізації можна одержати сіль. Розглянемо такий генетичний зв’язок на прикладі металу барію. Складемо схему:
Ba |
BaO |
Ba(OH)2 |
Ba3(PO4)2. |
|
Складемо рівняння хімічних |
реакцій, |
за допомогою яких можна здійснити такі |
||
перетворення:
1)2Ba + O2 = 2BaO;
2)BaO + H2O = Ba(OH)2;
3)3Ba(OH)2 + 2H3PO4 = Ba3(PO4)2 + 6H2O.
Із неметалу під час реакції горіння можна одержати кислотний оксид, який з водою утворить кислоту. Під час дії на кислоту основою в ході реакції нейтралізації можна одержати сіль. Розглянемо такий генетичний зв’язок на прикладі неметалу фосфору. Складемо схему:
P  P2O5
P2O5  H3PO4
H3PO4  Ba3(PO4)2
Ba3(PO4)2
Складемо рівняння хімічних реакцій, за допомогою яких можна здійснити такі перетворення:
1)4P + 5O2 = 2P2O5;
2)P2O5 + 3H2O = 2H3PO4;
3)2H3PO4 + 3Ba(OH)2 = Ba3(PO4)2 + 6H2O.
Наведені вище схеми генетичних зв’язків можна представити у загальному вигляді такими схемами:
метал → основний оксид → основа → сіль; неметал → кислотний оксид → кислота.
Розглянемо приклади задач, пов’язаних із розрахунками за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакцій.
Розв’язання задач такого типу треба починати зі складання рівняння або кількох рівнянь тих реакцій, про які йдеться в задачі. Розрахунки можна проводити тільки за рівнянням реакції, тому необхідно уважно перевірити всі коефіцієнти. Коефіцієнти показують не тільки число молекул вихідних речовин і продуктів реакції, а ще й кількість моль речовин, які беруть участь у реакції.
ЗМ 2.2. Загальні відомості про металічні елементи та метали
Метали мають величезне значення у розвитку людської цивілізації. З давніх-давен людству відомі золото, срібло, мідь та залізо. Сучасна металургія отримує для потреб техніки понад 60 металів та більше 5000 сплавів на їх основі. Розглянемо положення елементів-металів у Періодичній системі Д. І. Менделєєва. Якщо провести лінію від Бору до Астату, то можна помітити, що усі елементи, розташовані лівіше від проведеної лінії, відносять до металічних. Правіше цієї межі розміщені переважно елементи-неметали та деяка частина d-елементів, що належать до так званих перехідних металів (наприклад: Хром, Ферум, Платина). Бачимо, що переважна більшість відомих хімічних елементів є металічними. Атоми елементів-металів на зовнішньому енергетичному рівні містять невелику кількість електронів – від одного до трьох, зрідка – чотири. Намагаючись набути стійкої електронної конфігурації інертних газів, металічні елементи легко віддають електрони, утворюючи катіони. Чим менше електронів міститься на зовнішньому енергетичному рівні й чим більший радіус атома, тим легше атом металічного елемента перетворюється на відповідний катіон. За цієї причини у періодах у разі збільшення заряду атомного ядра металічні властивості зменшуються, а в групах – збільшуються. Метали є речовинами немолекулярної будови. Оскільки атоми елементівметалів здатні віддавати електрони із зовнішнього енергетичного рівня, то у вузлах кристалічної ґратки металів містяться позитивні іони та деяка частина нейтральних атомів. Між ними хаотично пересуваються відносно вільні електрони, які стають спільними для всієї кристалічної ґратки. Таку кристалічну ґратку називають металічною. Спарені електрони, вільно пересуваючись, компенсують сили електростатичного відштовхування між позитивно зарядженими іонами і, таким чином, забезпечують хімічний зв’язок у кристалі металу. Зв’язок, який здійснюють відносно вільні електрони між катіонами металів кристалічної ґратки, називають металічним. Фізичні властивості металів зумовлені особливостями їх будови. За звичайних умов усі метали (за винятком ртуті) є твердими кристалічними речовинами. Температури плавлення металів значно відрізняються: цезій можна розплавити у долоні, а температура плавлення вольфраму +3410 °С. Більшість металів, за винятком золота й міді, мають сріблясто-білий або сріблясто-сірий колір. Усі метали мають характерний металевий блиск, який пояснюється наявністю в них вільних
електронів. У вигляді порошку метали втрачають блиск (крім магнію та алюмінію) і набувають чорного або темно-сірого кольору. Усі метали – добрі провідники електричного струму. Це пояснюється наявністю вільних електронів, які під впливом навіть невеликої різниці потенціалів починають пересуватись у певному напрямку. Найкращими провідниками електричного струму є срібло, мідь, золото, алюміній і залізо. Метали мають високу теплопровідність, яка також пояснюється високою рухливістю електронів.
Більшість металів пластичні. Їх можна кувати, витягати у дріт, прокочувати у тонкі листи. При цьому відбувається зсув атомів та іонів кристалічної ґратки, але зв’язки між ними не розриваються завдяки руху відносно вільних електронів. Пластичність зменшується у ряді Au, Ag, Cu, Sn, Pb, Zn, Fe. Золото можна прокатати у тонку фольгу товщиною до 0,003 мм.
Метали відрізняються своєю твердістю. Найбільш твердим є хром, яким можна різати скло. Найбільш м’якими є натрій і калій, які легко ріжуться ножем. Також метали різняться своєю густиною. Найлегшим з металів є літій, а найважчим – осмій.
Хімічні властивості металів зумовлені здатністю їх атомів легко віддавати електрони із зовнішнього енергетичного рівня, перетворюючись на позитивно заряджені іони. Таким чином, у хімічних реакціях метали проявляють себе енергійними відновниками. Це і є їх головною загальною хімічною властивістю.
Здатність віддавати електрони в атомів окремих металічних елементів є різною. Чим легше метал віддає свої електрони, тим він активніший і тим енергійніше реагує з іншими речовинами. На основі досліджень всі метали були розташовані в ряд відповідно до зменшення їх активності. Цей ряд вперше запропонував видатний вчений М. М. Бекетов. Такий ряд активності металів називають ще рядом металів. Він має наступний вигляд:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au.
За допомогою цього ряду можна визначити, який метал є активнішим за інший. У цьому ряді присутній водень, який не є металом. Його віднові властивості прийняті для порівняння за своєрідний нуль.
Маючи властивості відновників, метали реагують із різними окисниками, насамперед із неметалами. З киснем метали реагують за нормальних умов або під час нагрівання з утворенням оксидів, наприклад:
2Mg0 + O02 = 2Mg+2O-2.
У цій реакції атоми Магнію окиснюються, атоми Оксигену відновлюються. Благородні метали, що знаходяться наприкінці ряду, з киснем не реагують. Активно відбуваються реакції з галогенами, наприклад, згоряння міді у хлорі:
Cu0 + Cl02 = Cu+2Cl-2.
Реакції з сіркою найчастіше відбуваються під час нагрівання, наприклад:
Fe0 + S0 = Fe+2S-2.
Активні метали, що знаходяться в ряді активності металів до Mg, реагують із водою з утворенням лугів та водню:
2Na0 + 2H+2O → 2Na+OH + H02.
Метали середньої активності від Al до H2 реагують із водою у більш жорстких умовах і утворюють при цьому оксиди й водень:
Pb0 + H+2O  Pb+2O + H02.
Pb+2O + H02.
Метали, що містяться після Н2 у вище наведеному ряду металів з водою не реагують і водень не витісняють. У реакціях з водою атоми металічних елементів віддають електрони і є відновниками. Окисниками є атоми Гідрогену з молекул води.
Здатність металу реагувати із кислотами та солями у розчині залежить також від його положення у витискувальному ряді металів. Метали, що стоять у витискувальному ряді металів лівіше водню, зазвичай витісняють (відновлюють) водень із розведених кислот, а метали, що стоять правіше водню, його не витісняють. Так, цинк та магній реагують із розчинами кислот, виділяючи водень і утворюючи солі; а мідь не реагує.
Mg0 + 2H+Cl → Mg+2Cl2 + H02;
Zn0 + H+2SO4 → Zn+2SO4 + H02.
Атоми металів у цих реакціях є відновниками, а іони Гідрогену – окисниками.
Метали реагують із солями у водних розчинах. Активніші метали витискують менш активні метали зі складу солей. Визначити це можна по ряду активності металів. Продуктами реакції є нова сіль і новий метал. Так, якщо залізну пластинку занурити у розчин купрум(ІІ)
сульфату, через якийсь час на ній виділиться мідь у вигляді червоного нальоту:
Fe0 + Cu+2SO4 → Fe+2SO4 + Cu0.
Але якщо у розчин купрум (ІІ) сульфату занурити срібну пластину, то ніякої реакції не відбудеться:
Ag + CuSO4 ≠ .
Для проведення таких реакції не можна брати надто активні метали (від літію до натрію), які здатні реагувати з водою.
Отже, метали здатні реагувати з неметалами, водою, кислотами та солями. У всіх цих випадках метали окиснюються і є відновниками. Для прогнозування перебігу хімічних реакцій за участю металів слід використовувати витискувальний ряд металів.
У вільному стані у природі зустрічаються тільки неактивні метали. Так, у вигляді самородків зустрічаються золото й платина, іноді – срібло та мідь. Добування цих металів пов’язане лише з механічним відокремленням їх від домішок. Більшість металічних елементів легко окиснюються й існують у природі тільки у сполуках: оксидах (Fe3O4, Cr2O3), сульфідах (FeS2, ZnS), солях (NaCl, CaCO3). Саме з таких природних сполук і добувають метали шляхом їх хімічної переробки.
Природні мінеральні сполуки, з яких економічно доцільно видобувати метал у виробничих умовах, називають рудами. Найважливішими рудами є оксиди, сульфіди і карбонати металічних елементів. Першим етапом переробки руд є видалення пустої породи – збагачення руди. Добування металів із руд ґрунтується на їх відновленні різними способами. Найважливіший спосіб одержання металів із руд – відновлення оксидів відповідних металічних елементів вугіллям (коксом) під час нагрівання:
SnO2 + C = Sn + CO2.
Досить часто оксидні руди відновлюють карбон(ІІ) оксидом, а інколи – воднем:
Fe2O3 + 3CO = 2Fe + 3CO2;
WO3 + 3H2 = W + 3H2O.
Сульфідні руди спочатку випалюють, а потім відновлюють одержаний оксид:
2PbS + 3O2 = 2PbO + 2SO2;
PbO + C = Pb + CO.
Важливим методом добування металів є відновлення менш активних металів активнішими металами і деякими неметалами під час нагрівання. Відновлення алюмінієм називають алюмотермією, відновлення магнієм – магнійтермією, силіцієм – силікотермією:
Fe2O3 + 2Al = 2Fe + Al2O3.
За звичайних умов метали можуть вступати у хімічні реакції з речовинами, що містяться у навколишньому середовищі, – киснем та водою. На поверхні металів з’являються плями, метал становиться крихким і не витримує навантажень. Це призводить до руйнування металевих виробів, на виготовлення яких було затрачено велику кількість сировини, енергії та багато людських зусиль.
Корозією називають мимовільне руйнування металів і сплавів під впливом навколишнього середовища.
Яскравий приклад корозії – іржа на поверхні сталевих та чавунних виробів. Щорічно через корозію втрачають близько чверті всього виробленого у світі заліза. Витрати на ремонт або заміну суден, автомобілів, приладів і комунікацій, водопровідних труб у багато разів перевищують вартість металу, з якого вони виготовлені. Продукти корозії забруднюють навколишнє середовище та негативно впливають на життя і здоров’я людей.
Хімічна корозія відбувається у різних хімічних виробництвах. В атмосфері активних газів (водню, сірководню, хлору), в середовищі кислот, лугів, солей, а також у розплавах солей та інших речовин відбуваються специфічні реакції із залученням металевих матеріалів, з яких зроблені апарати, в яких здійснюється хімічний процес. Газова корозія вникає у разі підвищення температури. Під її вплив потрапляють арматура печей, деталі двигунів внутрішнього згоряння. Електрохімічна корозія відбувається, якщо метал міститься у будьякому водному розчині.
Найбільш активними компонентами навколишнього середовища, які діють на метали, є кисень О2, водяна пара Н2О, карбон(IV) оксид СО2, сульфур (IV) оксид SО2, нітроген(IV) оксид NО2. Дуже сильно прискорюється процес корозії під час контакту металів із солоною водою. Із цієї причини кораблі іржавіють у морській воді швидше, ніж у прісній.
Суть корозії полягає в окисненні металів. Продуктами корозії можуть бути оксиди, гідроксиди, солі тощо. Наприклад, корозію заліза можна схематично описати таким рівнянням:
4Fe + 6H2O + 3O2 → 4Fe(OH)3.
Зупинити корозію неможливо, але її можна сповільнити. Існує багато способів захисту металів від корозії, але основним прийомом є запобігання контакту заліза з повітрям. Для цього металеві вироби фарбують, покривають лаком або вкривають шаром мастила. У більшості випадків цього достатньо, щоб метал не руйнувався протягом декількох десятків або навіть сотень років. Інший спосіб захисту металів від корозії – електрохімічне покриття поверхні металу чи сплаву іншими металами, які є стійкими до корозії (нікелювання, хромування, оцинковування, сріблення та золотіння). У техніці дуже часто використовують спеціальні корозійностійкі сплави. Для уповільнення корозії металевих виробів у кислому середовищі також використовують спеціальні речовини – інгібітори.
Оскільки різні метали мають подібний металічний зв’язок та утворюють подібні кристалічні ґратки, то при переході до розплавленого стану вони можуть змішуватись один з одним, утворюючи сплави. У розплавлених металах можуть розчинятися також деякі неметали й складні речовини. Сплав – це система, яка складається принаймні з двох компонентів, з яких хоча б один є металом.
Сплави мають більш різноманітні властивості порівняно з металами, тому у промисловості рідко використовують чисті метали. У більшості випадків для виготовлення деталей різних машин і приладів застосовують сплави. Так мідь, олово, цинк – м’які метали, а сплав на їх основі – бронза – дуже твердий. Тому бронза з давніх часів використовується людиною для виготовлення зброї, сільськогосподарських знарядь праці та інших виробів, які потребують підвищеної твердості. Сплави є найголовнішими конструкційними матеріалами. Їх найрізноманітніші властивості – жаростійкість, корозійна стійкість, міцність, твердість – зумовлюють широке застосування сплавів у техніці.
Сплави виявляють загальні властивості металів: металічний блиск, високі електро- і теплопровідність. Але властивості сплавів відрізняються від властивостей їх компонентів. Твердість сплавів перевищує твердість металів, що входять до їх складу. Ось чому у процесі виготовлення золотих ювелірних виробів для міцності додають мідь або срібло. Густина сплаву дорівнює середній густині металів, що входять до його складу. Температура плавлення сплаву, як правило, менша за температуру плавлення найбільш легкоплавкого компонента. Наприклад, сплав, що складається з 36% свинцю (tпл = 327 ˚C) та 64% олова (tпл = 232 ˚C), плавиться при температурі 181 ˚C. Теплота електропровідність сплавів менші, ніж у окремих металів. Під час змішування металів часто відбувається зміна кольору, наприклад, сплав міді з нікелем, який використовують у процесі карбування монет має білий колір. У наш час створюються сплави із заздалегідь заданими необхідними властивостями.
За своєю внутрішньою кристалічною структурою сплави бувають різними: розчинами, сумішами або сполуками. Якщо атоми одного металу заміщають атоми іншого у вузлах кристалічної ґратки, то утворюються тверді розчини. Це можливо, якщо розміри атомів окремих металів були близькі, а типи кристалічних ґраток збігаються. Прикладом такого сплаву є мельхіор – сплав міді та нікелю. Механічні суміші складаються із кристалів металів. Якщо під час сплавлення метали взаємодіють один з одним, то утворюються інтерметалічні сполуки. Більшість сплавів за своєю структурою є неоднорідними, деякі сплави є однорідними (наприклад, латунь – сплав міді та цинку).
Розрізняють чорні й кольорові сплави. Чорними сплавами називають сплави на основі заліза. До них належать чавун та сталь. Чавуном називають сплав заліза з вуглецем із масовою часткою вуглецю понад 1,7%. Найчастіше чавун містить від 2,6% до 3,6% вуглецю. Крім вуглецю, у чавуні є силіцій, манган, сірка, фосфор та інші компоненти. Чавун – твердий і крихкий матеріал. Його найширше застосовують у машинобудуванні для виготовлення різноманітних деталей. Сталь містить менше 1,7% вуглецю. На відміну від чавуну сталь ковка. За призначенням розрізняють машинобудівну (конструкційну) та інструментальну сталі. Нержавіюча сталь стійка до корозії. Сталь і чавун є найважливішими сплавами сучасної техніки. Обсяги виробництва цих залізовуглецевих сплавів перевищують виробництво всіх інших металів разом узятих більш ніж у десять разів.
Алюмінієві сплави легкі, мають високі електро- і теплопровідність, корозійну стійкість, міцність. Їх застосовують як конструкційні матеріали в авіації, будівництві, машинобудуванні, електротехніці. Сплавам на основі магнію притаманні легкість, міцність,
корозійна стійкість, тому їх використовують в автомобілебудуванні, для виготовлення штампованих виробів складної форми. Титанові сплави застосовують в авіації, ракетобудуванні, для виготовлення хімічної апаратури, а також у медицині. Мідні сплави міцні, мають високу електропровідність, корозійну стійкість, пластичність. З них виготовляють труби, різноманітні апарати й деталі, художні вироби та скульптури.
У ХХІ столітті метали і сплави залишаються найпоширенішими матеріалами, які застосовують у різних галузях.
Добування чавуну базується на відновленні заліза з оксидів Феруму та переводі пустої породи в шлак. Головною технологією виробництва чавуну є виплавка у доменних печах.
Чавун виплавляють у величезних доменних печах висотою до 30 м, а діаметром – до 12 м. Внутрішня частина домни викладена вогнетривкою цеглою, а зовнішня облицьована сталевими листами. Сировиною для виробництва чавуну в доменних печах є залізні руди, паливо та флюси. Таку суміш сировинних матеріалів називають шихтою. Найважливіші залізні руди: магнетит Fе3О4, гематит Fe2О3, пірит FеS2 , сидерит FеСО3. У якості палива використовують кокс, який є продуктом переробки кам’яного вугілля. Іноді замість коксу використовують природний газ або мазут. За допомогою флюсів тугоплавкі домішки та пусту породу перетворюють на легкоплавкі сполуки, шлак. У якості флюсів використовують вапняк СaCO3 і доломіт MgCO3.
Відновлення оксидів Феруму проходить за схемою:
Fe2O3 → Fe3O4 → FeO → Fe.
Зверху в доменну піч загружають руду, кокс і флюси. Знизу через фурми вдувають збагачене киснем і підігріте до 600–800 ºС повітря. У нижній частині печі згоряє кокс.
С + О2 = СО2↑.
За високої температури карбон(IV) оксид взаємодіє з коксом. Продуктом реакції є карбон(ІІ) оксид (чадний газ), який виконує роль відновника у доменному процесі:
СО2 + С = 2СО.
Шихта поступово опускається вниз, а назустріч рухаються нагріті гази. Тим самим здійснюється принцип теплообміну й протитечії реагентів.
Утворений карбон (IІ) оксид за температури 700ºС поступово відновлює залізну руду до утворення заліза:
3Fe2O3 + СО = 2Fe3O4 + СО2↑;
Fe3O4 + СО = 3FeО + СО2↑;
FeО + СО = Fe + СО2↑.
Відновлене у доменній печі залізо частково реагує з вуглецем і чадним газом. Продуктом реакції є цементит Fe3C:
3Fe + 2CO = Fe3C + СО2↑;
3Fe + С = Fe3C.
Під дією високої температури вапняк розкладається:
CaCO3 = CaO + CO2.
Утворений кальцій оксид реагує з тугоплавкими домішками – кислотними оксидами пустої породи. Утворюються легкоплавкі речовини – шлаки:
СаО + SiO2 = CaSiO3.
Залізо поступово опускається у більш гарячу частину печі (розпар) і розчиняє в собі до 4% вуглецю та інші домішки. Утворюється чавун – сплав заліза з вуглецем, карбідом заліза, S, P, Si. Домішки погіршують якість чавуну.
Чавун плавиться та стікає у нижню частину горна, а рідкі шлаки збираються на поверхні. Вони запобігають окисненню чавуну. Чавун і шлаки випускають із печі кілька разів на добу через особливі отвори, забиті глиною. Чавун виливається вогненним потоком при температурі 1500 ºС.
З доменної печі виходять гази, які містять до 25% карбон(ІІ) оксиду. Їх спалюють в особливих апаратах – кауперах. Каупери призначені для попереднього нагрівання повітря, яке вдувають у піч.
Доменна піч працює безупинно. Висока температура у печі підтримується завдяки екзотермічним реакціям. Періодично у піч додають нові порції шихти. В одній доменній печі за добу можна зварити понад 2000 т чавуну. Робота печі триває протягом кількох років, аж до капітального ремонту.
За призначенням до застосування чавун поділяється на три групи: ливарний, спеціальний, передільний. Із ливарного чавуну виливають найрізноманітніші вироби: деталі складної конфігурації, скульптури, предмети декору. Додавання магнію та інших металів значно поліпшує механічні властивості чавуну, зменшує його крихкість. Із передільного чавуну виплавляють сталь.
Доменний шлак використовують для виготовлення шлакобетону, гравію, щебеню тощо.
Сталь порівняно із чавуном містить менше вуглецю, силіцію, сірки та фосфору, отже, для одержання сталі з чавуну потрібно зменшити вміст цих речовин. Виробництво сталі ґрунтується на окисненні домішок, які містяться у чавуні.
Сталь виробляють із чавуну та металобрухту. Спочатку кисень, який поступає з повітрям, окиснює залізо і вуглець:
2Fe +O2 = 2FeO; 2C + O2= 2CO.
Потім утворений ферум(ІІ) оксид окиснює домішки – силіцій, манган, фосфор і вуглець:
Si + 2FeO = SiO2 + 2Fe; Mn + FeO =MnO + Fe; 2P + 5FeO = P2O5 + 5Fe;
C + FeO = CO + Fe.
За рахунок теплоти, що виділяється під час реакцій, підтримується висока температура. Отримані оксиди силіцію(IV) та фосфору(V) реагують із флюсами з утворенням легкоплавких шлаків, які видаляють із печі:
P2O5 + СaCO3 = Ca3(PO4)2 + CO2; |
SiO2 + СaCO3 = CaSiO3 + CO2. |
Надлишок ферум (ІІ) оксиду видаляють за допомогою металів - розкисників (мангану, ванадію, титану), які відновлюють атоми Феруму з ферум (ІІ) оксиду у вигляді заліза:
Mn + FeO = MnO + Fe.
Додатково під час виплавки сталі додають так звані легуючі добавки (кобальт, нікель, вольфрам, хром тощо), які надають сталі корозійної стійкості, міцності та інших властивостей, необхідних у процесі її застосування.
Отже, процес виплавляння сталі є окисно-відновним процесом.
Існує кілька способів переробки чавуну на сталь: конвертерний, мартенівський та електротермічний.
Конвертерний спосіб виробництва сталі запропонував англійський інженер-винахідник Генрі Бесемер у 1856 році. За цим методом використовують спеціальний конвертер, який має грушоподібну форму і може обертатись. Його виготовлено зі сталевих листів, а зсередини він викладений вогнетривкою цеглою. Конвертер працює періодично. Конвертер наповнюють у похилому положенні розплавленим чавуном і металобрухтом, а виробництво проводять у вертикальному положенні. У конвертер через спеціальну камеру й отвори нагнітається повітря, що окиснює домішки. Після закінчення процесу подачу повітря припиняють, переводять конвертер у горизонтальне положення, випускають шлак і додають метали - розкисники. Увесь процес триває 15–20 хвилин. Готову сталь виливають у ківш і направляють до інших цехів.
Застосовуючи киснево-конвертерний спосіб, замість повітря у конвертер продувають кисень. Збагачення киснем скорочує тривалість продувки, а також збільшує продуктивність конвертера.
За мартенівським методом, який запропонував у 1864 році французький металург П’єр Мартен, металобрухт, чавун і флюси завантажують у піч через завалочні вікна. У мартенівських печах спалюють мазут або попередньо підігріті гази. Кисень або повітря пропускають над розплавленим чавуном. Готовий метал випускають із печі через отвори, розташовані у найнижчій частини подини. На час плавки випускний отвір забивають вогнетривкою глиною. Для інтенсифікації мартенівського процесу повітря збагачують киснем.
Переробку чавуну на сталь здійснюють також в електричних дугових печах при температурі 2000 ºС і вище. Це сприяє повнішому видаленню фосфору та сірки за рахунок зв’язування їх у шлаки. В електропечах виплавляють високоякісні вуглецеві й леговані сталі та феросплави.
ЗМ 2.3. Металічні елементи та їх сполуки
Натрій і Калій є елементами головної підгрупи І групи Періодичної системи Д. І. Менделєєва. На зовнішньому енергетичному рівні атомів цих елементів знаходиться 1 неспарений s-електрон. Намагаючись завершити зовнішній енергетичний рівень, атоми цих елементів енергійно віддають один електрон і виявляють властивості активних відновників.
Усвоїх сполуках ці елементи є одновалентними. Отже, Натрій та Калій — типові представники лужних металічних елементів.
Уприроді лужні елементи трапляються лише у вигляді солей. Найважливішими мінералами Натрію є кам’яна сіль (або галіт) NaCl, чилійська селітра NaNO3, глауберова сіль (або
мірабіліт) Na2SO4 |
10H2O. |
Велика кількість солей Натрію кристалізується |
під час |
випаровування морської води. |
Масова частка Натрію у земній корі становить 2,6%. |
Калій, як |
|
і Натрій, є досить розповсюдженим хімічним елементом. Масова частка Калію в земній корі
– 2,5%. Природні солі Калію – сильвін KCl, сильвініт КCl · NaCl, карналіт КCl · MgCl2 · 6H2O. Калій входить до складу польових шпатів і слюди.
Катіони Натрію та Калію відіграють важливу роль у життєдіяльності живих організмів. Натрій міститься у кістковій тканині, крові, мозку, легенях, рідині ока, спинномозковій рідині. Катіони Натрію беруть участь у підтримці осмотичного тиску та кислотно-лужної рівноваги, у проведенні нервових імпульсів. Калій міститься у кістковій тканині, м’язах, крові, мозку, серці, нирках. Катіони Калію беруть участь у проведенні біоелектричних потенціалів у нервах і м’язах, у регуляції скорочень серця та інших м’язів, підтримують осмотичний тиск у клітинах, активують деякі ферменти.
За фізичними властивостями натрій і калій є типовими металами. Вони мають сріблястобілий колір, високі електро- і теплопровідність. Відрізняються вони тим, що є досить пластичними, м’якими (їх легко різати ножем), легкими (плавають на поверхні води) та легкоплавкими. Свіжі зрізи натрію і калію блищать. Ці метали дуже активні, тому їх зберігають під шаром гасу, або в запаяних ампулах.
Натрій та калій мають високу хімічну активність і є сильними відновниками. На повітрі натрій та калій легко окиснюються. Продуктами реакції є відповідні оксиди й пероксиди цих елементів:
4Na + O2 = 2Na2O; 2Na + O2 = Na2O2; 4K + O2 = 2K2O K +O2 = KO2.
Натрій та калій активно реагують із галогенами з виділенням світла. Під час взаємодії натрію з хлором утворюється натрій хлорид:
2Na + Сl2 = 2NaСl.
Продуктами реакцій натрію та калію з сіркою є сульфіди цих елементів, наприклад:
2K + S = K2S.
Під час взаємодії натрію та калію з водою утворюється відповідний луг і газуватий водень.
Натрій реагує з водою досить активно:
2Na + 2H2O = 2NaOH +H2↑
Реакція калію з водою відбувається ще активніше з можливим самозайманням водню:
2K + 2H2O = 2KOH +H2.
Натрій та калій добувають електролізом розплавів хлоридів і гідроксидів цих елементів. Вперше натрій та калій були отримані у 1807 році англійським ученим Гемфрі Деві.
Натрій використовують як наповнювач газорозрядних ламп. У металургії натрієм відновлюють деякі рідкісні метали: титан, цирконій, тантал. Калій використовують у фотоелементах. Натрій, калій та їхні сплави застосовують як теплоносії в ядерних енергетичних установках. Калій є важливими елементом для розвитку рослин, і додається до ґрунту у вигляді калійних добрив.
Кальцій – металічний елемент головної підгрупи ІІ групи 4 періоду періодичної системи хімічних елементів. Він належить до родини лужноземельних металів. На зовнішньому енергетичному рівні атома Кальцію міститься 2 спарених s-електрони, які він здатен енергійно віддавати у процесі хімічної взаємодії. Таким чином, Кальцій є відновником і у своїх сполуках має ступінь окиснення +2.
У природі Кальцій трапляється лише у вигляді солей. Масова частка Кальцію у земній корі – 3,6%. Основним природним мінералом Кальцію є кальцит CaCO3 та його різновиди – вапняк, крейда, мармур. Існують і живі організми (наприклад, корали), кістяк яких складається переважно з кальцій карбонату. Також важливими мінералами Кальцію є доломіт CaCO3 · MgCO3, флюорит CaF2, гіпс CaSO4 · 2H2O, апатит, польовий шпат тощо.
Кальцій відіграє важливу роль у життєдіяльності живих організмів. Масова частка Кальцію в людському організмі становить 1,4–2%. Він входить до складу зубів, костей, інших тканин і органів, бере участь у процесі згортання крові, збуджує серцеву діяльність. Щоб забезпечити організм достатньою кількістю Кальцію, слід обов’язково споживати молоко і молочні продукти, зелені овочі, рибу.
Проста речовина кальцій – це типовий метал сріблясто-білого кольору. Він досить твердий, пластичний, має густину 1,54 г/см3 і температуру плавлення 842 ºС.
Хімічно кальцій дуже активний. За звичайних умов він легко взаємодіє з киснем і вологою повітря, тому його зберігають у герметично закритих посудинах. За умов нагрівання у повітрі кальцій загоряється і утворює оксид:
2Ca + O2 = 2CaO.
Із хлором і бромом кальцій реагує під час нагрівання, а із фтором – навіть на холоді. Продуктами цих реакцій є відповідні галогеніди, наприклад:
Сa + Сl2 = CaСl2.
У процесі нагрівання кальцію із сіркою утворюється кальцій сульфід:
Ca + S = CaS.
Кальцій може реагувати і з іншими неметалами.
Взаємодія з водою призводить до утворення малорозчинного кальцій гідроксиду та виділення газуватого водню:
Ca + 2H2O = Ca(OH)2 + H2.
Металічний кальцій широко використовується. Його використовують як метал - розкисник у процесі виготовлення сталей і сплавів, як відновник для добування деяких тугоплавких металів.
Кальцій отримують електролізом розплаву кальцій хлориду. Таким способом кальцій був вперше отриманий у 1808 році Гемфрі Деві.
Найважливішими сполуками Кальцію є кальцій оксид і кальцій гідроксид.
Кальцій оксид СаО – біла тугоплавка кристалічна речовина. Його отримують розкладанням вапняку при нагріванні до 1000 ºС: СаСО3 = СаО + СО2.
Кальцій оксид має основні властивості. Він активно взаємодіє з водою, утворюючи кальцій гідроксид: СаО + Н2О = Са(ОН)2.
За цією реакцією кальцій оксид отримав побутову назву – «негашене вапно». У процесі його взаємодії з водою (під час так званого «гасіння») виділяється багато теплової енергії, яка перетворює воду на водяну пару. Під її дією і утворюється пухкий порошок кальцій гідроксиду, який називають «гашеним вапном».
Взаємодія з кислотними оксидами призводить до утворення солей, наприклад, у процесі взаємодії з вуглекислим газом утворюється кальцій карбонат: СаО + СО2 = СаСО3.
Кальцій оксид легко взаємодіє з вологою та вуглекислим газом повітря, тому його зберігають у щільно закритих посудинах.
У процесі взаємодії кальцій оксиду з кислотами утворюються солі, наприклад кальцій хлорид: СаО + 2НСl = СаСl2 + H2O.
Використовують кальцій оксид у промисловості головним чином для добування кальцій гідроксиду.
Кальцій гідроксид Са(ОН)2 (гашене вапно) – сіруватий малорозчинний у воді порошок. При змішуванні надлишку гашеного вапна з водою утворюється суспензія – так зване «вапняне молоко». Після фільтрування «вапняного молока» отримують прозорий розчин кальцій гідроксиду, який називають «вапняною водою».
Кальцій гідроксид є лугом, тому фенолфталеїн у його розчині набуває малинового забарвлення. Кальцій гідроксид вступає у реакції нейтралізації, наприклад, із хлоридною кислотою:
Са(ОН)2 + 2НСl = СаСl2 + 2H2O.
Маючи основні властивості, кальцій гідроксид реагує з кислотними оксидами. Під час пропускання карбон(IV) оксиду через вапняну воду утворюється осад кальцій карбонату:
Са(ОН)2 + СО2 = СаСО3↓ + Н2О.
Ця реакція є якісною для виявлення вуглекислого газу.
Гашене вапно входить до складу багатьох будівельних сумішей. Після змішування з водою та піском під дією вуглекислого газу такий будівельний розчин поступово твердне. Гашене вапно використовують також під час виробництва скла, для вапнування кислих ґрунтів, для пом’якшення води. Вапняне молоко використовують у виробництві цукру, у процесі

виготовлення сумішей для побілки дерев і боротьби з хворобами рослин. Вапняну воду використовують у лабораторній практиці для виявлення вуглекислого газу.
Тве́рдість води́.. Якщо вода містить значні кількості солей Кальцію, Магнію, то таку воду називають твердою, а коли цих солей зовсім немає або вони містяться в незначних кількостях – м’якою.
Відрізняють тимчасову (або карбонатну) твердість води і сталу. Тимчасова твердість обумовлюється наявністю кислих карбонатів, гідрогенкарбонатів кальцію і магнію (Ca(HCO3)2 та Mg(HCO3)2), а стала – наявністю сульфатів, хлоридів кальцію, магнію (CaSO4, MgSO4, CaCl2 і MgCl2). Загальна твердість води являє собою суму тимчасової і сталої твердості.
Тверда вода непридатна майже для всіх галузей виробництва. Так, наприклад, тверду воду не можна використовувати для прання білизни, миття шерсті й фарбування тканин,бо в ній мило втрачає свою мийну здатність. Це пояснюється тим, що розчинний у воді натрій стеарат (С17Н35СООNa), який становить головну складову частину мила, переходить у нерозчинний кальці стеарат (або магнію), утворюючи так зване кальцієве (або магнієве)
мило: 2С17Н35СООNa + CaSO4 = Са(С17Н35СОО)2↓ + Na2SO4.
При цьому мильна піна утворюється тільки після повного осадження іонів кальцію і магнію, на що непродуктивно витрачається багато мила. Крім того, утворюваний осад кальцієвого та магнієвого мила міцно осідає на волокнах тканин і забруднює їх, а при фарбуванні утворює плями.
Тверда вода непридатна й для цілого ряду інших виробництв: паперового, шкіряного, крохмального, спиртового тощо. Вона непридатна і для паросилового господарства, бо у процесі кип’ятіння води утворюється накип, який погано проводить тепло, внаслідок чого збільшуються витрати палива. Накип викликає інтенсивне руйнування стінок котлів, що може призвести до аварії.
Для приготування їжі тверду воду теж не вживають, бо в ній погано розварюються м’ясо і овочі. Для пиття вона також непридатна.
Способи зниження твердості води
Для зниження твердості води застосовують різні способи. Серед них найбільш поширеним є так званий содово-вапняний спосіб. Суть його полягає у тому, що до води додають розраховану кількість розчину гідроксиду кальцію Са(ОН)2 (вапняної води) і соди Na2CO3.
Кальцій гідроксид знижує карбонатну (тимчасову) твердість:
∙Ca(НСО3)2 + Са(ОН)2 = 2СаСО3 ↓ + 2Н2О;
∙Mg(НСО3)2 + Са(ОН)2 = MgCO2 ↓ +CaCO3 ↓ +2Н2О. Сода знижує сталу твердість води:
∙СаС12 + Na2СО3 = СаСO3 ↓ +2NaCl;
∙MgSO4 + Na2СО3 = MgCO3 ↓ + Na2SO4.
Утворені осади карбонатів кальцію та магнію відфільтровують.
Карбонатну твердість можна усунути також шляхом нагрівання води до кипіння. При цьому кислі карбонати розкладаються з утворенням нормальних карбонатів кальцію та магнію, які виділяються в осад:
∙ Са(НСО3)2 = СаСО3↓ + Н2О + СО2↑;

∙ Mg(НСО3)2 = MgСО3 ↓ + Н2О + СО2 ↑.
Тому карбонатну жорсткість називають також тимчасовою.
Алюміній – металічний елемент головної підгрупи ІІІ групи 3 періоду Періодичної системи. Електронна конфігурація зовнішнього енергетичного рівня його атома 3s23p1. У ході хімічних взаємодій у збудженому стані він здатен утворювати три ковалентних зв’язки або повністю віддавати свої три електрони, виявляючи у своїх сполуках ступінь окиснення +3. Отже, Алюміній є активним відновником.
Алюміній за поширеністю посідає третє місце серед інших елементів. Масова частка Алюмінію в земній корі становить 8,5%. У природі він зустрічається тільки у вигляді сполук. Він входить до складу алюмосилікатів, до яких належать глини, слюди, польові шпати, зокрема каолін. Промислово важливою алюмінієвою рудою є боксит Al2O3 · nН2О. Алюміній входить до складу мінералу корунду, що є кристалічним алюміній оксидом Al2O3. Різні домішки здатні надавати корундові різних кольорів: зеленого, жовтого, жовтогарячого, фіолетового та інших. Його синій різновид називають сапфіром, а червоний – рубіном. І рубіни, і сапфіри є коштовними каменями.
Проста речовина алюміній – блискучий сріблясто-білий метал. Він має високу здатність відбивати світлові й теплові промені, а також високі тепло - та електропровідність. Температура плавлення алюмінію – 660 °С. Це досить легкий та пластичний метал. З нього можна виробляти тонкий дріт і фольгу.
Хімічно алюміній дуже активний. Під дією повітря він швидко окиснюється і вкривається тонкою плівкою алюміній оксиду. Оксидна плівка є досить міцною та зумовлює корозійну стійкість алюмінію. Під час нагрівання у повітрі чи в кисні алюміній згоряє, утворюючи також алюміній оксид:
4Al + 3O2 = 2Al2O3.
Алюміній активно реагує з іншими неметалами. За звичайних умов він взаємодіє з хлором і бромом, утворюючи солі, наприклад, алюміній хлорид:
2Al + 3Сl2 = 2AlСl3.
Реакція алюмінію з йодом відбувається, якщо до суміші алюмінієвого порошку з йодом додати кілька крапель води, яка виконує роль каталізатора:
2Al + 3I2 = 2AlІ3.
Під час нагрівання алюміній реагує із сіркою, азотом, вуглецем, наприклад:
2Al + 3S = Al2S3.
У звичайному стані алюміній покритий захисною оксидною плівкою та є стійким до дії води навіть під час нагрівання. Якщо плівка алюміній оксиду буде зруйнована, то алюміній буде активно реагувати з водою з виділенням газуватого водню:
2Al + 6Н2О = 2Al(ОН)3↓ + 3Н2↑.
Алюміній реагує з розчинами кислот з утворенням солей і водню, наприклад:
2Al + 6НСl= 2AlCl3 + 3Н2↑.
Концентровані сульфатна та нітратна кислоти пасивують алюміній, тобто збільшують міцність оксидної плівки. Таким чином, алюміній з ними не реагує.
Оксидна плівка легко розчиняється в лугах. Алюміній реагує з розчинами лугів з виділенням водню:
2Al + 2NaOH +6Н2O = 2Na[Al(OH)4] + 3Н2↑.
Алюміній відновлює метали з їх оксидів під час нагрівання (алюмінотермія), наприклад:
Fe2O3 + 2Al = 2Fe + Al2O3.
Алюміній добувають шляхом електролізу глинозему, розчиненого у розплавленому кріоліті Na3[AlF6].
Широке застосування алюмінію зумовлене його властивостями. Поєднання легкості з достатньо високою електропровідністю дозволяє застосовувати алюміній як провідник електричного струму. Алюміній та його сплави використовують практично в усіх галузях сучасної техніки: в авіаційній і автомобільній промисловості, залізничному та водному транспорті, машинобудуванні тощо. Завдяки високій корозійній стійкості алюміній широко застосовують у процесі виготовлення апаратури для виробництва харчових продуктів і деяких хімічних речовин. Із полірованого алюмінію виготовляють дзеркала й поверхні нагрівальних та освітлювальних рефлекторів. Алюміній використовують як метал – розкисник сталей та інших сплавів. Ним відновлюють метали з їх оксидів. Найважливішими сполуками Алюмінію є алюміній оксид і алюміній гідроксид. Алюміній оксид Al2O3 – біла тугоплавка кристалічна речовина, нерозчинна у воді. У лабораторних умовах алюміній оксид добувають спалюванням алюмінію або термічним розкладанням алюміній гідроксиду:
4Al + 3O2 → 2Al2O3; 2Al(OH)3  Al2O3 + 3H2O.
Al2O3 + 3H2O.
За хімічними властивостями алюміній оксид є амфотерним. Він реагує з кислотами, проявляючи властивості основних оксидів: Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Реагуючи з лугами, він проявляє властивості кислотних оксидів. У розчинах лугів утворюються комплексні сполуки: Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4].
У процесі сплавлення утворюються солі метаалюмінієвої кислоти, наприклад, калій метаалюмінат: Al2O3 + 2KOH  2KAlO2+ H2O.
2KAlO2+ H2O.
Природну кристалічну модифікацію алюміній оксиду (корунд) застосовують у різних галузях науки і виробництва. Рубіни, наприклад, є матеріалом для виготовлення робочих каменів точних механізмів. Кристали корунду – робочі тіла лазерів. Рубіни та сапфіри використовують для оздоблення ювелірних виробів. Алюміній оксид є головною складовою наждаку – абразивного матеріалу. Тугоплавкість і корозійна стійкість алюміній оксиду зумовлює його застосування для виготовлення термостійкого хімічного посуду, цегли для мурування скловарних печей.
Алюміній гідроксид Al(OH)3 – це нерозчинна у воді кристалічна речовина білого кольору. У лабораторії алюміній гідроксид добувають із розчинних солей Алюмінію у процесі їх взаємодії з розчинами лугів, наприклад: AlCl3 + 3КOH = Al(OH)3↓ + 3КCl.
Отриманий алюміній гідроксид має вигляд драглистого осаду.
Алюміній гідроксид виявляє амфотерні властивості й розчиняється як у кислотах, так і в лугах:
Al(OH)3 + 3HCl → AlCl3 + 3H2O; Al(OH)3 + NaOH → Na[Al(OH)4].
У процесі сплавлення алюміній гідроксиду з натрій гідроксидом утворюється натрій метаалюмінат:
Al(OH)3 + NaOH  NaAlO2+ 2H2O.
NaAlO2+ 2H2O.
Здатність алюміній гідроксиду реагувати з кислотами використовують у терапії. Він входить до складу лікарських препаратів, які використовують для зниження кислотності та зменшення печії.
Отже, головними особливостями алюміній оксиду й алюміній гідроксиду є їх амфотерні властивості.
Ферум – металічний елемент побічної підгрупи VІІІ групи 4 періоду періодичної системи хімічних елементів. Він є представником d-елементів. На зовнішньому енергетичному рівні атома Феруму знаходиться два s-електрони, а на наперед останньому енергетичному рівні відбувається заповнення d-підрівня. У своїх сполуках Ферум здатен виявляти ступені окиснення +2 та +3.
Масова частка Феруму в земній корі становить 5%. Він посідає четверте місце за розповсюдженістю у природі. Найважливішими залізними рудами є магнетит Fе3О4, гематит Fe2О3, лімоніт — Fe2O3 · nH2O, сидерит FеСО3, пірит FеS2.
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого у печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію перенесення кисню від легень до тканин, а в зворотному напрямку – вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби – недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
Чисте залізо – сріблясто-білий блискучий метал з температурою плавлення 1535ºС та густиною 7,87 г/см3. Від інших металів залізо відрізняється магнітними властивостями. Залізо є дуже пластичним металом і легко піддається обробці.
Залізо належить до металів середньої активності. Хімічно чисте залізо стійке до корозії. Однак незначні частки домішок позбавляють його цієї властивості.
Залізо згоряє у кисні. Продукт цієї реакції – залізна ожарина: 3Fe + 2O2 = Fe3O4.
Залізо реагує і з іншими неметалами – галогенами, сіркою, вуглецем. У процесі взаємодії із сильними окисниками, наприклад, хлором утворюються сполуки Феруму зі ступенем окиснення +3: 2Fe + 3Сl2 = 2FeCl3.
А у процесі взаємодії з менш активними окисниками утворюються сполуки зі ступенем окиснення Феруму +2: Fe + S = FeS.
Під дією високої температури залізо реагує з водяною парою. У результаті реакції утворюються залізна ожарина і водень:и 3Fe + 4H2O  Fe3O4 + 4H2↑.
Fe3O4 + 4H2↑.
Залізо реагує з розчинами кислот з утворенням солей та виділенням газуватого водню:
Fe + H2SO4 = FeSO4 +H2↑.
Під дією концентрованих сульфатної та нітратної кислот на поверхні заліза утворюється щільна оксидна плівка; тому ці концентровані кислоти можна зберігати й транспортувати у сталевих цистернах.
Залізо заміщує менш активні метали під час взаємодії з розчинами їх солей:
Fe + CuSO4 = FeSO4 +Cu.
Під дією вологого повітря залізо зазнає корозії. Її продуктом є іржа. Унаслідок своєї пористості іржа не перешкоджає доступу кисню й вологи до металу, що призводить до подальшого руйнування металу.
Залізо – найважливіший метал сучасної техніки. У чистому вигляді залізо майже не використовується, але приблизно 90% металів, що використовуються людством – це сплави на основі заліза. Заліза виплавляється у світі дуже багато, приблизно в 50 разів більше, ніж алюмінію (не говорячи вже про інші метали). На основі заліза створюють сплави, які здатні витримувати вплив високих і низьких температур, вакууму та високих тисків, агресивних середовищ тощо. Сплави заліза широко застосовують як конструкційні та художні матеріали.
Ферум у сполуках виявляє декілька ступенів окиснення, найхарактернішими з яких є +2 і +3.
Ферум(ІІ) оксид FeO – це порошок чорного кольору, погано розчинний у воді. Цей оксид має основні властивості й реагує з кислотами з утворенням солей двовалентного Феруму:
FeO + 2HCl = FeCl2 + H2O.
Ферум(ІІІ) оксид Fe2O3 – порошок темно-червоного або коричневого кольору, практично не розчинний у воді. Він зустрічається у природі у вигляді мінералу гематиту. Цей оксид має амфотерні властивості. Він реагує з кислотами з утворенням солей трьохвалентного Феруму:
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O.
З лугами ферум(ІІІ) оксид взаємодіє під час сплавлення, утворюючи ферати:
Fe2O3 + 2NaOH  2NaFeO2 + H2O.
2NaFeO2 + H2O.
Існує змішаний оксид Fe3O4 (FeO · Fe2O3), який є порошком чорного кольору.
Ферум (ІІ) гідроксид Fe(OH)2 є нерозчинною речовиною білого кольору, яка у контакті з повітрям набуває зеленкуватого кольору. Він утворюється у вигляді осаду за реакцією обміну під час взаємодії розчинів солей двовалентного Феруму з лугами, наприклад:
FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2↓.
Ферум (ІІ) гідроксид має основні властивості й легко розчиняється у кислотах:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O.
Під дією повітря ферум(ІІ) гідроксид поступово окислюється до ферум(ІІІ) гідроксиду:
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3.
Ферум (ІІІ) гідроксид Fe(OH)3 є нерозчинною речовиною бурого кольору. Його можна добути реакцією обміну між солями трьохвалентного Феруму та лугами у розчині:
FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓.
Ферум (ІІІ) гідроксид виявляє амфотерні властивості й може взаємодіяти з кислотами та лугами.
Ферум (ІІ) гідроксид і ферум(ІІІ) гідроксид під час нагрівання розкладаються з утворенням відповідного оксиду та води:
Fe(OH)2  FeO + Н2О.
FeO + Н2О.
Найважливішими солями Феруму є залізний купорос FeSO4 · 7Н2О і ферум(ІІІ) хлорид FeCl3. Залізний купорос застосовують у сільському господарстві для боротьби зі шкідниками рослин, для очищення промислових стічних вод та виготовлення барвників. Ферум(ІІІ) хлорид застосовують у процесах фарбування тканин (як протраву) і виготовлення друкованих плат методом хімічного травлення.
ЗМ 2.4. Неметалічні елементи та їх сполуки
У Періодичній системі Д. І. Менделєєва елементи-неметали містяться у її правій верхній частині. Межа проходить за умовною лінією, яка з’єднала б елементи Бор і Астат. Елементи-неметали належать до р-елементів, за виключенням Гідрогену і Гелію, які є s- елементами (s1 і s2). Усі неметалічні р-елементи мають загальні властивості, бо структура зовнішнього електронного шару їхніх атомів подібна: ns2np1-5. У елементів благородних газів, на відміну від типових неметалів, р-підрівень завершений (має шість електронів) ns2np8. Це зумовлює вкрай низьку їх реакційну здатність, і тому благородні гази не відносять до типових неметалів. Такі особливості у будові атомів неметалів (зокрема – наявність неспарених електронів) визначають здатність елементів приєднувати електрони до завершення енергетичного рівня. Тому в елементів-неметалів переважають окиснювальні властивості й у сполуках з гідрогеном та металами вони мають негативні ступені окиснення.
У властивостях неметалів, незважаючи на подібність у будові валентних рівнів, більше різного, ніж спільного. Зазначимо, що всі елементи-неметали, які починають підгрупи, тобто елементи 2 періоду, різко відрізняються від інших елементів підгрупи та групи. Це пояснюється тим, що атоми цих елементів мають найменший радіус і найбільше значення електронегативності.
Елементи будь-якої групи неметалів утворюють хімічні зв’язки як за рахунок s- та p- електронів, так і за рахунок d-електронів. Тому вони можуть мати ступені окиснення, більші за кількості неспарених електронів.
Для прикладу зіставимо електронні конфігурації атомів Нітрогену 1s22s22p3 й Фосфору 1s22s22p63s23p3.
Із малюнка видно, що атоми Нітрогену і Фосфору у нормальному (не збудженому) стані мають по три неспарених електрони й тому можуть утворювати по три ковалентних зв’язки. Крім того, за рахунок відповідно 2sта 3s-орбіталей інколи утворюється четвертий зв’язок за донорсько-акцепторним механізмом. Тому Нітрогену і Фосфору відповідають такі сполуки: аміак NH3 та йон амонію NH4+, фосфін РН3 та йон фосфонію РН4+. Крім того, атом Фосфору у збудженому стані має п’ять неспарених електронів, що відповідає валентності п’ять. Ось чому атоми Фосфору у молекулі ортофосфорної кислоти (в йоні РO43-) мають валентність 5 і ступінь окиснення + 5. У той же час атом Нітрогену у молекулі азотної кислоти (в йоні NO3- ) має валентність 4, а ступінь окиснення + 5.
Різниця у будові зовнішніх електронних шарів неметалічних елементів відбивається на їх властивостях, а саме на здатності приєднувати електрони. У підгрупах вона поступово зменшується відповідно до зменшення електронегативності, але зростає здатність елементів віддавати електрони, набуваючи при цьому додатніх ступенів окиснення. Значення додатнього ступеня окиснення елементів змінне, що великою мірою залежить від атомівпартнерів, з якими реагуватиме неметал.
Електронегативність елементів визначає тип хімічного зв’язку. Ті елементи-неметали, які розташовані ближче до центру Періодичної системи, утворюють тільки ковалентні сполуки, наприклад: ВС13, SiH4, NO2. Більш електронегативні неметалічні елементи, розташовані справа у Періодичній системі, утворюють як ковалентні (ОF2, Н2О, SО2), так і іонні (LіF, NаСІ)сполуки. Характерними для неметалів є ковалентні сполуки.
Нарешті відзначимо, що атоми неметалів входять до складу комплексних сполук, наприклад: [Сu(NН3)4]SО4, Nа2[Сu(ОН)4].
Із наведеного вище можна зробити висновки:
Неметалічні елементи у Періодичній системі містяться у головних підгрупах IV–VII груп, лише Бор – у III групі. Вони розташовані у верхній правій частині Періодичної системи елементів Д. І. Менделєєва (від умовної лінії «Бор – Астат»).
Елементи-неметали відносять до р-елементів, крім Гідрогену і Гелію. На р-орбіталях міститься від 1 до 5 електронів. Структури зовнішніх електронних рівнів подібні, тому властивості їх аналогічні.
3.Загальні властивості неметалів:
-переважають окиснювальні властивості;
-характерний ковалентний зв’язок, а отже, і ковалентні сполуки.
4.Неметалічні властивості елементів закономірно змінюються у періодах та головних
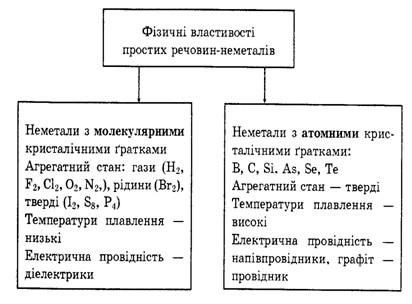
підгрупах Періодичної системи.
5.Кожний перший елемент підгруп неметалів значно відрізняється від інших елементів своїми властивостями. Це взагалі особлива властивість елементів 2 періоду. Вона пояснюється малими радіусами атомів і, відповідно, великими значеннями електронегативності.
6.Неметалічні елементи за властивостями більше різняться між собою, ніж подібні.
Неметалічні елементи утворюють прості речовини, що відрізняються своїм складом. Будова неметалів. Прості речовини-неметали існують у вигляді двохатомних або багатоатомних молекул. Атоми елементів 2 періоду, а також Гідроген утворюють між собою хімічні зв’язки лише за рахунок неспарених s-електронів (Гідроген) і p-електронів, тому вони двохатомні, наприклад: водень Н2, кисень О2, азот N2 та молекули галогенів – На12. Виняток становлять бор і вуглець як тверді речовини. Елементи-неметали 3 періоду утворюють додаткові зв’язки за рахунок вакантних d-орбіталей, тому їх прості речовини багатоатомні за звичайних умов, наприклад: білий фосфор Р4, сірка S8. Карбон утворює багато зв’язків тому, що в його атомі кількість валентних електронів та орбіталей однакова. Зв’язок між атомами у молекулах – ковалентний неполярний.
Більшість неметалів мають молекулярну структуру (молекулярні кристалічні ґратки), а бор, вуглець (алмаз), силіцій, арсен, селен, телур – атомну структуру (атомні кристалічні ґратки). Деякі неметали мають різні структури, бо існують у вигляді алотропних модифікацій.
Будова речовин впливає на їх властивості, насамперед – на фізичні.
Фізичні властивості неметалів. Залежність фізичних властивостей неметалів від їхньої будови відображає наступна схема:
Слід пам’ятати, що одна й та сама речовина може, залежно від умов, виявляти властивості неметалів або металів. Так, фосфор – неметал за звичайних умов, а під тиском вище 4×103 МПа набуває металічних властивостей.
У той же час алотропні модифікації неметалів мають різну будову, що впливає на їх властивості. Зверніть увагу, що лише графіт є електричним провідником. Нині вважають, що електропровідність – це один із головних критеріїв поділу речовин атомної будови на
метали та неметали.
Отже, фізичні властивості неметалів залежать від їх будови.
Хімічні властивості неметалів
Хімічні властивості простих речовин-неметалів зумовлені особливостями атомів елементів, що їх утворюють. Так, якщо елементи-неметали – окисники, то й прості речовини-неметали у багатьох реакціях виявляють окиснювальні властивості.
Неметалічні властивості речовин залежать значною мірою від енергії зв’язку між атомами у молекулі. Розглянемо значення енергій зв’язку (кДж/моль) у таких молекулах: хлору Сl2 – 243, кисню О2 – 494, азоту N2 – 945. Чим більше спільних електронних хмар, тим міцніше атоми зв’язані між собою (енергія зв’язку більша). Звідси найбільш активна речовина – хлор, а найменш активна – азот.
Більшість неметалів свою хімічну активність виявляють лише за певних умов.
Перед тим як розглядати хімічні властивості неметалів, зауважимо, що у природі існує така об’єктивна закономірність: між собою реагують речовини, протилежні за складом і властивостями.
Виходячи з цього, неважко усвідомити, що неметали реагують із металами, окисники – з відновниками (між собою можуть реагувати і два неметали), прості речовини-неметали зі складними, неметали як неорганічні речовини – з органічними. У всіх перелічених реакціях неметали будуть або окисниками, або відновниками – залежно від хімічної природи другого реагенту. Реакції між газоподібними неметалами – обернені. Більшість продуктів реакцій сполучення – ковалентні сполуки з більшою чи меншою часткою йонного зв’язку.
Деякі неметали відрізняються від усіх інших. Так, фтор – це єдиний із неметалів, який виявляє лише окиснювальні властивості. Неметали: бор, вуглець, силіцій та фосфор – відновлюють такі сильні окисники, як азотну та концентровану сірчану кислоти. У реакціях із кислотами кожний із неметалів окиснюється повністю, ступінь окиснення металу стає максимально позитивним.
У деяких неметалів, залежно від умов, відбувається одночасно збільшення та зменшення ступеня окиснення одного й того самого елемента. Наприклад, у реакції розчинення хлору у воді або розчині гідроксиду натрію атоми Хлору як віддають електрони (відновники), так і приєднують їх (окисники):
C12 + H2O → HC1 + HC1O;
Cl - le → Cl+1 (процес окиснення, Cl – відновник);
Cl + 1e → Cl-1 (процес відновлення, Cl – окисник).
Такі реакції належать до реакцій самоокиснення – самовідновлення, або диспропорціювання.
Отже, залежно від умов, неметали у хімічних реакціях можуть бути як окисниками (у більшості випадків), так i відновниками.
Електронна конфігурація атома Фосфору:

Електронна конфігурація атома Фосфору в збудженому стані:
Валентність Фосфору: III і V, ступінь окиснення у сполуках: –3, 0, +3, +5.
Фізичні властивості азоту. Безбарвний газ без смаку та запаху, трохи легший за повітря
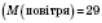 г/моль,
г/моль,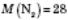 г/моль), погано розчинний у воді. Температура плавлення – 210 °С, кипіння – 196 °С.
г/моль), погано розчинний у воді. Температура плавлення – 210 °С, кипіння – 196 °С.
Алотропні модифікації Фосфору. Серед простих речовин, що утворює елемент Фосфор, найбільш поширені білий, червоний і чорний фосфор.
Поширення Нітрогену у природі. Нітроген у природі зустрічається головним чином у вигляді молекулярного азоту. У повітрі об’ємна частка азоту складає 78,1%, масова – 75,6%. Сполуки Нітрогену в невеликих кількостях містяться у ґрунті. У складі органічних сполук (білки, нуклеїнові кислоти, АТФ) Нітроген міститься у живих організмах.
Поширення Фосфору у природі. Фосфор зустрічається в хімічно зв’язаному стані у складі мінералів: фосфоритів, апатитів, основна складова яких є Ca3(PO4)2. Фосфор – життєво важливий елемент; входить до складу ліпідів, нуклеїнових кислот, АТФ, кальцій ортофосфату (у кістках і зубах).
Одержання азоту й фосфору.
Азот одержують у промисловості з рідкого повітря: оскільки азот має найнижчу температуру кипіння з усіх атмосферних газів, із рідкого повітря він випаровується першим. У лабораторії азот одержують у процесі термічного розкладання амоній нітриту:
 .
.
Фосфор одержують з апатитів чи фосфоритів під час прожарювання їх із коксом і піском при температурі 1500°C.
Хімічні властивості азоту.
1) Взаємодія з металами. Речовини, що утворюються в результаті цих реакцій, називаються нітридами.
Під дією кімнатної температури азот реагує тільки з літієм: 6Li + N2 → 2Li3N.
З іншими металами азот реагує під дією високої температури:
2Al + N2 → 2AlN – алюміній нітрид. 2) Взаємодія з неметалами.
Із воднем азот взаємодіє з участю каталізатора під дією високого тиску і температури:
N2 + 3H2 → 2NH3– амоніак.
Під дією дуже високої температури 3000°C азот реагує з киснем:
N2 + O2 →2NO– нітроген(ІІ) оксид.
Хімічні властивості фосфору. 1) Взаємодія з металами.
Під час нагрівання фосфор реагує з металами:
3Ca + 2P → t Ca3P2 - кальцій фосфід. 2) Взаємодія з неметалами.
Білий фосфор самозаймається, а червоний горить, якщо його підпалити:
4P + 5O2 → 2P2O5 -+ фосфор(V) оксид.
Якщо кисню недостатньо, утворюється фосфор(ІІІ) оксид (дуже отруйна речовина):
4P + 3O2 → 2P2O3
Взаємодія з галогенами:
2P + 2Cl2 → 2PCl3 – фосфор (ІІІ) хлорид
Взаємодія із сіркою:
2P + 3S → P2S3 - фосфор (ІІІ) сульфід
Хімічні властивості азоту і фосфору.
Фосфор уперше добули у вільному стані у вигляді схожої на віск маси, що світиться в темряві. Звідси й походить назва цього елемента («фосфор» у перекладі з грецької – «світлоносний»).
У вільному стані фосфор утворює кілька алотропних видозмін. Атом фосфору, як і атом азоту, може утворювати три ковалентних зв’язки. Але у молекулі азоту обидва атоми
витрачають всі три зв’язки на зв’язування одного з одним, а в усіх алотропних видозмінах фосфору атоми зв’язані попарно тільки одним зв’язком. Якщо один атом фосфору приєднує до себе таким чином три інших, то утворюється проста молекула з чотирьох атомів, кожний з яких зв’язаний ковалентним зв’язком з трьома іншими. Форма молекули – тетраедр.
З таких молекул складається білий фосфор. Його кристалічна ґратка молекулярна, складається з молекул, слабо зв’язаних міжмолекулярними силами. Тому білий фосфор, як і інші речовини з молекулярною ґраткою, легко плавиться та леткий. У воді він майже не розчиняється, але добре розчиняється у багатьох органічних розчинниках. Білий фосфор отруйний.
Від помірного нагрівання під дією дуже високого тиску (що перевищує більш як у 1200 раз атмосферний) білий фосфор переходить у чорний, який має атомну шарувату кристалічну ґратку. Чорний фосфор характеризується найменшою реакційною здатністю порівняно з іншими видозмінами фосфору.
Під дією світла чи від слабкого нагрівання без доступу повітря білий фосфор перетворюється на порошок червоно-бурого кольору (червоний фосфор). Червоний фосфор нелеткий і не розчиняється у воді та органічних розчинниках. Він не отруйний. Від сильного нагрівання без доступу повітря червоний фосфор знову перетворюється на білий фосфор. Це перетворення можна спостерігати, ледь потерши в темряві сірником об коробку, щоб він не запалився. На мить головка сірника залишить на коробці світлий слід – це світиться білий фосфор.
Фосфор відповідно до місця у періодичній таблиці більш електронегативний, ніж метали та водень, і менш електронегативний, ніж неметали, розміщені у періодичній таблиці далі справа та вище від нього. З металами фосфор сполучається, утворюючи фосфіди, наприклад фосфід магнію Mg3P2. У цій та аналогічній сполуках фосфор виявляє ступінь окиснення – 3.
Радіус атома фосфору більший за радіус атома азоту. Тому атом фосфору гірше утримує свої валентні електрони і слабше притягує електрони, яких йому не вистачає для завершення зовнішнього шару. Внаслідок цього кисневі сполуки фосфору міцніші від кисневих сполук азоту, а сполука з воднем навпаки, не така міцна, як сполука азоту – аміак.
Фосфороводень (фосфін) РН3 настільки неміцна сполука, що, на відміну від амоніаку, її не можна добути прямим сполученням фосфору з воднем. Леткі сполуки фосфору з воднем, що утворюються від гниття органічних решток, здатні самозайматись під дією повітря. Це є причиною рідкісного природного явища – «блукаючих вогнів», що породило марновірство про душі померлих, які виходять з могил.
Найхарактернішими для фосфору є сполуки, в яких він проявляє ступінь окислення +5. Взаємодіючи з киснем, фосфор горить сліпучим полум’ям і утворює твердий вищий оксид Р2О5 у вигляді білого диму:
0 0 |
+ 5 − 2 |
4 P+ 5O2 |
= 2P2 O5 . |
Червоний фосфор займається тільки від підпалювання. Білий фосфор окиснюється на повітрі вже при звичайній температурі, при цьому він світиться. Світіння білого фосфору під час повільного окиснення – приклад прямого перетворення частини енергії окиснення у світлове випромінювання.
Суміш червоного фосфору з бертолетовою сіллю КСl03 займається з вибухом навіть від
найменшого тертя або натискання:
0 + 5 |
+ 5 |
− 1 |
P+ K C l O3 |
→ P2 O5 + K C l . |
|
(Розставте коефіцієнти.)
Цю хімічну реакцію ви здійснюєте щоразу, коли запалюєте сірник. Бертолетова сіль у суміші, наприклад, із сіркою як пальним є в головці сірника, а червоний фосфор – на бічній стінці коробки, об яку чиркають сірником. Так, за допомогою червоного фосфору вдалося розв’язати проблему виготовлення безпечних і зручних у користуванні сірників.
Оксигеновмісні сполуки неметалічних елементів
Неметали утворюють два класи кисневмісних сполук − оксиди та гідроксиди.
Оксиди неметалів. В оксидах, як відомо, Оксиген має ступінь окиснення –2. Лише у сполуці ОF2 він дорівнює +2. Оксиген може мати ступінь окиснення –1, наприклад у молекулі пероксиду гідрогену Н2О2 (Н-О-О-Н). Сполуки, в яких Оксиген має ступінь окиснення –1, називаються пероксидами. Майже всі неметали утворюють кілька оксидів, бо елементи мають змінну валентність. Наприклад: оксиди карбону(II і IV) СО та СО2, оксиди нітрогену (І–V) N2О, NO, N2О3, NО2, N2О5, оксиди сульфуру (IV і VI) SО2 та SО3 тощо. Отже, за складом молекул оксиди неметалів поділяються на нормальні (СО2, NО2, SО2, Сl2О7) та пероксиди (Н2O2).
Зв’язок Е-О у молекулах оксидів – ковалентний, але залежно від природи елемента ступінь його полярності буде різним.
Оксиди неметалів – це кислотні оксиди, кислотний характер яких збільшується із збільшенням ступеня окиснення, про що свідчить також зростання теплового ефекту реакцій розчинення оксидів у воді. Наприклад:
P4O10 + 6H2O → 4H3PO4 + 59,8 кДж. SO3 + H2O → H2SO4 + 81,8 кДж. Cl2O7 + H2O → 2HClO4 + 330,9 кДж.
На цих реакціях засновано добування оксигеновмісних кислот. Розчинення оксидів у воді залежить від полярності їхніх молекул. Так, СО2, молекула якого неполярна, погано розчиняється у воді, утворюючи слабку вугільну кислоту:
CO2 + H2O → H2CO3 → H+ + HCO3- → 2H+ + CO32−.
Оксиди неметалічних елементів як кислотні оксиди реагують з основними оксидами, основами і деякими солями:
1).Ca + CO2 → CaCO3
2). CO2 + Ca(OH)2 → CaCO3 + H2O
3). CaCO3 + CO2 + H2O → Ca(HCO3)2
4).CaCO3 + SiO2 → t CaSiO3 + CO2 Більшість кислотних оксидів є солетворними.
Окисно-відновні властивості оксидів неметалів залежать від ступеня окиснення елемента і природи компонента в реакції. Так, NО під дією повітря окиснюється і є відновником:

На відміну від нітроген(ІІ) оксиду нітроген(ІV) оксид є сильним окисником: у ньому горять фосфор, сірка, вуглець і деякі органічні сполуки. Але нітроген (IV) оксид може бути й відновником:
2NO2 + H2O → HNO3 + HNO2.
Порівняно з нітрогеном (ІІ) оксидом NO для нітроген (IV) оксиду NO2 більш характерною є окиснювальна функція. Нарешті, оксид N2O5 – дуже сильний окисник (і лише окисник!). Органічні речовини в його середовищі загоряються.
Таким чином, для оксидів із низьким позитивним ступенем окиснення характерні відновні властивості; з високим, що відповідає номеру групи, – окиснювальні, а з проміжним – окиснювальні й відновні.
Оксигеновмісні кислоти. Ви неодноразово помічали, що один і той же елемент може утворювати кілька кислот, наприклад:
сульфітна H2SO3 і сульфатна H2SO4, нітритна HNO2 і нітратна HNO3. У цьому випадку головна причина полягає у ступені окиснення відповідного елемента. Крім того, різноманітність кислот залежить і від кількості молекул води, що можуть зв’язатись із молекулою відповідного оксиду. Так, у метакислотах на один моль оксиду припадає не більше одного моля води, а в ортокислотах – більше одного моля води.
Хімічні властивості кислот зумовлені їхньою здатністю дисоціювати у водних розчинах з утворенням іонів гідроксонію Н3О+. Сила оксигеновмісних кислот різна і характеризується константою дисоціації.
Сила оксигеновмісних кислот у групах р-елементів із збільшенням протонного числа елемента послаблюється, а у періодах посилюється від IV до VII групи.
Згідно з теорією електролітичної дисоціації, всі загальні характерні властивості кислот (кислий смак, зміна забарвлення індикатора, взаємодія з основами, основними оксидами, солями) зумовлені іонами гідроксонію.
Особливі властивості оксигеновмісних кислот стосуються їхньої окиснювальної здатності. У цих сполуках елемент перебуває у вищому ступені окиснення, тому такі

кислоти є сильними окисниками відносно як металів різної активності, так і неметалів та органічних речовин. Сказане повною мірою стосується нітратної кислоти будь-якої концентрації та концентрованої сульфатної кислоти. Розглянемо деякі приклади.
1.Взаємодія концентрованих нітратної та сульфатної кислот із металами різної активності:
2.Взаємодія розведених сірчаної та азотної кислот із металами різної активності:
Знаведених рівнянь реакцій виходить, що неметал у молекулі кислоти (Нітроген або Сульфур) знижує свій ступінь окиснення, тобто є окисником. Виняток становить дія розчину сульфатної кислоти на активні метали.
Вам відомо, що концентрована сульфатна кислота обвуглює органічні речовини – цукор, папір, деревину тощо, відбираючи від них елементи води. При цьому утворюються гідрати сульфатної кислоти. Обвуглювання цукру відбувається за таким рівнянням:
С12Н22О11 + nH2SO4 ® 12C + H2SO4×12H2O. Вугілля, що утворилось, частково вступає у взаємодію з кислотою:
C + 2H2SO4 ® CO2 + 2SO2 + 2H2O.
Кислоти з меншим ступенем окиснення неметалу можуть бути відновниками (нітритна кислота HNO2 – сильний відновник) і окисниками – залежно від властивостей речовинипартнера. Зіставимо нітритну й сульфітну кислоти:
Отже, оксигеновмісні сполуки у вищих ступенях окиснення неметалу – окисники, а у нижчих
– відновники й окисники (залежно від умов реакції).
Таким чином, оксигеновмісні кислоти неметалів мають як загальні характерні властивості, так і особливі.
Хімічні властивості фосфатної кислоти. Фосфатна кислота – активна речовина. Реагує з багатьма речовинами.
Тому що фосфатна кислота багатоосновна, її дисоціація протікає ступінчасто. Головним чином – у першій фазі, менше – у другій та лише незначною мірою – у третій. Тому у водяному розчині фосфатної кислоти поряд із молекулами H3PO4 є іони (у кількостях, що послідовно зменшуються ,) H2PO4ˉ, HPO4²ˉ и PO4³ˉ:
H3PO4 Н+ + H2PO4- (перша фаза);
H2PO4ˉ Н+ + HPO4²ˉ (друга фаза;
HPO4²ˉ Н+ + PO4³ˉ (третя фаза).
1. Взаємодія з металами:
6Na + 2H3PO4 = 2Na3PO4 + 3H2О.
2. Взаємодія з оксидами:
3CaO + 2H3PO4 = Ca3(PO4)2 ↓ + 3H2O.
3. Взаємодія з основами:
H3PO4 + 3KOH = K3PO4 + 3H2O;
3Н+ + PO4³ˉ+ 3K++3OHˉ = 3K+ + PO4³ˉ + 3H2O;
3Н++3OHˉ = 3H2O.
4. Взаємодія із солями:
2H3PO4 + 3Na2CO3 = 2Na3PO4 + 3CO2↑ + 3H2O.
5. Фосфатна кислота витискує більш сильну кислоту з розчину:
3Ca(NO3)2 + 2H3PO4 = Ca3(PO4)2↓ + 6HNO3;
Ca²+ + 6NO3ˉ + 2H3PO4 = Ca3(PO4)2↓ + 6Н+ + 6NO3ˉ;
Ca²+ + 2H3PO4 = Ca3(PO4)2↓+ 6Н+.
6. Специфічна властивість:
H3PO4 + 3AgNO3 = Ag3PO4↓ + 3HNO3;
3Н++ PO4³ˉ+ 3Ag++ 3NO3ˉ = Ag3PO4↓ + 3Н++ 3NO3ˉ;
PO4³ˉ+ 3Ag+ = Ag3PO4↓.
Характеристика Гідрогену
Електронна формула 1s1.
Положення Гідрогену у Періодичній системі неоднозначне. Раніше його розміщували у головній підгрупі І групи, на даний момент частіше розташовують на початку підгрупи
галогенів.
На користь розміщення Гідрогену на початку лужних металів свідчать такі аргументи:
1)Як і лужні метали, Гідроген виявляє у більшості сполук ступінь окиснення +1.
2)Подібно до лужних металів, він має яскраво виражені відновні властивості.
3)Для Гідрогену та металів, у тому числі й лужних, характерні реакції взаємного витіснення. Схожість Гідрогену з галогенами зумовлена наступним:
1)Як і атоми галогенів, Гідроген може приєднувати електрон з утворенням іону Гідрогену, який є ізоелектронним стосовно найближчого інертного газу Гелію.
2)Як і галогени, проста речовина – водень – газоподібна за звичайних умов; молекула водню складається із двох атомів.
3)Гідроген у сполуках заміщується галогенами. Численні приклади таких реакцій є в органічній хімії (галогенування насичених вуглеводнів).
4)Потенціал іонізації Гідрогену близький за значенням до потенціалів іонізації галогенів. Так І(Н)=13,6 еВ, а І(F)=17,4 еВ, однак I(Li)=5,6 еВ.
Оскільки Гідроген значно відрізняється за властивостями від лужних металів та галогенів, належність його до тієї чи іншої групи є умовною.
Поширення у природі
Водень є дуже поширеним у природі елементом. У земній корі, включаючи атмосферу, гідросферу й літосферу, його вміст становить 0,15% (мас.) або 3,0% за числом атомів (мольних часток у відсотках). Водночас він надзвичайно поширений у Всесвіті. Спектральним аналізом доведено, що у фотосфері Сонця міститься близько 84% водню. Він є головним компонентом поверхневих речовин великих планет Сонячної системи – Юпітера, Сатурна, Урана, а також білих і блакитних зір. Водень – це «космічне атомне паливо», джерело енергії Сонця та зір. За оцінками поширеності елементів у Всесвіті, його вміст перевищує 70% (мас.).
Увільному стані у природних умовах Землі водень майже не трапляється. Значна кількість (до 70%) водню міститься у вулканічних газах, порівняно невелика кількість водню утворюється під час розкладу органічних речовин, наприклад клітковини та білків, під дією деяких бактерій. Водень, маючи низьку хімічну активність, підіймається у високі шари атмосфери й може зовсім залишити нашу планету. Дуже розріджена атмосфера Землі на висотах понад 100 км складається переважно з водню, що перебуває здебільшого в атомарному стані й має в основному неземне походження. Під час досить частих вибухів на Сонці у космічний простір потрапляють колосальні маси водню та гелію, які з «космічним вітром» досягають нашої планети. Водень у ньому перебуває в атомарному стані й хімічно є дуже активним. Він повністю, ще у високих шарах атмосфери, реагує з киснем і потрапляє на Землю у вигляді води. Дослідженнями водних мас Землі доведено, що вони залишаються незмінними упродовж тривалої історії існування нашої планети.
В організмі людини міститься близько 60% води, тому зрозуміло, що вона є найціннішою речовиною і для людини, і для всього живого.
Увигляді води та органічних сполук в організмі людини масою 70 кг міститься близько 7 кг (3500 моль) водню.
Вода займає більшу частину поверхні земної кулі, перебуваючи на ній у трьох агрегатних станах: твердому (крига полюсів та високогірні сніги), рідкому (океани, моря,
ріки, озера тощо) і газоподібному (атмосферна волога, пара). Крім того, величезні маси води входять до складу мінералів та гірських порід.
Водень є також компонентом речовин органічного походження, рослинного і тваринного світу, газу, нафти, горючих копалин.
Проста речовина Добування. Сировинна база для добування водню практично невичерпна, тому обсяги його
одержання зумовлюються лише попитом та енергетичними можливостями. Розроблено кілька різних способів його добування у промисловості, причому відповідно до потреб використовують найдоцільніші та найдешевші з них. Переважна більшість способів добування водню ґрунтується на принципі його відновлення з хімічних сполук.
Залізопаровий спосіб був розроблений у 1783 р. французьким хіміком А. Лавуазьє та історично є першим способом добування водню. Він полягає у відновленні водню з водяної пари залізом під дією високої температури:
4H2O + 3Fe ¾¾t® Fe3O4 + 4H2.
Відновлення води вуглецем. При температурі понад 1000 °С водяна пара взаємодіє з розжареним коксом з утворенням водяного газу, який є сумішшю водню з карбон (ІІ) оксидом:
Н2О + С = СО + Н2.
Водень відокремлюють від домішок (СО2, N2, СО) охолодженням отриманої газової суміші скрапленим повітрям при температурі –200 °С. При цьому водень залишається у газоподібному стані, оскільки має значно нижчу температуру скраплення, а інші складові газової суміші переходять у рідкий стан.
За цим способом добувають дуже чистий водень, який використовують у харчовій промисловості для гідрогенізації жирів.
Найчастіше водяний газ разом з водяною парою при температурі 400 °С пропускають над каталізатором (оксид заліза чи кобальту), внаслідок чого оксид вуглецю(П) взаємодіє з водою і перетворюється на вуглекислий газ (так звана конверсія СО):
СО + Н2О(пара) = СО2 + Н2.
Вуглекислий газ легко відокремлюють від водню пропусканням газової суміші крізь воду під тиском, а залишки СО поглинають аміачним розчином хлориду міді(І).
Скраплення коксового газу. Коксовий газ утворюється під час високотемпературного процесу коксування кам’яного вугілля, яке разом із вуглецем містить значну кількість різноманітних вуглеводнів. При температурі коксування відбувається розклад (піроліз) вуглеводнів і утворюється величезна кількість вільного водню. Коксовий газ містить (за об’ємом): 55% водню, 25% метану, 2% етану, 4–6% карбон (ІІ) оксиду 2% вуглекислого газу і 10–12% азоту. Слід зазначити, що чим вища температура прожарювання вугілля, тим більше утворюється водню і менше залишається вуглеводнів.
Таким способом одержують величезні об’єми водню та використовують його для синтезу амоніаку.
Взаємодія метану з водяною парою. Для синтезу амоніаку і гідрування вугілля водень добувають також за реакцією високотемпературної (~1100 °С) взаємодії метану з водяною парою під дією сталого тиску:
СН4 + Н2О(пара) = СО + 3Н2; |
Н = 206,2 кДж. |
Ця реакція ендотермічна і потребує затрат теплоти. Водень одержують, застосовуючи «внутрішнє згоряння», для чого до суміші газів додають кисень, щоб частина метану згоріла до СО2:
СН4 + 2О2 = СО2 + 2Н2О(пара); = -802,2 кДж.
Врешті-решт співвідношення між компонентами реакційної суміші добирають таким, щоб процес був слабко екзотермічним:
12СН4 + 5Н2О(пара) + 5О2 = 29Н2− + 9СО + 3СО2, Н = -67,2 кДж.
Конверсією СО одержують додаткову кількість водню, а СО2 відокремлюють, пропускаючи суміш газів під тиском крізь воду.
Конверсія метану відбувається при температурі 800°С та за наявності нікелевого каталізатора. Конверсія карбон (ІІ) оксиду відбувається при температурі 550°С і наявності каталізатора, що містить активуючі домішки магнію чи хрому.
Електрохімічний розклад води. Вода має дуже низьку електропровідність, тому з метою зменшення енерговитрат у промисловості для проведення електролізу використовують лужні розчини. При цьому на електродах, які виготовляють із заліза або нікелю, відбуваються такі процеси:
Катод: |
2Н2О + 2е = Н2− + 2ОН-, |
Е° = -0,83 В; |
Анод: |
4 ОН- - 4е = О2− + 2Н2О |
Е° = 0,401 В. |
Процес електрохімічного розкладу води дуже енергомісткий. Теоретично для добування 1 м3 водню за нормальних умов потрібно затратити близько 2,8 кВт/год електроенергії. Насправді ж її затрати майже вдвічі більші внаслідок перенапруги на електродах та омного опору електроліту й діафрагми.
Водень, одержаний за цим способом, дуже чистий, тому його застосовують для гідрогенізації жирів, а також в інших процесах каталітичного гідрування. Таким чином у промисловості добувають близько 20% усієї кількості водню.
Інші способи добування водню з води мають лабораторне значення, оскільки їх використовують за умов, коли потрібні невеликі його об’єми.
Взаємодія деяких металів з розчинами кислот. Ці реак ції найпростіші для лабораторного добування водню, їх використовував ще Г. Кавендіш. Прикладом є взаємодія цинку з розчином хлоридної кислоти:
Zn + 2НС1 = ZnС12 + Н2.
Водень за цим способом добувають в апараті Кіппа: у його середню кулю завантажують гранульований цинк. Для очищення водень пропускають крізь підкислений розчин KMnO4 або K2Cr2O7, а для висушування – крізь концентровану H2SO4.
Взаємодія гідриду кальцію з водою належить до окисно-в ідновних реакцій диспропорціонування, оскільки відновником катіона Гідрогену виступає негативно заряджений гідрид-іон Н-:
СаН-12 + 2Н2О = Са(ОН+1)2 + 2Н02.
Для добування 1 м3 водню за цією реакцією потрібно всього 0,94 кг гідриду кальцію
СаН2.
Ще менше, всього 0,357 кг гідриду літію під час взаємодії з водою утворюють 1 м3 водню. З цієї причини його застосовують У рятувальних жилетах пілотів морської авіації.
Взаємодію лужних і лужноземельних металів із водою можна подати такими реакціями:
2Nа + 2Н2О → 2NаОН + Н2;
Са + 2Н2О → Са(ОН)2 + Н2.
Взаємодію алюмінію або кремнію з їдкими лугами описують такі рівняння: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2;
Si + 2NaOH + H2O → Na2SiO3 + 2H2.
Для добування 1 м3 водню за цими способами потрібно 0,81 кг алюмінію або 0,63 кг кремнію, тому останній спосіб економніший.
Фізичні властивості
Газоподібний водень складається з двохатомних молекул Н2. Він безбарвний і не має запаху. Утворення молекул водню з атомів супроводжується виділенням великої кількості теплоти:
2Н = Н2, Н = -432,1 кДж, що є свідченням великої енергії зв’язку Н—Н і значної стійкості цієї молекули.
Побудова моделі утворення молекули водню з атомів, яка була запропонована у 1927 р. німецькими фізиками В. Г. Гайтлером (1904–1989) і Ф. Лондоном (1900–1954), започаткувала сучасний етап квантово-механічного підходу до розуміння хімічного зв’язку. Атомізація молекулярного водню відбувається під час пропускання крізь нього електричного розряду.
Атомарний водень можна одержати і термічно – нагріванням водню розжареною електричним струмом платиновою ниткою або пропусканням струменя водню крізь зону вольтової дуги.
Оксиген – найпоширеніший елемент на Землі (вміст 58% (мол.) або 47,2 % (мас.)). Завдяки високій реакційній здатності він визначає форму існування на Землі всіх інших елементів Періодичної системи, утворюючи з ними безліч хімічних сполук. Його значення було особливо великим у період формування земної кори. Існує припущення, що наявність кисню в атмосфері зумовлена вторинними процесами – життєдіяльністю зелених рослин.
Наведені факти визначили провідну роль Оксигену в становленні й розвитку хімічної науки. Ще видатний шведський хімік Й. Я. Берцеліус (1779–1848) стверджував, що Оксиген – це та вісь, навколо якої обертається хімія. Слід згадати, що значною мірою на основі Оксигену та його найважливішої сполуки – води було засновано класифікацію неорганічних сполук, започатковано вивчення кислотно-основної взаємодії та окисно-відновних реакцій. До 1961 р. використовували кисневу шкалу атомних мас елементів. Оксиген відіграє важливу роль у процесах, пов’язаних із забезпеченням життєдіяльності тварин і рослин.
Поширення у природі
Оксиген входить до складу більшості природних неорганічних та органічних речовин. Відомо близько 1400 мінералів, які містять Оксиген. У зв’язаному стані на Землі він є у гідросфері (85,82% (мас.)) та літосфері (47%(мас.)). До важливих кисневмісних мінералів належать кварц та його модифікації (вміст кисню 53% (мас.)), алюмосилікати (польові шпати, слюди, глина – 56% (мас.)), вапняки тощо, а також речовини тваринного і рослинного походження (наприклад, в організмі людини міститься Оксиген з масою часткою до 65% ).
У вільному стані Оксиген є в атмосфері (23,1% (мас.) або 20,95% (об.)), що становить 1,5*1015 т. Зазначена кількість не перевищує 0,0001 загального вмісту Оксигену в земній
корі. Оксиген повітря витрачається на процеси горіння, дихання, гниття, іржавіння й водночас він безперервно регенерується завдяки фотосинтезу:
nСO2 + mН2O ¾ ¾hν ® Сn(Н2O)m + nO2−.
Для задоволення потреб живих істот у кисні важливим є лише його парціальний тиск. Хоча вміст кисню в повітрі у відсотках залишається без змін, його парціальний тиск на значних висотах стає недостатнім внаслідок розрідженості атмосфери. Саме тому під час сходження на гірські вершини або висотних польотів організм людини зазнає кисневого голодування. Заслуга з’ясування причин шкідливого впливу розрідженого повітря на кисневий обмін в організмі людини належить видатному російському фізіологу І. М. Сєченову.
Проста речовина Добування Основним промисловим методом добування кисню є виділення його з повітря за
допомогою скраплення останнього та фракційної дистиляції. Оскільки кисень є газом, для переведення у рідкий стан його необхідно спочатку охолодити до температури, нижчої за критичну (яка досить низька – -118 °С), а потім піддати дії високого тиску.
Кисень має вищу температуру кипіння (-183 °С) порівняно з азотом (-196 °С), тому під час дистиляції азот випаровується і збирається для використання, а кисень залишається в рідкому стані в нижній частині ректифікаційної колони. Такий кисень містить незначні домішки азоту, вуглекислого газу та близько 3% аргону, який має близьку до кисню температуру кипіння (-186 °С).
Кисень високого ступеня чистоти добувають електролізом води. Цей метод використовують переважно для добування водню (катодний процес), але одночасно на аноді одержують другий корисний продукт – кисень.
Кисень зберігають і транспортують під тиском 15 МПа у сталевих балонах, пофарбованих у блакитний колір, з чорним написом «Кисень». Велику кількість кисню зберігають у скрапленому стані. Для цього використовують спеціальні ємкості (так звані танки), які мають ефективну теплоізоляцію.
Лабораторні методи добування кисню ґрунтуються на розкладі багатих на нього, але відносно нестійких хімічних сполук. Наприклад, кисень можна одержати під час термічного розкладу перманганату калію КМnО4, хлорату калію КСlO3 (з участю каталізатора, наприклад МnO2, Fe2О3, Сr2О3), нітратів, оксидів металів тощо:
2KC1O3 → 2KC1 + 3O2; 2KMnO4 →K2MnO4 + MnO2 + O2;
2KNO3 → 2KNO2 + O2;
2HgO → 2Hg + O2.
Зручним способом лабораторного добування кисню є розклад гідроген пероксиду з участю каталізатора МnО2:
2Н2О2 = 2Н2О + О2.
Фізичні властивості. Вільний кисень складається з двохатомних молекул O2. Внаслідок ковалентної природи зв’язку кисень є типовим газом з низькими температурами кипіння (- 183 °С) і плавлення (-218,7 °С). Газоподібний кисень безбарвний, не має запаху та смаку, у рідкому і твердому станах має блідо-синє забарвлення.
У 100 об’ємах води при температурі 0 °С розчиняється близько 5 об’ємів кисню, при 20 °С – близько 3 об’ємів (або 0,004% (мас.)).
Води гідросфери вміщують 1,5*1013 т розчиненого кисню. Він легко розчиняється в органічних розчинниках, тому простого переливання таких рідин на повітрі достатньо для насичення їх киснем. Кисень здатний також розчинятись у деяких розплавлених металах (сріблі, платині, золоті, паладії). Так, один об’єм срібла вбирає близько 10 об’ємів кисню.
Низькі температури кипіння та плавлення кисню пояснюють тим, що молекула О2 неполярна і має малу здатність до поляризації. Це зумовлює існування в конденсованих станах речовини лише слабких сил дисперсійної міжмолекулярної взаємодії, які легко долаються вже під дією відносно низьких температур. Саме тому неполярні та малополяризовані молекули кисню мають низьку розчинність у поляризованій воді.
Довжина хімічного зв’язку у молекулі О2 становить 120,7 пм, що істотно менше за довжину одинарного ковалентного зв’язку О–О. Наприклад, у молекулі Н–О–О–Н вона становить 149 пм. Згідно з цим енергія зв’язку у молекулі O2 велика і становить 494 кДж/моль, що значно перевищує енергію одинарного зв’язку О–О (у молекулі Н–О–О–Н вона становить 210 кДж/моль). Цим пояснюють той факт, що гемолітична
дисоціація молекул кисню на атоми розпочинається лише при температурі понад 1500 °С. Вона може відбуватися також у разі вбирання ультрафіолетового випромінювання
(фотоліз). Тому коло земної поверхні кисень в атмосфері перебуває у молекулярному стані О2, а вище за 100 км основною формою існування кисню стає атомарний. Молекули О2 розщеплюються тут на атоми під впливом ультрафіолетового випромінювання Сонця.
Молекула кисню парамагнітна, наявність парамагнетизму відповідає розміщенню на молекулярній орбіталі двох неспарених електронів. Внаслідок парамагнетизму рідкий і твердий кисень притягується магнітним полем.
Утворення хімічних зв’язків у молекулі О2 та деякі її властивості пояснює метод молекулярних орбіталей. Так, мала довжина зв’язку між атомами О–О та висока його енергія зумовлені тим, що кратність зв’язку у молекулі кисню О2 дорівнює 2.
Парамагнітні властивості молекули О2 спричинені наявністю двох неспарених електронів, які, за правилом Хунда, займають дві окремі вироджені розпушувальні молекулярні орбіталі. Атом кисню порівняно з молекулою має більшу енергію іонізації (відповідно 1313 і 1165 кДж/моль), оскільки у разі іонізації молекули О2 електрон відщеплюється з енергетично вищої (ніж атомні) розпушувальної молекулярної орбіталі. Утворення молекулярних іонів О2+, О2- та О22- можливе тому, що число зв’язувальних електронів перевищує число розпушувальних (кратність зв’язку більша за нуль).
На Землі виявлено три стабільні нукліди кисню: 168 О (99,759% (мас.)), 178 О (0,037% (мас.)) та 188 О (0,204% (мас.)). Штучно одержано три радіоактивні нукліди кисню, період піврозпаду яких не перевищує десятків секунд.
Кисень має алотропну модифікацію – озон О3.
Хімічні властивості. Кисень характеризується високою хімічною активністю і належить до типових окисників. Він реагує з більшістю простих речовин, найчастіше утворюючи оксиди, в яких має ступінь окиснення -2. Такі реакції зазвичай відбуваються з досить великою швидкістю лише під дією підвищеної температури, оскільки потребують активації молекул О2:

Великі від’ємні значення стандартної енергії Гіббса утворення багатьох оксидів свідчать про значну спорідненість цих елементів до кисню.
Кисень безпосередньо не окиснює лише благородні гази, деякі метали (золото, платину) та галогени. Для таких систем зміна енергії Гіббса має додатне значення, наприклад
G°(Au2О3(т)) = 79 кДж/моль, G°(ClO2(г.))=122 кДж/моль.
Проте оксиди цих елементів, за винятком гелію, неону та аргону, можна одержати непрямим шляхом, наприклад:
Оксиди можуть утворюватись не лише під час окиснення киснем простих речовин. Багато складних речовин за певних умов також взаємодіє з киснем. При цьому утворюються оксиди елементів, а іноді й оксиди, і прості речовини, наприклад:
Здебільшого реакції окиснення відбуваються з достатньою швидкістю лише під дією підвищеної температури, оскільки потрібна деяка енергія для активації молекул O2.
Якщо окиснення речовин відбувається енергійно, з виділенням великої кількості теплоти і світла, то такі процеси називають горінням. Вони відбуваються, як правило, за умови надлишку повітря або чистого кисню та завершуються утворенням кінцевих продуктів окиснення (СО2, Н2О, SО2, Р2О5, N2 тощо). Наприклад, під час горіння ацетилену в середовищі кисню температура полум’я досягає 3200 °С.
Відносно повільні реакції окиснення залежно від характеру речовини називають іржавінням (окиснення металів), тлінням (окиснення органічних решток), а найчастіше – просто окисненням.
Майже 90% кисню, що потрапляє в організм людини, використовується під час дихання як акцептор електронів. Енергію, що виділяється в разі окиснення різних субстратів молекулярним киснем, організм використовує для синтезу життєво необхідного аденозинтрифосфату (АТФ). М’яке окиснення молекулярним киснем різних субстратів у живих організмах є основним джерелом енергії для забезпечення перебігу процесів
життєдіяльності.
Про значну окиснювальну здатність кисню у водних розчинах свідчить високе значення стандартного електродного потенціалу його відновлення до води:
О2 + 4Н+ + 4е- = 2Н2О, Е° = 1,23 В (при рН = 0).
Для добування металів та деяких неметалів пірометалургійними способами широко використовують процес окиснювального випалювання природних сульфідних мінералів з метою їх переведення у відповідні оксиди (далі оксиди відновлюють до простих речовин), наприклад:
Класифікацію основних типів неорганічних сполук кисню за ступенями його окиснення подано у наведеній нижче схемі.
Оксиди. Загальні методи добування оксидів вам відомі з курсу хімії середньої школи. Взагалі утворення одноатомних багатозарядних аніонів типу Еn- енергетично невигідне. З цієї причини не існує сполук, до складу яких входять вільні іони О2-. Навіть у кристалічних оксидах найактивніших металів (Na2О, СаО тощо) ефективний негативний заряд атома кисню істотно менший за -2.
В оксидах неметалів різниця між електронегативностю атомів кисню і неметалу невелика, тому хімічний зв’язок у них ковалентний полярний. Більшість таких сполук за звичайних умов – гази, леткі рідини або легкоплавкі тверді речовини. Це пояснюється тим, що вони у твердому стані утворюють, як правило, молекулярні кристалічні ґратки зі слабкими силами міжмолекулярної взаємодії. Навпаки, оксиди з полімерними структурами значно міцніші й більш тугоплавкі. До таких речовин належить, наприклад, SiO2. Він має полімерну структуру, в якій кожен атом силіцію сполучений з чотирма атомами кисню (відбувається sр3-гібридизація валентних орбіталей атомів силіцію) та утворює тетраедр, а кожен атом Оксигену, у свою чергу, сполучений з двома атомами силіцію. Внаслідок цього полімерний SіО2 (на відміну від мономерного СО2) за звичайних умов хімічно неактивний і має високу
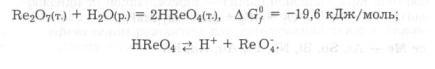
температуру плавлення (1700 °С). В оксидах неметалів валентні орбіталі атомів кисню найчастіше перебувають у стані sр3-гібридизації.
Оксиди неметалів за хімічною природою кислотні. Більшість із них розчиняються у воді з утворенням відповідних кислот, тому їх називають ангідридами кислот:
СO2 + Н2O ↔ Н2СO3;
SО3 + Н2О ↔ Н2SО4.
Оксиди найактивніших металів мають переважно іонний зв’язок і за хімічною природою основні. До найтиповіших з них належать оксиди лужних та лужноземельних металів, їм відповідають гідроксиди, які є сильними основами.
У міру зростання ступеня окиснення металу збільшується частка ковалентності в його хімічному зв’язку з киснем. Такі оксиди з іонно-ковалентним зв’язком амфотерні, їм відповідають амфотерні гідроксиди, здатні дисоціювати за типом слабких основ за місцем зв’язку Ме–ОН і за типом слабких кислот – за місцем зв’язку МеО–Н. До таких оксидів належать переважно оксиди металів, які мають відносно невелику електронегативність, наприклад А12О3, Сr2О3, РbО, ZпО, Fе2О3 тощо. Залежно від умов вони виявляють властивості основних або кислотних оксидів. Амфотерні оксиди з водою не взаємодіють (не розчиняються), але можуть реагувати як з кислотами, так і з лугами, а під час нагрівання – з основними та кислотними оксидами з утворенням солей.
Оксиди металів (d-елементів) з високими ступенями окиснення мають ковалентний характер зв’язків між атомами у молекулах (СrО3, Мn2О7, Rе2О7, ОsО4 тощо). Частина з них розчиняється у воді з утворенням гідратів, які дисоціюють за типом кислот за місцем найбільш полярного зв’язку Н–О:
Перелічені оксиди мають кислотну природу і також належать до ангідридів кислот. Перехідні елементи здатні утворювати не стехіометричні оксиди, їхні кристалічні ґратки складаються зі щільно упакованих іонів оксиду, а частина пустот такої структури заповнена іонами металу, наприклад FеО1-x (х=0,05-0,10). Існують також не cтехіометричні оксиди, у кристалічних ґратках яких пустоти наповнені надлишковим, тобто надстехіометричним киснем, наприклад U2+Х (х = 0,00–0,30).
На початкових стадіях реакцій металів із киснем можуть утворюватися субоксиди – сполуки з металічним зв’язком. Вони є продуктом укорінення атомів Оксигену в кристалічні ґратки металів, наприклад: Ті6О, Ті3О.
Похідні молекулярних іонів кисню
У процесі хімічних перетворень молекула О2 може віддавати або приєднувати електрони й утворювати молекулярні іони О2+, О2- або О22-. Оскільки в них сполучені між собою два атоми кисню, то їх називають сполуками пероксидного типу. Деякі характеристики цих
сполук наведено нижче. Віддаючи один електрон з πр2р-молекулярної орбіталі, молекула кисню перетворюється на іон О2+, який називають діоксогеніл-іоном. Реалізація процесу О2 = О2+ + е- потребує значних витрат енергії (І =1165 кДж/моль у розрахунку на одну молекулу), тому можлива лише за умови застосування дуже сильних окисників, зокрема фториду платини (VІ) РtF6. Внаслідок перебігу цієї реакції утворюється гексафтороплатинат

(VI) діоксогенілу О2[РtFe6]. Синтез діоксогенілових солей можна реалізувати нагріванням при температурі 150–-500 °С суміші кисню, фтору та порошку відповідного елемента:
Похідні іона О2+ парамагнітні, що зумовлено наявністю одного неспареного електрона на його pр2р-молекулярній орбіталі. Як видно з наведених вище даних, між’ядерна відстань у катіоні О2+ менша, а кратність зв’язку більша, ніж у молекулі О2.
Приєднуючи один електрон на pр2р-молекулярну орбіталь, кисень утворює молекулярний іон О2-, який називають надпероксид-іоном, а його сполуки надпероксидами. Процес О2 + 1е- = О2-, супроводжується виділенням енергії (48,1 кДж/моль у розрахунку на одну
молекулу) і зумовлює зменшення кратності зв’язку до 1,5 (на розпушувальних pр2рмолекулярних орбіталях до двох неспарених електронів молекули О2 додається третій електрон). Як зазначалося вище, надпероксиди можна добути безпосередньо з простих речовин для найактивніших відновників – лужних металів підгрупи калію (К, Rb, Cs). Такі сполуки мають парамагнітні властивості, що, згідно з методом молекулярних орбіталей,
зумовлено наявністю одного неспареного електрона на pр2р-молекулярній орбіталі кисню. Молекула О2 може приєднувати два електрони з утворенням пероксид-іона О22-, похідні якого називають пероксидами. Цей процес потребує витрати енергії (160 кДж/моль).
Додаткові електрони розміщуються на pр2р-молекулярній орбіталі. При цьому кратність зв’ язку знижується до 1, тому порівняно з надпероксид-іоном O2- (кратність зв’язку 1,5) й особливо з молекулою кисню О2 (кратність зв’язку 2) енергія дисоціації пероксид-іонів істотно менша, а відстань між атомами кисню більша. У молекулах пероксидів атоми кисню сполучені між собою простим двохелектронним s-зв’язком (О–О)2-. Відсутність неспарених електронів визначає діамагнетизм пероксидів. Вони утворюються під час окиснення киснем деяких активних металів, наприклад:
2Nа + О2 = Nа2О2.
Пероксиди та надпероксиди – сильні окисники. Під час контакту з ними багато органічних речовин займаються. Пероксид натрію Nа2О2 є ефективним реагентом для вибілювання тканин, бавовни, шовку, паперу тощо.
Вода. Найпоширенішою у природі та найважливішою для людини сполукою водню є вода. Нашу планету без перебільшення можна назвати планетою води. Вода вкриває 3/4 поверхні земної кулі. Загальна кількість води на Землі становить близько 1500 млн км3 (1,45×1018 м3), або 1/4500 маси земної кулі. З води зародилося життя на Землі, вода його розвиває і підтримує.
Водні ресурси земної кулі складаються з води морів та океанів; води полярних льодовиків – прісної, але недоступної для використання; води річок та озер – прісної та доступної для використання; підземної води, яка залягає до глибини 800 м та 1600 м – прісної або мінералізованої.
Вода є надзвичайно важливою технологічною речовиною. Жодне виробництво не обходиться без використання величезних мас води. Наприклад, для добування 1 т заліза використовують 300 т води. Загальні витрати чистої води в Україні становлять близько 0,01
км3 щодоби. Це стільки, скільки її є приблизно в двох кілометрах течії Дніпра. Найкращою для споживання людиною є вода глибоких артезіанських свердловин. Вона чиста, достатньо мінералізована і містить переважно потрібні людині розчинені солі.
Прийнятною є очищена вода річок. Очищення річкової води – це складний технологічний процес, який включає фільтрування та обробку спеціальними речовинами (хлором, озоном) для знешкодження шкідливих бактерій, що містяться в ній. Іноді воду додатково опромінюють ультрафіолетовим світлом. Для вилучення розчинених солей воду переганяють або дистилюють.
Як з фізичного, так і з хімічного поглядів вода є однією з найскладніших речовин, яку до того ж дуже важко виділити у чистому вигляді.
Фізичні властивості води. Чиста вода – прозора, рухома, безбарвна за звичайних умов рідина, яка не має ні запаху, ні смаку. Вона складається з кутових молекул Н2О, кут між двома зв’язками Н–О, становить 104,5°. Молекули води полярні (диполі). У конденсованому стані (рідкому або твердому) вода значною мірою асоційована, кожна її молекула утворює із сусідніми по два міжмолекулярні водневі зв’язки, тому у просторі кожен атом кисню оточений чотирма найближчими атомами водню – двома «своїми», з коротшими зв’язками, і двома «чужими», з довшими зв’язками. Водневі зв’язки між молекулами води набагато міцніші порівняно з іншими подібними речовинами. Навіть у «холодній» парі вода перебуває у досить асоційованому стані. В органічних розчинниках її молекули димеризовані (Н2О)2.
Будова рідкої води остаточно ще не з’ясована. Рентгеноструктурними дослідженнями доведено, що молекули води у рідині розміщені так, що між ними утворюються порожнини
– не зайняті молекулами канали мікроскопічних розмірів. Внаслідок теплового руху ці фрагменти весь час розпадаються, перегруповуються й утворюються знову. Окремі молекули, які в даний момент не беруть участі в утворенні водневих зв’язків, потрапляють до цих каналів і набувають більшої рухливості, ніж інші. Це свідчить про те, що в рідкій воді не всі молекули відіграють однакову роль: одні – потрапляють до порожнин, інші – займають місця у «стінках» порожнин. Внаслідок цього вода набуває різних аномальних властивостей. Під час охолодження води розміри асоціатів збільшуються, але водночас порожнини заповнюються, оскільки уповільнюється рух молекул, зростає густина води. При температурі 4 °С (точніше, 3,98 °С) вода має найбільшу густину, яка умовно прийнята за одиницю густини 1 г/см3. У
разі охолодження води до температури 0°С утворюються восьмимолекулярні асоціати. Такі агрегати з 8 молекул уже мають виражену «кригову» структуру. Порожнини вивільнюються, об’єм рідини збільшується. В упорядкованій кристалічній структурі льоду кожна молекула води тетраедрично оточена чотирма іншими сусідніми молекулами. У результаті утворюється ажурна гексагональна кристалічна ґратка, в якій є порівняно великі порожнини діаметром 520–690 пм. Здатність води розширюватись під час кристалізації треба завжди брати до уваги у практичній діяльності, оскільки при цьому створюються значні тиски, і ємкості, в яких вона перебуває, можуть легко зруйнуватись. За рахунок цього вода, зокрема, руйнує камінь, шляхове покриття.
Отже, розширення води під час замерзання пов’язане з тим, що в разі нерегулярного розміщення у просторі молекули у рідкій воді займають менший об’єм порівняно з цілком
регулярною орієнтацією в разі утворення кристалічної структури. Наслідком збільшення об’єму води під час кристалізації, згідно з принципом Ле Шательє, є зниження температури кристалізації при підвищенні зовнішнього тиску.
Вода має величезну теплоємність. Теплоємність речовини визначають за зміною температури речовини в разі поглинання нею певної кількості теплоти. Якщо до кількох різних речовин підвести однакову кількість теплоти, то більше нагріється та з них, яка має меншу теплоємність. Теплоємність речовини у розрахунку на одиницю її маси називають питомою теплоємністю. Якщо останню виразити як відношення теплоємності речовини до теплоємності еквівалентної маси води за температури 15 °С, то дістанемо безрозмірне значення відносної теплоємності.
Кількістю теплоти, що виділяється під час охолодження 1 м3 води на 1 °С, можна нагріти 1000 м3 повітря на 3°С. Цей процес відбувається у природі, коли настає холодна пора. Нагріта влітку вода океанів і морів, поступово охолоджуючись, нагріває величезні об’єми повітря і перешкоджає різкому зниженню температури. За відсутності у води цієї властивості клімат Землі був би вкрай несприятливим для життя людини.
Вода має надзвичайно високу приховану теплоту плавлення. Щоб розтопити 1 кг льоду необхідно затратити 332,4 кДж енергії (це вдвічі більше за приховану теплоту плавлення сталі й у 15 разів більше за приховану теплоту плавлення свинцю). Завдяки цьому щедре весняне тепло повільно зігріває землю, не спричиняє катастрофічних повеней.
Нарешті, вода характеризується надзвичайно високою теплотою випаровування (кількість теплоти, необхідна для повного випаровування 1 г речовини). Щоб випарувати 1 л води, потрібно затратити понад 2000 кДж енергії. Величезне значення теплоти випаровування води зумовлює її високу температуру кипіння, оскільки лише при температурі 100 °С пружність водяної пари досягає атмосферного тиску, і вода починає кипіти.
Завдяки високим значенням теплоємності води, прихованої теплоти плавлення льоду та дуже високому значенню теплоти випаровування, які пов’язані з великими витратами теплоти на руйнування асоційованої структури води, вона є регулятором клімату на Землі. Найбільш помірний клімат спостерігається поблизу великих водних басейнів – на берегах морів та океанів.
Влітку моря послаблюють спеку, бо вода повільно нагрівається. Багато теплоти витрачається на випаровування води. Краплі дощу, пронизуючи повітря, вбирають його теплоту й охолоджують атмосферу. Багато теплоти вбирається під час танення вічних снігів і льодовиків.
Взимку, навпаки, атмосфера нагрівається за рахунок замерзання великих мас води, а коли кристалізація води відбувається у повітряному просторі, йде сніг.
Вода є прекрасним розчинником багатьох неорганічних та органічних речовин. При цьому розчинність газів, рідин і твердих речовин великою мірою залежить від їхньої природи. Майже всі гази, що складаються з полярних молекул, добре розчиняються у воді. Розчинність газів зростає зі збільшенням їх тиску та зниженням температури. Неполярні гази у воді розчиняються погано, але розчинність кисню, молекули якого парамагнітні, вища, ніж розчинність азоту, хоча парціальний тиск атмосферного азоту вчетверо вищий, ніж кисню. Справді, розчинність кисню в 1 об’ємі води при температурі 0 °С становить 0,0491 об’єму, а за 20 °С – 0,0311 об’єму, тоді як розчинність азоту в 1 об’ємі води при 0 °С

досягає лише 0,0236 об’єму. Розчинений у воді кисень відіграє вирішальну роль у житті всіх гідробіонтів (організмів, які живуть у воді).
Розчинність у воді рідин в основному залежить від характеру молекул, з яких вони складаються. Полярні рідини зазвичай добре розчиняються у воді.
З неорганічних солей добре розчиняються у воді нітрати, переважна більшість хлоридів і сульфатів, тому у природній прісній воді завжди є аніони Сl-, SО42-, НСО3- та катіони Nа+, Са2+, М2+, Fе2+. У морській воді найбільше міститься хлориду натрію, а в аналітичних кількостях містяться ще близько 60 хімічних елементів. Деякі вчені вважають, що у морській воді присутні всі стійкі елементи. Вода є ідеальним середовищем (розчинником) для перебігу різноманітних хімічних реакцій. Часто вона виявляє каталітичну дію.
Хімічні властивості води. Відносно нагрівання вода є досить стійкою сполукою. Вона практично не розкладається під час нагрівання до температури 1200 °С, і тільки під дією вищих температур термічно дисоціює на атом Н і групу –ОН. При температурі 5000 °С вода розкладається з вибухом.
Відносно різноманітних хімічних сполук вода поводить себе як досить активний реагент. Вона може реагувати з речовинами як неорганічного, так і органічного походження. Під час взаємодії з ними вона може руйнуватись або залишатись незмінною.
Найхарактернішими для води є хімічні реакції, наведені нижче.
1.Приєднання основних та кислотних оксидів з утворенням основ і кислот:
2.Приєднання до основ, кислот і солей з утворенням кристалогідратів: КОН×Н2О,
Н2SО4×2Н2О, Nа2SО4×10Н2О.
3.Окиснення за рахунок водню в ступені окиснення +1 сильних відновників за звичайних умов або під дією високої температури:
4.Відновлення за рахунок кисню в ступені окиснення -2. Наприклад, водяна пара горить у середовищі фтору:
F2 + Н2О = 2НF + О.
5.Участь у донорсько-акцепторних взаємодіях. За рахунок донорських властивостей атома
Оксигену, який має дві неподілені пари електронів, вода часто відіграє роль ліганда в реакціях комплексоутворення. Вона може бути і донором протона, тому в кислотноосновних перетвореннях відіграє роль амфоліту:
Н+ + Н2О « Н3О+.
Згідно з протонною теорією кислот і основ Й. Н. Бренстеда (1879–1947) у цій реакції вода є основою. Відносно електролітів, здатних приєднувати протон, вода поводить себе як кислота, наприклад:
NН3 + Н2О ↔ NH4+ + ОН-.
Вона утворює велику кількість аквакомплексів: Сu2++4Н2О=[Сu(Н2О)4]2+;
Сr3+ + 6Н2О = [Сr(Н2О)6]3+.
Вода може не лише створювати середовище, а й бути безпосереднім учасником окисновідновних реакцій:
С12 + Н2О ↔ НС1 + НОСl;
2КМnО4 + 3К2SО3 + Н2О = 2МnО2 + 3К2SО4 + 2КОН.
Чиста вода є дуже слабким електролітом і майже не проводить електричний струм. Іонний добуток води при температурі 22 °С відповідає стану рівноваги:
Н2О ↔ Н+ + ОН- і дорівнює Кв = [Н+][ОН-] = 10-14.
У водних розчинах зазначену рівновагу дисоціації можна змінювати у той чи інший бік не лише розчиненням у воді кислот і лугів, а й солей слабких кислот або основ (гідроліз солей): Fе3+ + Н2О ↔ FеОН2+ + H+;
РО43- + Н2О ↔ HРО42-+ ОН-.
Внаслідок цих реакцій змінюється концентрація протонів або гідроксил-іонів. Відомо багато сполук, які повністю розкладаються водою, наприклад:
Аl2S3 + 6Н2О = 2А1(ОН)3 + 3Н2S; РС13 + 3Н2О = Н3РО3 + 3НС1.
Важка вода. Сполуку D2О (оксид дейтерію) називають важкою водою. Вперше її одержали у 1933 р. американські хіміки Г. Н. Льюїс (1875–1946) та Ф. Г. Спеддінг (1902–1989) електролізом лужного розчину. Вміст її у морській воді становить близько 0,018%, тому для добування 1 кг важкої води необхідно розкласти 170 т звичайної води. Одержують D2О електролізом звичайної води (іони дейтерію розряджаються повільніше, ніж іони протію), фракційною дистиляцією рідкого водню та іншими методами. Температура її плавлення становить 3,8 °С, густина – 1,104 г/см3, температура кипіння – 101,43 °С, іонний добуток – 0,2*1014. Біологічні процеси у важкій воді відбуваються дещо повільніше, ніж у звичайній.
Виробляють важку воду у великих кількостях, її широко використовують в атомній енергетиці. В ядерних реакторах її застосовують для уповільнення нейтронів.
Гідроген пероксид. Пероксид водню є однією з найважливіших сполук кисню. У промисловості його добувають електрохімічними та хімічними способами. Для електрохімічного добування Н2О2 використовують розчини сірчаної кислоти або її солей (зокрема, (NН4)2SО4). У цьому разі електролізу піддають 50%-й розчин Н2SО4 при високій густині струму та охолодженні. За таких умов на платиновому аноді окиснюються гідросульфат-іони до пероксодисірчаної кислоти Н2S2О8:
2НSО4- = Н2S2О8 + 2е.
Слабке нагрівання розчину Н2S2О8 сприяє перебігу процесу гідролізу, внаслідок чого утворюється Н2О2:
Н2S2О8 + 2Н2О = Н2О2 + 2Н2SО4.
Хімічні методи добування Н2О2 ґрунтуються на окисненні киснем органічних сполук, наприклад таких, як алкільні похідні антрагідрохінону та ізопропіловий спирт.
Пероксид водню легко утворюється з пероксиду барію під дією на нього розбавленого
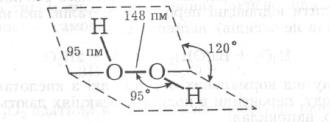
розчину сірчаної кислоти:
ВаО2 + Н2SО4 = Н2О2 + ВаSО4.
Осад нерозчинного у воді ВаSО4 повністю відокремлюється від розчину Н2О2 звичайним фільтруванням.
У промисловості добувають пероксид водню концентрацією, яка не перевищує 60%, оскільки більш концентровані його розчини вибухонебезпечні під час транспортування. 30%-й стабілізований розчин Н2О2 називають пергідролем. У медицині застосовують 3%-й розчин Н2О2. Щорічне світове виробництво пероксиду водню становить 0,5 млн тонн.
Пероксид водню високого ступеня чистоти та його розчини за звичайних умов досить стійкі та можуть зберігатись протягом тривалого часу, але під час нагрівання, в разі ультрафіолетового опромінення, а також за наявності іонів перехідних металів Н2О2 інтенсивно розкладається з виділенням кисню. Чистий Н2О2 та його концентровані розчини розкладаються бурхливо, часом з вибухом.
Для запобігання розщепленню Н2О2 до його розчину додають стабілізатори (зазвичай фосфати натрію), які зв’язують шкідливі іони металів і тим самим гальмують небажаний процес, їх зберігають у прохолодному місці у темних посудинах. При цьому слід мати на увазі, що луги, навіть у кількостях, що вилуговуються зі звичайного скла, істотно прискорюють розщеплення молекули Н2О2.
Молекула Н2О2 нелінійна, два зв’язки О–Н розміщені у двох площинах під кутом 120°.
Внаслідок несиметричного розміщення зв’язків О–Н молекула Н2О2 дуже полярна. Наявність неподілених електронних пар у атомів Оксигену створює можливість донорськоакцепторної взаємодії. Так, подібно до води, пероксид водню може входити до складу кристалічних речовин, наприклад Ка2СО3×1,5Н2О2×Н2О.
Рідкий і твердий пероксиди водню, а також його розчини у воді характеризуються наявністю стійких водневих зв’язків, які спричиняють асоціацію молекул. Тому за звичайних умов чистий пероксид водню – олієподібна в’язка блідо-блакитна рідина без запаху, яка майже у 1,5 рази важча за воду. Тиск пари Н2О2 нижчий за тиск пари води (за однакової температури), тому температура кипіння пероксиду водню вища і становить 150,2 °С. На цій властивості ґрунтується відокремлення Н2О2 від води шляхом фракційної перегонки. Слід також зазначити, що температуру кипіння Н2О2 при атмосферному тиску безпосередньо визначити неможливо, оскільки вже під дією температури 90 °С він починає розкладатись. Твердий Н2О2 має температуру плавлення -0,43 °С, його густина становить 1,71 г/см3.
Пероксид водню змішується з водою у будь-яких співвідношеннях завдяки виникненню нових водневих зв’язків. Він розчиняється також в ефірі, яким його можна екстрагувати із суміші з водою. З водних розчинів пероксид водню виділяється у вигляді нестійкого кристалогідрату Н2О2×2Н2О, температура плавлення якого становить -52 °С.
Діелектрична константа чистого Н2О2 при температурі 25 °С становить 93, а його 65%-го
водного розчину – 120, тому чистий Н2О2 та його водні розчини є чудовими іонізуючими розчинниками, які подібно до води добре розчиняють речовини з полярними та іонними зв’язками. Однак використання таких розчинників обмежене недостатньою стійкістю Н2О2.
У водних розчинах пероксид водню є слабкою, але сильнішою за воду кислотою:
Н2О2 « Н+ + НО2-, К = 2,24×10-12.
Під час взаємодії його розчинів з лугами можна виділити відповідні пероксиди металів, які належать до класу солей (а не оксидів), наприклад:
Н2О2 + Ва(ОН)2 = ВаО2 + 2Н2О.
На відміну від нормальних оксидів, які з кислотами утворюють сіль та воду, пероксиди у подібних реакціях дають сіль і пероксид водню, наприклад:
ВаО + Н2SО4 = ВаSО4 + Н2О;
ВаО2 + Н2SО4 = ВаSО4 + Н2О2.
Пероксиди металів як солі слабкої кислоти у водному розчині нестійкі. Це зумовлено їх сильним гідролізом та розкладом Н2О2 у лужному середовищі:
Na2O2 + 2H2O = 2NaOH + H2O2;
2H2O2 ¾ O¾¾H− ® 2H2O + O2.
Відомі численні неорганічні та органічні сполуки, які містять пероксидні групи.
Зв’язок між атомами кисню НО–ОН слабкий, що може бути пояснено взаємним електростатичним відштовхуванням неподілених пар електронів двох сполучених між собою атомів кисню. Він майже втричі слабкіший за зв’язок О–Н, тому для пероксиду водню особливо властиві реакції, які супроводжуються руйнуванням зв язку НО–ОН з утворенням сполук кисню з характерним для нього ступенем окиснення -2 або 0. Тобто для Н2О2 найхарактерніші окисно-відновні реакції. Пероксиди в окисно-відновних реакціях можуть перетворюватись за наведеною нижче схемою.
Прикладом може бути характерна для пероксиду водню реакція розкладу за типом диспропорціювання (окисно-відновна реакція самоокиснення – самовідновлення):
2Н2О2 = 2Н2О + О2.
Отже, Н2О2 здатний виявляти властивості як окисника, так і відновника, що властиво сполукам з проміжними ступенями окиснення елементів. Окисна та відновна активності Н2О2 характеризуються такими значеннями електродних потенціалів відповідних перетворень:
Н2О2 + 2Н+ + 2е- = 2Н2О, Е° = 1,78 В; О2 + 2Н+ + 2е- = Н2О2, Е° = 0,68 В.
Порівняння цих електродних потенціалів свідчить про те, що окиснювальна здатність Н2О2 (Е° = 1,78 В) виражена значно сильніше, ніж відновна (Е° = 0,68 В). Справді, пероксиди – сильні окисники. Вони легко окиснюють йодиди до вільного йоду, нітрити – до нітратів, сполуки хрому(ПІ) – до хрому(VІ) тощо, наприклад:
2КІ + Н2О2 + Н2SО4 = І2 + 2Н2О + К2SО4;
2К3[Сr(ОН)6] + 3Н2О2 = 2К2СrО4 + 8Н2О + 2КОН.
Лише під час взаємодії із сильними окисниками Н2О2 виявляє відновні властивості, продуктом його окиснення є кисень, наприклад:
Н2О2 + С12 = О2 + 2НС1; Н2О2 + О3 = 2О2 + Н2О;
3Н2О2 + 2КМnО4 = 3О2 + 2МnО2 + 2КОН + 2Н2О;
.5Н2О2 + 2КМnО4 + 3Н2SО4 = 5О2 + 2МnSО4 + К2SО4 + 8Н2О.
Останню реакцію використовують у хімічному аналізі для кількісного визначення пероксиду водню.
Озон. Озон О3 – алотропна модифікація кисню. Він утворюється з газоподібного кисню під дією на нього тихого електричного розряду або ультрафіолетового випромінювання. Для штучного добування О3 використовують озонатори. Тихий розряд проходить у просторі між стінками внутрішньої та зовнішньої скляних посудин. Кисень, який виходить з озонатора, містить кілька відсотків озону (до 10 %).
Озон також утворюється під час обробки молекулярного кисню потоком електронів, протонів, короткохвильового випромінювання, тобто за рахунок радіо - та фотохімічних реакцій.
Уприземній атмосфері концентрація озону дуже мала і становить 10-7–10-6 %. У стратосфері на висоті 18–50 км земна куля оточена тонким шаром озону, максимальна його кількість скупчена на висоті 20–30 км. Загальна площа атмосферного озонового шару становить 500 млн. км2.
Уземній атмосфері озон утворюється під час грозових розрядів, а у верхніх її шарах – під дією ультрафіолетового випромінювання. Географія озону дуже динамічна, на неї впливають повітряні течії – вітри атмосфери. Антициклони зменшують, а циклони
збільшують кількість О3 у стратосфері.
Вільний стратосферний озон відіграє дуже важливу роль у природі. Озоновий шар затримує небезпечне для живих істот жорстке короткохвильове сонячне випромінювання. Практична діяльність людини дуже часто призводить до руйнування озонового шару.
Серед речовин, які руйнують стратосферний озон, найбільш небезпечним є хлор. Одна
молекула хлору здатна знищити до 100 тис. молекул О3 (для порівняння: 1 молекула NО руйнує лише 10 молекул О3). Розрахунками із застосуванням математичного моделювання доведено, що один запуск космічного корабля багаторазового використання «Шаттл» (США) спричиняє руйнування 0,3% загальної кількості озону земної атмосфери.
Озон – отруйний газ синього кольору з різким характерним запахом (tкип = -110 °С, tпл = -192,7 °С). Рідкий озон має темно-синє забарвлення, твердий – чорне.
Молекула О3 діамагнітна, має кутову будову, що зумовлює її полярність. Крім того, порівняно з киснем вона має більшу поляризованість внаслідок більшого розміру молекули.
Енергія міжмолекулярної взаємодії О3 у конденсованих станах перевищує цю величину для молекул О3, тому температури кипіння і плавлення озону вищі, ніж кисню. Цими чинниками пояснюють також вищу розчинність озону у полярній воді (за звичайних умов 45 об’ємів О3 розчиняються у 100 об’ємах води).
Довжина зв’язку між атомами кисню (128 пм) проміжна порівняно з одинарним (149 пм) та подвійним (121 пм) зв’язками, тому вважають, що порядок зв’язків у молекулі О3 дорівнює
