
Лекция №1_2 сем_ФЕРМЕНТЫ МИКРООРГАНИЗМОВ
.pdf
Национальный фармацевтический университет Специальность «Биотехнология»
Дисциплина «Общая микробиология и вирусология» Кафедра биотехнологии
Лекция 1
ФЕРМЕНТЫ МИКРООРГАНИЗМОВ. РОЛЬ ФЕРМЕНТОВ В МЕТАБОЛИЗМЕ


ФЕРМЕНТЫ
Ферменты (энзимы) – биологические катализаторы, вырабатываемые живой клеткой. Являются веществами белковой природы, способными катализировать реакции преобразования вещества и энергии, то есть все метаболические реакции клетки. За каждое превращение одного метаболита в другой ответственным является особый фермент.
Биохимический анализ отдельных клеточных фракций показал, что ферменты расположены в различных органеллах соответственно их функциям в обмене веществ.
Примеры локализации ферментов в эукариотической клетке

ПРИМЕНЕНИЕ ФЕРМЕНТОВ
Но не только в организме, а и выделенные в чистом виде ферменты в определенных условиях катализируют разнообразные превращения, имеющие огромное значение в
разных отраслях практической деятельности.
Они используются, например, в процессах приготовления пищи, в производстве пищевых продуктов и напитков, фармацевтических препаратов, моющих средств, текстиля, кожи и др.
Некоторые примеры использования ферментов в промышленности

ХИМИЧЕСКОЕ СТРОЕНИЕ ФЕРМЕНТОВ
По химической структуре ферменты представляют собой глобулярные белки как простые, так и сложные. М. м. колеблется от 15 до нескольких тысяч Кдальтон. Например, пепсин, трипсин, уреаза – простые, а амилаза, рибонуклеаза – сложные белки.
Сложные ферменты ещё называют холоферментами; их белковая часть носит название апофермента или феррона, а небелковая, как правило, термостабильная часть фермента – агон.
Агон может быть лабильным, т.е. легко может быть отделен от белковой части и способным к самостоятельному существованию. В этом случае он носит название кофермент. Если же эта часть прочно связана, не отделяется от белковой части, то ее называют
простетической группой.
ХИМИЧЕСКОЕ СТРОЕНИЕ ФЕРМЕНТОВ
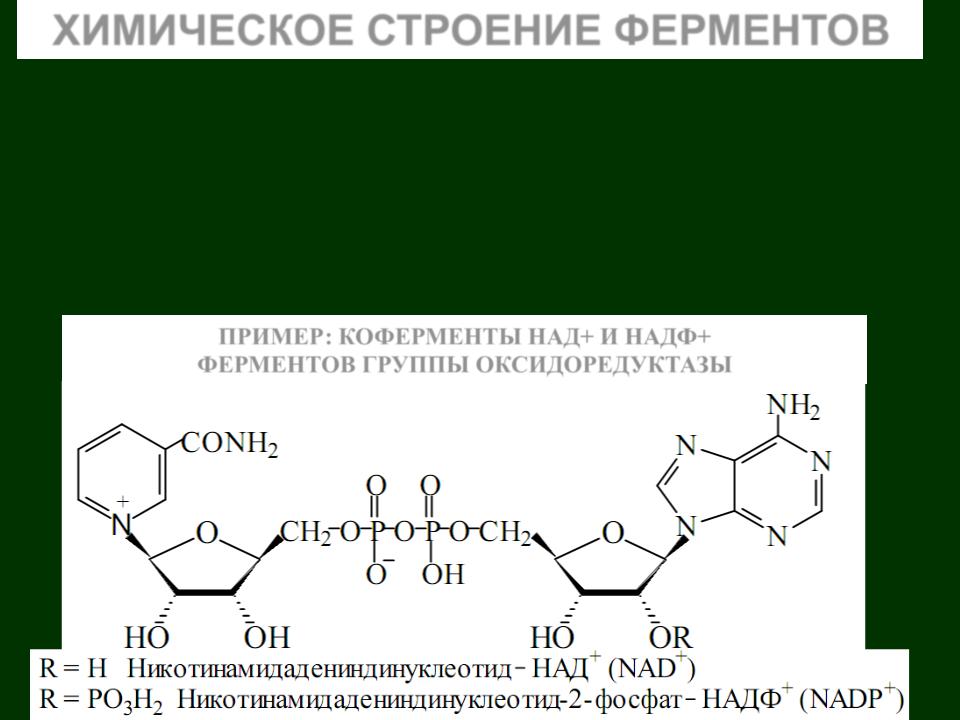
Роль коферментов в двухкомпонентных ферментах играют
большинство витаминов (Е, К, Q, В1, В2, В6, В12, С, Н и др.) или соединений, построенных с участием витаминов (коэнзим А,
НАД+ и т. п.). Кроме того, функцию коферментов выполняют такие соединения, как НS-глутатион, многочисленная группа нуклеотидов и их производных, фосфорные эфиры некоторых моносахаридов и ряд других веществ.
ПРИМЕР: КОФЕРМЕНТЫ НАД+ И НАДФ+
РИБОФЛАВИН |
ФЕРМЕНТОВ ГРУППЫ ОКСИДОРЕДУКТАЗЫ |
|
РИБИТОЛ

ХИМИЧЕСКОЕ СТРОЕНИЕ ФЕРМЕНТОВ
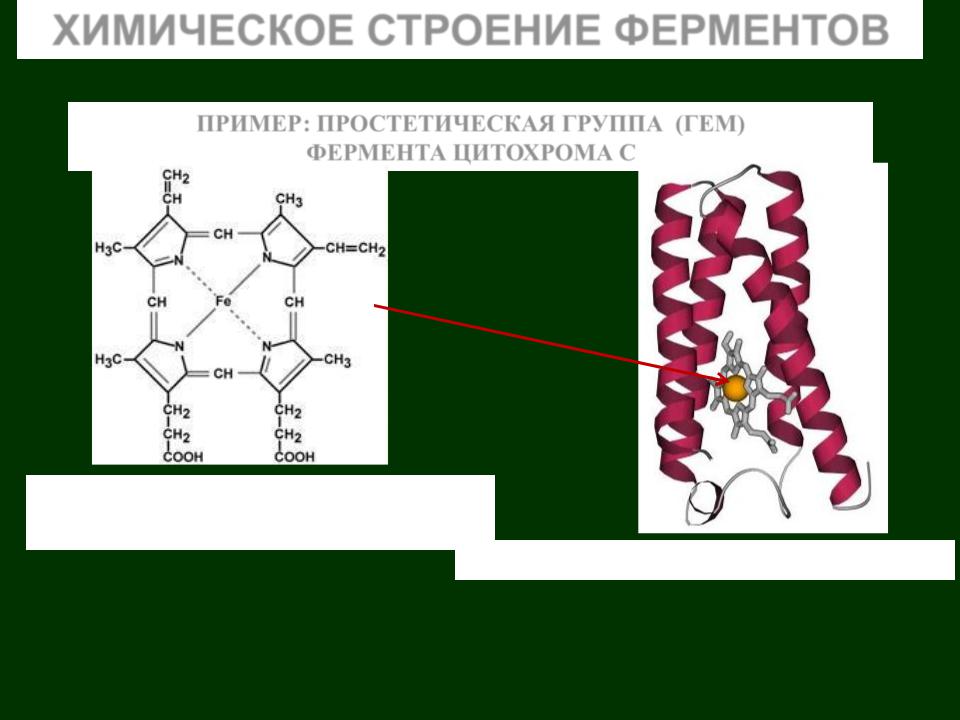
В качестве простетических групп могут быть: витамины (например, витамин В2 – рибовлавин является простетической группой флавиновых ферментов – ФМН, ФАД), или комплексно связанные металлы (железо в небелковой части – геме ферментов каталаза, пероксидаза, цитохромов; медь в аскорбиноксидазе, кальций в щелочной протеиназе) и др.
ПРИМЕР: ПРОСТЕТИЧЕСКАЯ ГРУППА (ФАД) ФЕРМЕНТА ГЛЮКОЗОКСИДАЗЫ
Флавинадениндинуклеотид (ФАД) Трехмерная структура глюкозоксидазы
ХИМИЧЕСКОЕ СТРОЕНИЕ ФЕРМЕНТОВ
ПРИМЕР: ПРОСТЕТИЧЕСКАЯ ГРУППА (ГЕМ) ФЕРМЕНТА ЦИТОХРОМА С
Гем – небелковая часть ферментов каталаза, пероксидаза, цитохромов
Трехмерная структура цитохрома С

КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ
Характерной особенностью двухкомпонентных ферментов
является то, что ни белковая часть, ни агон в отдельности не обладают заметной каталитической активностью. Только комплекс белковой и небелковой части проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность агона, присущую ей в свободном состоянии в очень малой степени; агон же стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам.
НЕАКТИВНЫЙ |
|
АГОН |
|
АКТИВНЫЙ |
ФЕРМЕНТ |
|
|
|
ФЕРМЕНТ |
|
|
|
||
|
|
|
|
|

КАТАЛИТИЧЕСКИЙ ЦЕНТР СЛОЖНЫХ ФЕРМЕНТОВ
Таким образом, хотя непосредственным исполнителем каталитической функции является кофермент или простетическая группа, образующая каталитический центр, ее действие немыслимо без участия полипептидных фрагментов белковой части фермента.
Более того, в апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый коферментсвязывающий домен; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна.
ПРИМЕР: ПРОСТЕТИЧЕСКАЯ ГРУППА (ГЕМ)
СВЯЗЫВАЕТСЯ С БЕЛКОВОЙ ЧАСТЬЮ ФЕРМЕНТОВ ЦИТОХРОМОВ, ПЕРОКСИДАЗЫ, КАТАЛАЗЫ ПО ОПРЕДЕЛЕННЫМ АМИНОКИСЛОТАМ АПОФЕРМЕНТА
