
- •Титриметричний метод аналізу Теоретична частина.
- •Титриметричний (обיємний) аналіз – метод кількісного аналізу, заснований на вімірюванні обיєму реагенту т, витраченого на реакцію з речовиною, яку визначають х.
- •Практична частина: і. Кислотно-основне титрування
- •Лабораторна робота № 3 (1). Визначення вмісту карбонату та гідрокарбонату натрію у суміші (Пряме титрування).
Титриметричний метод аналізу Теоретична частина.
Основні поняття.
Титриметричний (обיємний) аналіз – метод кількісного аналізу, заснований на вімірюванні обיєму реагенту т, витраченого на реакцію з речовиною, яку визначають х.
Титрування – процес визначення речовини Х поступовим додаванням невеликих кількостей речовини Т, при якому певним способом визначають точку (момент), коли вся речовина Х прореагувала. Титрування дозволяє знайти кількість речовини Х за відомою кількістю речовини Т, доданої до цієї точки, враховуючи, що співвідношення у якому Т реагує з Х відомо з стехіометрії або з іншого джерела.
Титрант – розчин, що містить активний реагент Т, за допомогою якого проводять титрування. Зазвичай титрування проводять, додаючи титрант з каліброванної бюретки у колбу з розчином речовини Х.
Аліквотна доля (аліквота) – точно відома кількість речовини, яку визначають, відібрана для аналізу. Відбирають речовину зазвичай піпеткою.
Точка еквівалентності (ТЕ) – така точка (момент) титрування, у якій кількість доданого титранту Т єквівалентно кількості речовини, яку
титрують Х.
Кінцева точка титрування(КТТ) – точка (момент) титрування, в якій деяка властивість розчину (наприклад його забарвлення) різко змінюється. КТТ більш-менш відповідає ТЕ.
Індикатор – речовина, що дає видиму зміну у ТЕ або поблизу неї. В ідеалі, титрант присутній у достатньо малих кількостях, щоб в його інтервалі переходу не витрачалося помітних кількостей титранту Т.
Інтервал переходу індикатора – Область концентрації йонів водню, металу або інших йонів в межах якої можна на око визначити зміну у тоні, інтенсивності забарвлення, флюоресценції або іншої властивості візуального індикатора, що викликана зміною співвідношення двох різних форм індикатора. Цю область зазвичай виражають у вигляді відיємного логарифму концентрації (pH= -logc(H3O+)). Для окисно-відновного індикатора, інтервал переходу є відповідною областю окисно-відновного потенціалу.
Ступінь відтитрованості f – співвідношення обיєму V(T) доданого титранту до обיєму V(ТЕ) титранту, що відповідає ТЕ:
f=V(T)\/V(ТЕ)
Тобто, ступінь відтитрованності – відношення кількості відтитрованої речовини, до її загальної кількості у розчині.
Крива титрування – Графічне зображення залежності зміни концентрації с(Х), речовини Х, яку визначають, або деякої повיязаної з нею властивості розчину, від обיєму V(T) доданого титранту Т. Величина с(Х) у ході титрування змінюється на кілька порядків, тому криву часто будують у координатах lg c(X) – V(T).
По осі абсцис відкладають обיєм доданого титранту V(Т), або ступінь відтитрованості f.
Якщо по осі ординат відкладають рівноважну концентрацію с(Х), або пропорційну їй величину, то отримують лінійну криву титрування.
Якщо по осі ординат відкладають lg c(X), або логарифм властивості, пропорційної с(Х), то отримують логарифмічну криву титрування.
Вимоги до реакцій, які використовують у титриметричному аналізі.
Реакція повинна протікати за строго визначеним стехіометричним рівнянням. Не повинно бути побічних реакцй.
Реакція повинна протікати кількісно, тобто практично до кінця. Рівновага в системі повинна бути повністю зміщена в бік продуктів реакції
Реакція повинна проходити швидко, щоб у будь-який момент титрування рівновага досягалася практично миттєво. Іноді для цього розчин доцільно нагріти або додати каталізатор.
Реакція має давати змогу точно і зручно визначати КТТ і ТЕ.
Класифікація методів титриметричного аналізу.
Кислотно-основне титрування (метод нейтралізації) – титрування, що базується на реакції переносу протонів від однієї часточки у розчині до іншої.
Ацидометрія (ацидиметричне титрування) – визначення речовини титруванням стандартним розчином кислоти.
Алкаліметрія (алкаліметричне титрування) – визначення речовини титруванням стандартним розчином сильної основи.
Окисно-відновне титрування (редоксиметрія) – титрування, що супроводжується переходом одного чи більше електронів від донора (відновника) до акцептора (окисника).
Осадове титрування – титрування, у якому речовина, яку титрують, взаємодіє з титрантом, утворюючи осад.
Комплексометричне титрування – титрування речовини, яку визначають, розчином такої речовини , що утворює з речовиною, яку визначають слабодисоційований розчинний комплекс. Різновидом комплексометричного титрування є комплексонометричне титрування, коли речовина, яку визначають, утворює з титрантом - розчином комплексонів комплексонати металів.
Види титрування, які застосовують у титриметричному аналізі.
Пряме титрування. Речовина Х безпосередньо титрується стандартним розчином титранту Т чи навпаки:
T+X = Продукти реакції
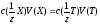 ,
де 1/z- фактор
еквівалентності
,
де 1/z- фактор
еквівалентності
Зворотнє титрування – титрування надлишку стандартного розчину, який додали до розчину, який аналізують. До розчину речовини Х додають у надлишок точно відомий обיєм стандартного розчину речовини Т1. Речовина Х повністю реагує з Т1. Надлишок речовини Т1 титрують стандартним розчином титранту Т2.
Х + Т1 = Продукти реакції
Т1 (залишок) + Т2 = Продукти рекції
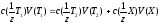 ,
де 1/z- фактор
еквівалентності
,
де 1/z- фактор
еквівалентності
Зворотнє титрування використовують, коли пряма реакція Х з Т проходить надто повільно, або не існує індикатор для прямого титрування.
Приклад. Визначення кальцію у карбонаті кальцію методом зворотнього титрування. Нехай нам потрібно визначити вміст Ca(речовина Х) вCaCO3. Для цього розчинимо CaCO3 у розчині з точно визначеним вмістом HCl (речовина Т1).
CaCO3 + 2HCl CaCl2 + CO2 + H2O
X T1
Надлишок HCl, що не прореагував відтитровують розчином NaOH (речовина Т2) з точно відомою концентрацією.
HCl + NaOH = NaCl + H2O
Т1 (залишок) Т2
У відповідності з законом еквівалентів маємо
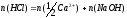 ,
,
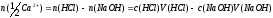 ,
,
n – кількість речовини.
Знаючи n(1/2Ca2+), можемо знайти масу Са:
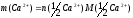 ,
,
n – кількість речовини,
M – молярна маса.
Титрування замісника. Речовина, яку визначають, не реагує з титрантом безпосередньо, тому його визначають опосередковано, використовуючи стехіометричну реакцію з утворенням іншої речовини, яку і визначають титруванням. До розчину речовини Х додають реагент А у надлишку (для забезпечення повноти протікання реакції). При цьому утворюється речовина В – замісник у кількості, еквівалентній кількості компоненту Х:
Х + А (надлишок) В (замісник)
Замісник В відтитровують стандартним розчином титранту Т:
В + Т продукти реакції
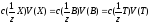 ,
де 1/z- фактор
еквівалентності
,
де 1/z- фактор
еквівалентності
А отже
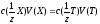 ,
де 1/z- фактор
еквівалентності
,
де 1/z- фактор
еквівалентності
Приклад. Визначення нітратів методом титрування замісника. До аліквоти розчину додають цинк у невеликому надлишку і луг. Відбувається реакція:
NaNO3 + 4Zn + 7NaOH + 6H2O NH3 + 4Na2[Zn(OH)4]
Х В
Аміак, що утворився, відганяють у приймач з відомим обיємом стандартного розчину HCl, де аміак перетворюється на йони амонію:
NH3 + HCl NH4Cl
B T D
HCl, що не прореагувала відтитровують стандартним розчином лугу:
HCl + NaOH NaCl + H2O
Таким чином:
n(NaNO3) = n(NH3)
n(HCl) = n(NH3) + n(NaOH) = n(NaNO3) + n(NaOH)
n(NaOH) = n(HCl) – n(NaOH)
c(NaNO3) = [c(HCl)V(HCl) – c(NaOH)V(NaOH)]/V(NaNO3)
m(NaNO3) = c(NaNO3)M(NaNO3)Vk , де
n – кількість речовини;
M – молярна маса;
c – концентрація;
Vk – обיєм вихідного розчину.
