
patgiz_uchebnik_2_chast
.pdf(ослабление разрушения тромбоцитов), эритремии, эссенциальной тромбоцитемии (усиление тромбоцитопоэза).
При первичном тромбоцитозе (эритремия, эссенциальная тромбоцитемия) очень часто выявляется склонность к тромбообразованию.
Важное значение в тромбообразовании принадлежит и ослаблению активности противосвертывающей системы крови (табл. 6).
Таблица 6
Важнейшие элементы противосвертывающей системы крови и их эффекты
Элемент |
Механизм действия |
||
|
|
||
Антитромбопластин |
Ингибитор комплекса факторов II в VII а |
||
|
|
||
|
Ингибитор тромбина и плазменных фак- |
||
Антитромбин III |
торов VII, |
IX, Ха, XI а, XII а. Потен- |
|
цирование |
эффектов гепарина. Слабый |
||
(α2 - глобулин) 70 - 80 % анти- |
|||
ингибитор плазмина и калликреина. |
|||
коагулянтной активности крови |
|||
|
|
||
Тромбомодулин |
Инактивация тромбина и активация белка |
||
С |
|
||
|
|
||
Гепарин (сульфатированный по- |
Подавление образования тромбина. Ак- |
||
лисахарид) |
тивация антитромбина III. |
||
|
Ингибитор тромбина и плазменных фак- |
||
α1 - антитрипсин |
торов IX а, XI а, XII а, плазмина, каллик- |
||
|
реина. |
|
|
|
К - витаминзависимые антикоагулянты. |
||
Белок С и S |
Ингибируют плазменные факторы VIII а, |
||
|
V а. Активируют фибринолиз. |
||
|
|
||
Плазмин |
Расщепление фибрина, фибриногена, V, |
||
VIII плазменных факторов, белка С |
|||
|
|||
Доказано, что пятидесятипроцентный дефицит естественных коагулянтов ведет к тромбозу. Описан врожденный дефицит белка С и S, при котором обнаружена тенденция к тромбоэмболии вен. Приобретенная тенденция к тромбозу описана у беременных женщин и связана с повышением связывания белка С и уменьшением белка S в плазме крови.
Дефицит антитромбина III описан как врожденный семейный дефект и может иметь приобретенный характер, например, при поражении печени, нефротическом синдроме, в первой фазе ДВС-синдрома.
Образование плазмина из плазминогена инициируется тромбином, белком С и связано с освобождением активаторов плазминогена из сосудистой стенки. Блокируют фибринолитическую систему а1-антитрипсин, а2-плазминовый ингибитор и а2-макроглобулин. Сильное подавление противосвертывающей системы создает большую опасность тромбоза.
Так, врожденный дефицит антитромбина III несовместим с жизнью, поскольку ведет к тромбоэмболии. Более того, отмечены спонтанные тромбозы и эмболии при снижении антитромбина, III до 40-60 %. Для сравнения можно привести следующие данные. Снижение таких плазменных факторов свертыва-
61
ния как VIII, IX, XI и фибриногена даже до 10-20 % не сопровождается спонтанной кровоточивостью. Это говорит о том, что расстройства противосвертывающей системы более опасны для жизни, нежели дефицит плазменных факторов свертывания (В.Г.Лычев).
Для предотвращения тромбоза и его лечения используются антикоагулянты и антиагреганты (табл. 7).
ТРОМБОГЕМОРРАГИЧЕСКИЙ СИНДРОМ. (ДВС-синдром, коагулопатия потребления).
Диссеминированное внутрисосудистое свертывание крови - ДВС-синдром - это сложный неспецифический патологический процесс, который первоначально характеризуется генерализованным внутрисосудистым свертыванием крови с блокадой микроциркуляции в жизненно важных органах и последующей склонностью к кровоточивости из-за дефицита плазменных факторов свертывания, активации фибринолиза, образования веществ, повышающих проницаемость сосудов.
Таким образом, при тромбогеморрагическом синдроме происходят одновременно два явления, патогенетически связанные между собой - генерализованное тромбообразование и прогрессирующая склонность к кровоточивости.
ЭТИОЛОГИЯ. Наиболее частые причины тромбогеморрагического синдрома приведены ниже:
1.Сепсис (особенно грамм-отрицательная микрофлора).
2.Злокачественные опухоли (лейкозы, диссеминированные опухоли легких, желудка, простаты).
3.Шок любой этиологии.
4.Акушерская патология (плодоразрушающие операции, атония матки, эмболия околоплодными водами, эклампсия, преждевременная отслойка плаценты и ее предлежание),
5.Тяжелые травмы и хирургические травматические операции.
6.Иммунологический конфликт (системная красная волчанка, болезнь Шенлейн-Геноха, острый диффузный гломерулонефрит).
7.Укусы змей.
8.Терминальные состояния.
Тромбогеморрагический синдром в 30-40% связан с генерализованной инфекцией (бактерии, вирусы), а в периоде новорожденности в 70 % с развитием "злокачественной пурпуры новорожденных".
Дессеминированное внутрисосудистое свертывание всегда является вторичным по отношению к заболеванию его вызвавшему.
ПАТОГЕНЕЗ. Несмотря на различие причин, вызывающих тромбогеморрагический синдром, главным условием является чрезвычайно сильная активация внутрисосудистого свертывания крови и неспособность противосвертывающей системы (особенно антитромбин III и белок С и S) предотвратить этот процесс.
62
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 7 |
||
|
|
|
Антикоагулянты и механизм их действия |
|
|
|
|
|||||||||
|
|
|
(Б.Б. Векслер и др., с дополнениями автора) |
|
|
|
|
|||||||||
Антикоа- |
Механизм |
Дли- |
Изменение |
Антидот |
Предпочтительное |
|||||||||||
гулянт |
|
действия |
тель- |
гемостати- |
при передо- |
применение |
||||||||||
|
|
|
|
|
ность |
ческих по- |
зировке |
|
|
|
|
|
||||
|
|
|
|
|
дейст- |
казателей |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вия |
крови |
|
|
|
|
|
|
|
|
|
|
Гепарин |
Подавление |
2-4 ч. |
Увеличение |
|
Протамин |
Для |
профилактики |
|||||||||
|
|
обра- |
|
|
времени |
|
сульфат |
|
тромбоза вен у хи- |
|||||||
|
|
зования |
|
|
свертывания |
|
|
|
рургических |
боль- |
||||||
|
|
тромбина, |
|
крови |
|
|
|
|
|
ных |
и |
переломах |
||||
|
|
активация |
|
|
|
|
|
|
|
костей, |
|
предотва- |
||||
|
|
антит- |
|
|
|
|
|
|
|
|
рещения |
дальней- |
||||
|
|
ромбина III |
|
|
|
|
|
|
|
шего |
|
свертывания |
||||
|
|
|
|
|
|
|
|
|
|
|
|
крови |
при |
артери- |
||
|
|
|
|
|
|
|
|
|
|
|
|
альном тромбозе. |
||||
Тромболи- |
Ускорение |
Мин. |
Стрепто- |
и |
Перелива- |
Для |
|
уменьшения |
||||||||
тики |
|
фибриноли- |
|
урокиназа |
|
ние |
свеже- |
интенсивности ар- |
||||||||
(стрептоки- |
за |
|
|
увеличивают |
заморо- |
|
териального |
тром- |
||||||||
наза, |
уро- |
|
|
|
|
тромбиновое |
женной |
|
боза |
|
|
|
|
|||
киназа, тка- |
|
|
|
|
время |
в |
2 |
плазмы |
|
|
|
|
|
|
||
невой |
акти- |
|
|
|
|
раза |
|
|
|
|
|
|
|
|
|
|
ватор |
плаз- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
миногена) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Антагони- |
Подавление |
До 48 ч. |
Протромби- |
Свежезамо- |
Для |
|
длительного |
|||||||||
сты |
вита- |
в |
печени |
|
новое |
время |
роженная |
снижения |
сверты- |
|||||||
мина К |
синтеза |
|
|
увеличи- |
|
плазма |
нор- |
вания крови (про- |
||||||||
|
|
плазменных |
|
вается в 1,5- |
мализует |
филактики тромбо- |
||||||||||
|
|
факторов II, |
|
2 раза |
|
|
протромби- |
зов) |
|
|
|
|
||||
|
|
VII, IX, X и |
|
|
|
|
новое |
время |
|
|
|
|
|
|||
|
|
белков |
С и |
|
|
|
|
за 4-6 ч., а |
|
|
|
|
|
|||
|
|
S |
|
|
|
|
|
|
витамин |
К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
за 12-36 ча- |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
сов. |
|
|
|
|
|
|
|
Аспирин |
Необрати- |
7 дн. |
Время |
свер- |
Перелива- |
Для |
профилактики |
|||||||||
(антиагре- |
мая блокада |
|
тывания |
|
ние тромбо- |
острого |
инфаркта |
|||||||||
гант) |
|
циклоокси- |
|
крови |
удли- |
цитов |
|
|
миокарда при ише- |
|||||||
|
|
геназы |
пла- |
|
няется |
|
|
|
|
|
мической |
болезни |
||||
|
|
стинок |
- |
|
|
|
|
|
|
|
сердца |
|
|
|
||
|
|
нарушение |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
агрегации |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
тромбо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цитов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
63 |
Вразвитии тромбогеморрагического синдрома выделяют две стадии - гипер- и гипокоагуляции. Стадия гиперкоагуляции кратковременная и быстро переходит в стадию гипокоагуляции, продолжительность которой может исчисляться часами.
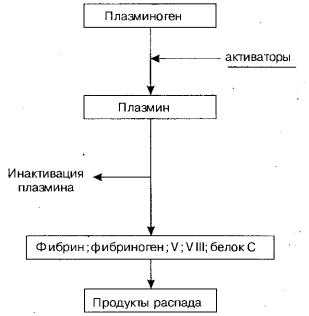
Внутрисосудистая коагуляция крови обусловлена попаданием в кровь прокоагулянтных веществ (при патологических родах, удалении плаценты, разможжении тканей, ожогах, опухолевом процессе, шоке, гемолизе, попадании в кровь трипсина при остром панкреатите) или же контактом крови с поврежденным эндотелием (сепсис) и с чужеродной поверхностью (экстракорпоральное кровообращение). Свертывание крови осуществляется преимущественно в сосудах микроциркулаторного русла. Причем, свертывание идет как по внешнему, так и внутреннему механизму. При этом при агрегации тромбоцитов и их лизисе
вкровоток освобождаются многие тромбоцитарные факторы- Т3, Т4 (тромбоцитарный тромбапластин и антигепарин), серотонин, аденозиндифосфат, которые вызывают последующее усиление адгезии и агрегации тромбоцитов. Катехоламины, избыток которых наблюдается в этот момент, непосредственно активируют плазменный фактор контакта (XII). Все это ведет к генерализованной внутри сосудистой коагуляции. Это может вести к микротромбозам во многих органах, в том числе и жизненно важных, с развитием ишемии и даже некроза, Вслед за гиперкоагуляцией развивается гипокоагуляция, когда кровь не свертывается не только в течение многих минут, но и часов. Механизм гипокоагуляции следующий: в первую очередь это связано с уменьшением плазменных факторов коагуляции и тромбоцитов, использованных в ходе диссеминированной внутрисосудистой коагуляции (фибриноген, протромбин, V, X плазменные факторы). Образовавшийся тромбин в ходе свертывания крови, белок С и ряд веществ, освобождающихся из сосудистой стенки, активируют плазминоген с образованием плазмина (протеолитический фермент) (рис.1 табл. 7, 8). Последний вызывает лизис фибрина, фибриногена, белка С, V, VIII плазменных факторов. Одновременно с этим активируется кининовая система и система комплемента. Фактически формируется "гуморальный протеазный взрыв", результатом которого является накопление в крови продуктов белкового распада, повышающих проницаемость сосудистой стенки.
Инактивация плазмина происходит под влиянием его ингибиторов- а1,- антитрипсина, а2-плазминового ингибитора, а2 макроглобулина.
Таким образом, уменьшение факторов свертывания в крови происходит не только в ходе коагуляции крови, но и в процессе фибринолиза. Одновременно с этим уменьшается количество антитромбина 111. Последний расходуется на инактивацию ферментных факторов свертывания крови. Именно снижение уровня антитромбина III способствует прогрессированию внутрисосудистого свертывания и делает организм гепаринорезистентным. Поэтому тромбогеморрагический синдром называют коагулопатией потребления. Время свертывания крови резко увеличивается, формируется стадия гипокоагуляции.
Входе расщепления фибрина, фибриногена и других белков образуются продукты деградации фибрин-фибриногена. Они, с одной стороны, задерживают полимеризацию фибрина и нарушают функцию тромбоцитов (ингибируют агрегацию), усиливая, таким образом, гипоагуляцию, а с другой стороны, вызывают
64
повышение проницаемости сосудов, следствием которого будут многочисленные геморрагии во внутренних органах (легких, печени, почках, мозге) и коже. Кроме того, из поврежденных сосудов отмечается профузное кровотечение, которое может вести к гибели больного из-за острой кровопотери. На аутопсии в органах обнаруживаются ишемические и геморрагические инфаркты и кровоизлияния. Кровь, взятая в пробирки, не свертывается часами, в то время как микро циркуля торное русло забито микротромбами. Чем острее ДВС-синдром, тем более кратковременна стадий гиперкоагуляции и тем тяжелее фаза выраженной гипокоагуляции и кровоточивости.
Рис. 1 Активация фибринолитической системы.
Таким образом, при тромбогеморрагическом синдроме в крови отмечается снижение количества тромбоцитов, фибриногена, антитромбина III, плазмина, V, VIII факторов плазмы и увеличение продуктов расщепления фибринфибриногена.
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ.
В первую очередь лечение направлено на устранение процесса, способствующего избыточной коагуляции крови (сепсис, шок, ожог и т.д.). В связи с истощением плазменных факторов рекомендуется восполнить их путем переливания свежезамороженной плазмы, а также введения антиагрегантов и веществ улучшающих реологические свойства крови. Одновременно с этим возмещается фибриноген, и антитромбин III. Установлено, что антитромбин III в комплексе с гепарином наиболее эффективен на ранних этапах свертывания крови, ибо обеспечивает инактивацию, IX а и X а факторов и предотвращает образование тромбина. Так, по данным В.Г.Лычева, 1 мкг комплекса антитромбин III -
65
гепарин нейтрализует 32 ЕД фактора X а, что равнозначно Предупреждению образования 1.600 ЕД тромбина, на инактивацию которого в случае его образования необходимо уже 73 мкг указанного комплексного антикоагулянта. Так как при тромбогеморрагическом синдроме имеет место блокада системы мононуклеарных фагоцитов, в качестве дезинтоксикацион-ного средства применяется лечебный плазмоферез, что, кстати, и уменьшает гепаринорезистентность.
Таблица 8
Фибринолитическая система (активаторы и ингибиторы) (Д.М. Зибанров)
|
|
Молеку- |
Концен- |
|
|
|
Компоненты |
лярная |
трация в |
Функция |
|||
масса, |
плазме, |
|||||
|
|
|
|
|||
|
|
кДа |
мкМ |
|
|
|
Плазминоген |
92 |
1,3 |
Предшественник |
плазмина |
||
|
|
|
|
|
||
Плазмин |
|
85 |
- |
Сериновая протеаза, гидролиз фибри- |
||
|
|
|
|
на |
|
|
Тканевой актива- |
67 |
0,00006 |
Фермент, находящийся в клетках и |
|||
тор плазминогена |
|
|
освобождающийся в кровь. Превра- |
|||
|
|
|
|
щение плазминогена в плазмин путем |
||
|
|
|
|
ограниченного протеолиза |
||
Проурокиназа |
54 |
0,00015 |
Одноцепочная |
форма активатора |
||
|
|
|
|
плазминогена типа урокиназы, при- |
||
|
|
|
|
сутствующая в крови и моче |
||
Урокиназа |
|
30 |
|
Двуцепочная форма активатора плаз- |
||
|
|
|
|
миногена, находящаяся в моче |
||
Фактор XII, кал- |
|
|
Компоненты контактной фазы свер- |
|||
ликреин, |
высоко- |
|
|
тывания крови, превращающие плаз- |
||
молекулярный |
|
|
миноген в плазмин |
|||
кининоген |
|
|
|
|
|
|
Альфа 2- |
|
67 |
1,0 |
Специфический |
ингибитор |
|
антиплазмин |
|
|
плазмина |
|
||
Ингибитор |
акти- |
52 |
0,2 – |
Специфический ингибитор тканевого |
||
ватора |
плазми- |
|
0,0004 |
активатора плазминогена и урокина- |
||
ногена - 1 |
|
|
|
зы. Находится в эндотелии, тромбоци- |
||
|
|
|
|
тах и освобождается в кровь |
||
Ингибитор |
акти- |
48 |
|
Специфический ингибитор тканевого |
||
ватора |
плазми- |
|
|
активатора в плаценте и нейтрофилах, |
||
ногена - 2 |
|
|
|
освобождается в кровь во время бере- |
||
|
|
|
|
менности |
|
|
Ингибитор |
акти- |
67 |
0,1 |
Ингибитор урокиназы, присутствует в |
||
ватора |
плазми- |
|
|
моче, обнаружен в плазме крови, |
||
ногена - 3 |
|
|
|
идентичен ингибитору протеина С |
||
Стрептокиназа |
48 |
|
Белок, продуцируемый стрептококка- |
|||
|
|
|
|
ми, косвенно активирует плазминоген |
||
|
|
|
|
|
66 |
|
Глава 2. Нарушения функций сердца и сосудов
2.1. СЕРДЕЧНЫЕ АРИТМИИ
Основными функциями сердечной мышцы являются: автоматия, возбудимость, проводимость и сократимость. Выполнение этих функций связано с особенностями потенциала покоя и действия различных клеток сердечной мышцы и наличием проводящей системы. Среди важнейших особенностей следует назвать параметры, характеризующие потенциал покоя клеток различных отделов сердца и формирование потенциала действия. В настоящее время известно, что потенциал покоя клеток синоатриального узла равен -50-60мВ, атриовентрикулярного узла 60-70мВ, а кардиомиоцитов предсердий и желудочков - 80-90 мВ. В клетках синусного и атриовентикулярного узлов формирование потенциала действия начинается с процесса медленной деполяризации, а в кардиомиоцитах - с быстрой деполяризации. Понять особенности формирования потенциала действия в этих структурах сердца можно на основании наличия в мембранах клеток сердца трех разновидностей каналов, по которым осуществляется электролитный обмен: быстрые натриевые, медленные натрийкальциевые и калиевые каналы. Известно также, что при потенциале покоя равном 50-70 мВ быстрые натриевые каналы, как правило, блокированы. В синусовом узле спонтанно, а в атриовентрикулярном - под влиянием приходящего импульса, формирование потенциала действия начинается с медленной деполяризации, которая обусловлена активацией медленных каналов. Натрий медленно поступает в цитоплазму клетки, уменьшает отрицательный заряд ее мембраны, и как только этот заряд достигает пороговой величины 40 мВ, активируются быстрые натриевые каналы и натрий, стремительно поступая в цитоплазму, вызывает быструю деполяризацию, а заряд вместо отрицательного становится даже положительным. Одновременно с этим снова активируются медленные натрие- во-кальциевые каналы, поэтому натрий продолжает медленно поступать в цитоплазму, и одновременно в цитоплазму поступает кальций. Вслед за этим активируются калиевые каналы, и калий начинает покидать клетку, что приводит к процессам реполяризации. В дальнейшем за счет натрий-калий-кальциевых насосов восстанавливается потенциал покоя, а затем процессы повторяются.
Такое повторение генерации импульсов обеспечивает выполнение автоматической функции синоартериального узла. Наличие медленной деполяризации в атриовентрикулярном узле, возникающей в ответ на приходящий в него импульс, обеспечивает задержку импульсов в нем. Это имеет важный биологический смысл, т.к. импульс вызывает возбуждение кардиомиоцитов не в ранний, наиболее неблагоприятный период (окончание зубца Т на ЭКГ): а тогда, когда возбудимость кардиомиоцитов полностью восстанавливается. В кардиомиоцитах предсердий и желудочках заряд равен 80-90мВ, приходящий импульс вызывает активацию натриевых каналов, поэтому потенциал действия начинается с процессов быстрой деполяризации. Отличительной особенностью такого потенциала является наличие "плато", которое обусловлено активацией медленных натрий-кальциевых каналов. С изменением концентрации кальция в цитоплазме связан механизм сопряжения возбуждения с сокращением миофибрилл кардиомиоцитов. При увеличении количества кальция сила сокращений возрастает.
67
Для того чтобы понять изменение ритма сердца в условиях физиологии и патологии, необходимо проанализировать особенности симпатоадреналовых и парасимпатических влияний на сердце. Известно, что при повышении активности симпатического отдела нервной системы отмечается учащение сокращений сердца, ускорение проведения импульсов и увеличение силы сокращения сердца. Генез этих эффектов связан с действием норадреналина и адреналина на сердце. По современным представлениям, катехоламины повышают активность медленных натрий-кальциевых каналов, поэтому в синусовом узле генерация импульсов учащается, в атриовентрикулярном узле облегчается их проведение, а в связи с повышением количества кальция в цитоплазме кардиомиоцитов происходит увеличение силы сокращения сердца.
Повышение активности парасимпатического отдела нервной системы проявляется в виде брадикардии, замедления проведения импульса, а в исключительных случаях, и в полной его блокаде в атриовентрикулярном узле. Это связано с особенностями влияния медиатора парасимпатического отдела нервной системы - ацетилхолина на потенциал покоя в синусовом и атриовентрикулярном узлах, в клетках которых ацетилхолин вызывает явления гиперполяризации. При этом потенциал покоя синоатриального узла увеличивается до 65-75 мВ, атриовентикулярного узла - свыше 70 мВ. Как при нормальном потенциале покоя, так и в условиях гиперполяризации быстрые натриевые каналы блокированы. Требуется значительно больше времени, чтобы в ходе медленной деполяризации был достигнут критический заряд 40 мВ, когда начинается возбуждение быстрых натриевых каналов, и формирование процессов быстрой деполяризации. Такие изменения позволяют понять механизм замедления ритма сердечных сокращений и проведения в атриовентрикулярном узле.
При резком повышении активности парасимпатического отдела, а отсюда
ирезкой гиперполяризации, потенциал действия может не сформироваться, вследствие чего возникает остановка сердца. Классическим примером подобного рода изменений является остановка сердца при нокауте у боксера.
При нарушении автоматизма, возбудимости, проводимости и сократимости формируются явления, получившие название "аритмии сердца".
Аритмии сердца являются наиболее частыми нарушениями функции этого органа и представляют собой изменение частоты и (или) периодичности возбуждения и сокращения сердца. Клинически аритмии сердца могут проявляться ощущением сердцебиений и перебоев в работе сердца, болью в области сердца (стенокардия), потерей сознания, снижением артериального давления, одышкой, вплоть до удушья, и развитием отека легких. Основным методом диагностики аритмии сердца является электрокардиография.
Причины возникновения аритмий многообразны. В зависимости от особенностей этиологических факторов аритмии подразделяют на функциональные
иорганические, функциональные аритмии, как правило, имеют психогенное, рефлекторное происхождение или являются следствием гипоксии и электролитных расстройств. Органические аритмии наблюдаются при органических поражениях миокарда (инфаркте, воспалении, кардиосклерозе).
Классификация аритмий (в зависимости от этиологических факторов) :
1.Ишемические - возникают при коронарной недостаточности.
68
2.Гемодинамические - формируются при расстройствах внутрисердечного и системного кровообращения (врожденные, приобретенные пороки, артериальные гипертензии, сердечно-сосудистая недостаточность и др.).
3.Инфекционно-токсические и инфекционно-аллергические - раз-
виваются |
вследствие поражения сердца при миокардитах, ревматическом |
процессе, |
инфекционных заболеваниях и т.п. |
4.Токсические - вследствие интоксикации наперстянкой, адреналином, кофеином, алкоголем и другими лекарственными и токсическими соединениями.
5.Дисгормональные - возникают при нарушениях баланса таких гормонов как катехоламины, кортикостероиды, тиреоидные, половые гормоны.
6.Электролитные - являются следствием сдвигов содержания и соотношения калия, натрия, кальция и магния.
7.Механические - могут «сопровождать травмы сердца и оперативные вмешательства на органах грудной клетки, катетеризация сердца.
8.Врожденные - формируются при пороках развития (врожденная атриовентрикулярная блокада, синдром Вольфа-Паркинсона-Уайта, при котором возникает преждевременное возбуждение и сокращение желудочков вследствие наличия дополнительных пучков проводящей системы, по которым синусовый импульс по более короткому пути, минуя атриовентрикулярный узел, достигает желудочков).
АРИТМИИ, СВЯЗАННЫЕ С НАРУШЕНИЕМ АВТОМАТИЗМА.
Известно, что существуют центры автоматизма трех уровней. Клетки синоатриального узла представляют собой клетки-водителя ритма первого порядка. Они генерируют импульсы с частотой 70-80 импульсов в минуту. В атриовентрикулярном узле находятся клетки-водителя ритма второго порядка. Они могут генерировать импульсы с частотой 50-60 импульсов в минуту. В волокнах Пуркинье находятся клетки, выполняющие функцию водителя ритма третьего порядка. Они генерируют импульсы с частотой 15-40 импульсов в минуту. В норме водители ритма второго и третьего порядка не функционируют.
Аритмии, связанные с нарушениями автоматизма, могут быть обусловлены нарушением генерации импульса в синусовом узле с возможным возникновением импульса вне синусового узла. В зависимости от локализации источника импульсации аритмии данного типа можно подразделить на две основные группы: номотопные и гетеротопные (П.Ф.Литвицкий, С.П.Грачев). К номотопным аритмиям относятся: синусовая тахикардия, синусовая брадикардия, синусовая аритмия. К гетеротопным аритмиям относятся: предсердный медленный ритм, атриовентрикулярный узловой ритм, идиовентрикулярный (желудочковый) ритм, диссоциация с интерференцией и миграция водителя ритма.
Синусовые тахикардия и брадикардия по механизму развития классифицируется на центральные, рефлекторные, периферические и обменные.
СИНУСОВАЯ ТАХИКАРДИЯ
Синусовая тахикардия центрального происхождения наблюдается при эмоциональном стрессе, при действии на нервную систему возбуждающих факторов.
69
Рефлекторная тахикардия вызывается тремя группами причин: снижением системного артериального давления, гипоксией и болевыми воздействиями. При снижении артериального давления уменьшается раздражение бapоpopeцептopoв, особенно аортальных и синокаротидных зон. Вследствие v дефицита притока информации в сосудодвигательный центр активируются его прессорные зоны, что одновременно сопровождается активацией симпато-адреналовой системы. При гипоксии и боли также рефлекторно активируется симпато-адреналовая система.
Периферическая синусовая тахикардия наблюдается сравнительно редко: при раздражении рубцом или опухолью симпатических ганглиев и нервов или в эксперименте путем введения адреналина.
Обменная тахикардия связана с усилением обмена веществ, особенно в области синоатриального узла, например, при лихорадке, гипертермии, тиреотоксикозе.
Анализ синусовых тахикардии показывает, что их формирование реализуется за счет высвобождения адреналина и норадреналина: на ЭКГ наблюдается укорочение интервала PQ и общей диастолы. Проявляется синусовая тахикардия учащением сердечных сокращений свыше 90-100 ударов в минуту. Частота сердечных сокращений может увеличиваться в два и более раза, увеличивается и сила сокращений сердца.
СИНУСОВАЯ БРАДИКАРДИЯ
Центральная синусовая брадикардия наблюдается как в физиологических (во время сна, у атлетов), так и в патологических условиях (например, при воспалении, опухолях мозга). Центральная брадикардия может наблюдаться при назначении наркотических средств.
Рефлекторные синусовые брадикардии развиваются при резком и быстром повышении артериального давления, надавливании на глазные яблоки (рефлекс Ашнера), каротидные синусы (рефлекс Геринга), при ударе по передней брюшной стенке (рефлекс Гольца), растяжении желчных путей и желчного пузыря.
При повышении системного артериального давления в результате раздражения барорецепторов, поступающая в сосудодвигательный центр информация подавляет активность прессорных зон и активирует центры блуждающих нервов. Поэтому в этих условиях преобладают парасимпатические эффекты на сердце.
Периферические синусовые брадикардии наблюдаются при раздражении ветвей блуждающего нерва опухолью или рубцом, при введении ацетилхолина.
Обменные синусовые брадикардии обусловлены снижением обмена веществ, особенно в области синоатриального узла, переохлаждением, дефицитом тиреоидных гормонов.
В связи с тем, что при синусовой брадикардии основные изменения обусловлены эффектом парасимпатического отдела нервной системы и ее медиатора ацетилхолина, на ЭКГ отмечается удлинение интервала PQ и общей диастолы, частота сердечных сокращений уменьшается ниже 60, но не ниже 40, ибо последнее может наблюдаться при нарушении проводимости. Таким образом,
70
