
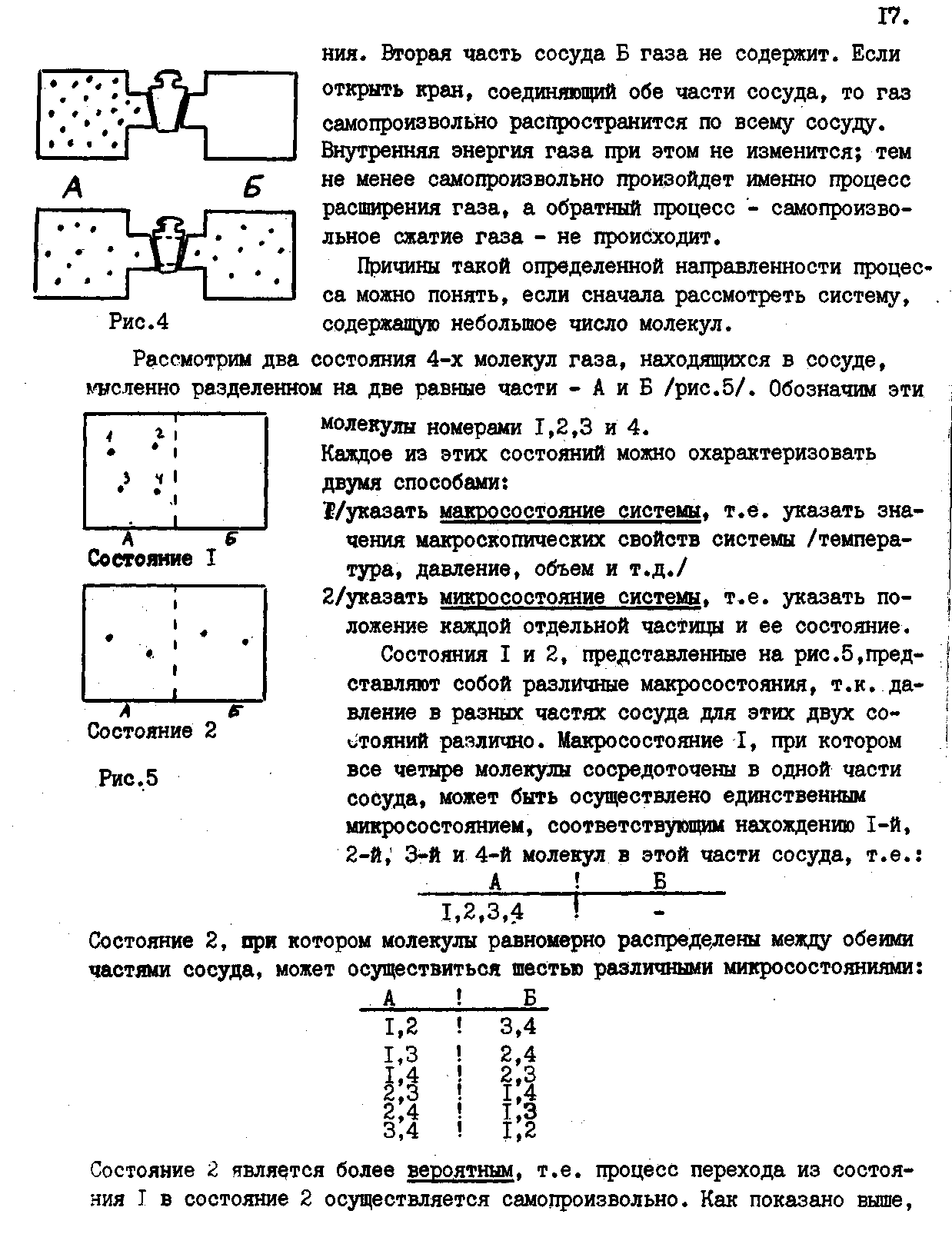
3.Тепловые гФфекти химических и биохимических дищшшцм процессов.
Расчеты тепловых эффектов различных процессов могут быть осуществлены с помощью первого закона /начала./ термодинамики, который является частным случаем закона сохранения энергии .применительно к процессам, связанным с переходом энергии в системах в форме теплоты и работы.
Первый закон термодинамики является постулатом; он не может быть по существу доказан логическим путем, а вытекает из суммы всего человеческого опыта. Справедливость этого закона доказывается тем, что ни одно из следствий, к которым он приводит, не находится в противоречии с опытом.
В установлении современной формы выражения первого закона термодинамики большую роль сыграли работы Г.И.Гесса /1840/, Р.Майера /1842/, Джоуля /1847/, Гельмгольца/1847/ и др. Кстати, и русский ученый Герман Иванович Гесс, и немецкий исследователь Роберт Майер по образованию были медиками.
Можно дать несколько формулировок первого закона, которые по существу равноценны одна другой. Большое значение имеет следующая формулировка первого закона термодинамики.
Изменение внутренней энергии системы при переходе ее из одного состояния /I/ в другое /2/ равно теплоте полученной системой извне, за вычетом работы /А/, совершенной системой:
/I/
Это соотношение следует рассматривать как математическое выражение I закона термодинамики. Все величины в этом выражении, разумеется, должны быть выражены в одинаковых единицах измерения. Теплоте, выделяемой системой, и теплоте, поглощаемой ею, всегда приписывают противоположные знаки. В термодинамике принято считать положительной теплоту 4? > поглощаемую системой в данном процессе, и отрицательной - теплоту, выделяемую системой. Работа А считается положительной, если она совершается системой над окружающей средой; если же работа совершается над системой, ей приписывают отрицательный знак.
Выражение /I/ можно преобразовать и представить его.в таком виде:
/г/
Это выражение означает, что если к системе подводится теплота, то в общем случае она расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил.
В
ходе
химических
реакций,
протекающих
в
открытых
сосудах,
и
биохимических
процессов
в
живых
организмах
весьма
часто
происходит
изменение
объема
вследствие
выделения
газообразных
веществ.
Поэтому
неизбежно
со-


















27.
тываем влияния температуры на величины дН и А$>. Тем не менее, полученные данные позволяют сделать правильные выводы о том, что рассматриваемая реакция при стандартной температуре не может самопроизвольно протекать в указанном нап$влении /iMrgggX)/ и, следовательно, при этой температуре возможно самопроизвольное протекание реакции в обратной направлении /образование СаСОз из СаО и COg/, а при Т=1560°К реакция в указанном направлении протекает самопроизвольно /aG^qqKO/.
Если концентрации реагирующих веществ отличаются от стандартных, то энергия Гиббса реакции также шш не равна стандартной энергии Гиббса. Однако, при этом следует иметь в виду, что при резко выраженных отрицательных значениях ДСгппа химической реакции взаимодействие протекает самопроизвольно практически при любых концентрациях веществ. И наоборот, если д#Ядо»0, то7 самопроизвольное течение процесса неосуществимо и при концентрациях, отличных от стандартных.
В тех же случаях, когда величины ЛЈ§gg для реакций невелики по абсолютной величине., изменение концентраций участвующих в реакции веществ может изменить даже знак A^t- по сравнению с A^ggg» и поэтому в этих случаях судить о направлении реакции по величинам стандартных энергий Гиббса можно только тогда, когда концентрации близки к стандартным.
В
заключение
этого
раздела
необходимо
отметить,
что.
отрицательное
значение
энергии
Гиббса
химичекой
реакции
указывает
только
на
принципиальную
возможность
ее
протекания.
В
действительности,
реакция
при
этом
нередко
и
не
наблюдается.
Это
связано
с
тем,что
величина
Aug^совершенно
не
зависит
от
механизма
химической
реакции,
которым
определяется
скорость
реакции
/изучением
механизмов
и
скоростей
химических
реакций
занимается
другой
раздел
химии
- химическая
кинетика/.
Механизмы
многих
реакций
таковы,
что
скорости
этих
реакций
при
обычных
условиях
шишшшшвюшпшшш
Шицгг".....
практически
равны
нулю,
ж
реакции
не
протекают,
несмотря
на
отрицательное
значение
4<?у
Например,
процессы
окисления
глюкозы
и
многих
других
органических
веществ
кислородом
воздуха
характеризуются
отрицательными
значениями
энергии
Гиббса,
однако
эти
вещества
сохраняются
на
воздухе
в
течение
длительного
времени
без
всяких
признаков
изменений.
В этом проявляется ограниченность термодинамики, которая позволяет нам лишь получать сведения о возможности протекания данной реакции в данном направлении, но ничего не утверждает относительно скорости реакции. Чтобы какая-нибудь реакция началась, сначала надо тем или иным способом снабдить молекулы реагентов некоторой избыточной энергией, чтобы они могли преодолеть энергетический барьер, или попытаться снизить этот барьер путем введения катализаторов. Все это является предметом изучения химической кинетики.







35.
азота, кислорода, серы и т.д. так же хорош, как любой другой eitom того же элемента. Что же достигается их обменом, что составляет то драгоценное нечто, содержащееся в нашей пище и предохраняющее нас от смерти /равновесия/ ? На это легко ответить. Каждый процесс, явление, событие, короче говоря, все, что происходит в Природе, означает увеличение энтропии в той части Вселенной, где это имеет место. Так и живой организм непрерывно увеличивает свою энтропию, или, иначе, производит - положительную энтропию и, таким образом, приближается к опасному состоянию максимальной энтропии, представляющему собой смерть. Он может избежать этого состояния, т.е. оставаться живым, только постоянно извлекая из окружающей среды "отрицательную" энтропию. Отрицательная энтропия - это то, чем организм питается. В самом деле, организм усваивает высокоупо-рядоченные продукты, обладающие малой энтропией /белки, жиры, углеводы и другие высокомолекулярные соединения/. Выделяет же организм в окружающую среду продукты распада и окисления высокомолекулярных соединений /воду, углекислый газ, мочевину и др./, т.е. низкомолекулярные вещества, обладающие в совокупности значительно большей энтропией, чем суммарная энтропия поступивших в организм высокомолекулярных соединений.
Таким образом, существенно в метаболизме то, что организму удается освобождаться от всей той энтропии, которую он производит, пока жив. В результате, организм поддерживает себя на постоянном и достаточно низком уровне энтропии.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Т.М.Х.Карапетьянц. Введение в теорию химических процессов, М.,"Высшая школа", 1975.
2.С.А.Балезин, Ь.В.Ерофеев, Н.И.Подобаев. Основы физической и коллоидной химии, М./'Просвещение", 1975.
3.В.В.Кузнецов, В.Ф.Усть-Качкинцев. Физическая и коллоидная химия, М., "Высшая школа", 1976.
4.Р.4анг. Физическая химия с приложениями к биологическим системам, М., "Мир", 1980.
5.Э.Шредингер. Что такое жизнь /с точки зрения физика/, М.,"Атомиздат", 1972.
6.К.А.Макаров. Химия и медицина, М.,"Просвещение", 1981.
