
Научные стремления 2012-1
.pdf




Указанные полисахариды B. bifidum BIM B-465-D отличаются по своей структуре от полисахаридов, типичных для клеток B. bifidum 791 (а также
B. longum B379M и B. adolescentis 94 BIM), и являющихся антигенами,
индуцирующими выработку тестируемых ПАТ.
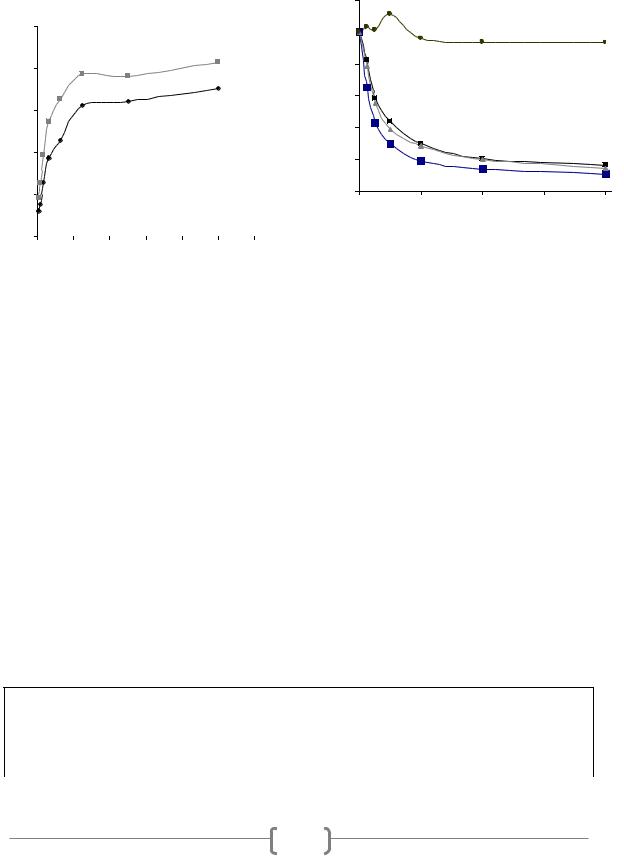
Выводы. ПАТ к антигенам целых клеток B. bifidum 791 имеют рабочий титр в диапазоне 1/80 000 – 1/640 000, и проявляют высокую перекрестную реакцию с антигенами B. adolescentis 94 BIM, B. longum B379M, равную 57,14 % и 66,67 %, соответственно.
Литературные источники
1.Получение, характеристика, перспективы использования поликлональных антитител кроликов к антигенам бифидобактерий / Е.П. Киселева [и др.] // Современные проблемы инфекционной патологии человека: сб. науч. тр. – Минск, 2011. – Вып. 3. – С.
644–649.
2.Тест-система для количественного определения клеток бифидобактерий в культуральных средах для технологий производства биодобавок пробиотического действия
/Е.П. Киселева [и др.] // Белорусские лекарства: материалы Междунар. науч.-практ. конф., Минск, 2-3 ноября 2010 г. – Минск, 2010. – С. 90–92.
3.Structure of the cell wall polysaccharides of probiotic bifidobacteria Bifidobacterium bifidum BIM B-465 / E. L. Zdorovenko [et al.] // Carbohydrate Res. – 2009. – No. 344. – Р. 2417–2420.
Starovoitova T.A1, Kiseleva E.P2, Sidorenko A.V1, Novik G.I1
THE MAJOR CHARACTERISTICS OF POLYCLONAL RABBIT ANTIBODIES TO ANTIGENS OF WHOLE CELLS OF BIFIDOBACTERIUM BIFIDUM 791
1Institute of microbiology, National Academy of Sciences, Minsk 2Institute of Bioorganic Chemistry, National Academy of Sciences, Minsk
Summary
The titre of polyclonal antibodies (PAb) obtained by immunization of rabbits with whole cells of Bifidobacteria bifidum 791 was selected. A competitive ELISA of PAb was conducted using other species and strains of the genus Bifidobacterium. It was found that PAb had high cross-reaction to the antigens of B. adolescentis 94 BIM (57,4 %), B. longum B379M (66,7 %) and no cross-reaction to the antigens of B. bifidum BIM B-465-D (<1 %).
286




