
Научные стремления 2012-1
.pdf
Литературные источники
1.Тихомиров А. А., Шарупич В. П., Лисовский Г. М. Светокультура растений: биофизические и технологические основы. Новосибирск. 2000. 213 с.
2.Zukausskas A., Shur M.S., Gaska R.. Introduction to solid-state lighting. NewYork, 2002. 207 p.
3.Бахарев И., Прокофьев А., Туркин А., Яковлев А. // Современные технологии автоматизации. 2010. №2. С.76-82
4.Stutte G. W. // Hortscience. 2009. V. 44(2). P 231-234
5.Мороз Д.С. // Ботаника (исследования): Сборник научных трудов.. 2010. Т. 39. С.
361-375.
6.Мороз Д.С., Цвирко В.И. // Материалы секционных заседаний. Молодежный инновационный форум «ИНТРИ» – 2010. Минск: ГУ «БелИСА», 2010. С.175-176.
7.Телюк Н.А., Реуцкий В.Г, Родионов П.А. // Весцi НАН Беларусi. Сер. бiял. навук. 1996. №4. С.38-42
Moroz D.S.
WATER EXCHANGE OF TOMATO LYCOPERSICON ESCULENTUM MILL. PLANT
ASSIMILATION TISSUE UNDER COMBINED LED LIGHTING
Institute of experimental botany, National Academy of Sciences, Minsk
Summary
This article considers combined LED lighting effect on water exchange of tomato plant assimilation tissue. It was shown, that LED should be distribute inter and on top of plant cenosis for forming plants with higher adaptive potential.
271

УДК 637.146:616.34-008:579.8.017
Пилипчук Т.А., Герасимович А.Д., Новик Г.И.
ВЫДЕЛЕНИЕ НОВЫХ ШТАММОВ БАКТЕРИОФАГОВ
PSEUDOMONAS FLUORESCENS
Институт микробиологии НАН Беларуси, Минск
Введение. В Институте микробиологии НАН Беларуси в настоящее время успешно функционирует Белорусская коллекция непатогенных микроорганизмов, в которой депонированы штаммы различных таксономических групп. Данная коллекция внесена в Государственный реестр научных объектов, составляющих национальное достояние Беларуси. Одной из первостепенных задач коллекции является долговременное хранение культур в жизнеспособном состоянии с обеспечением их генетической стабильности и сохранением ценных свойств для дальнейшего использования
впромышленности, сельском хозяйстве, медицине, и т. д.
Вколлекции непатогенных микроорганизмов поддерживается жизнеспособность свыше 1500 штаммов микроорганизмов различных таксономических групп. Промышленно-ценные штаммы микроорганизмов могут быть использованы для получения ферментов, биологически активных веществ, производства лечебно-профилактических препаратов, заквасок для силосования растительных субстратов, биологических средств защиты растений и животных; для применения в биосенсорных, природоохранных технологиях, получении биотоплива.
Бактерии Pseudomonas fluorescens широко используются в качестве модельных объектов для многочисленных исследований, в частности для изучения формирования биопленок в лабораторных условиях [1]. Однако, вместе с этим, данные микроорганизмы наносят существенный экономический ущерб сельскохозяйственному производству, поражая бобовые, злаковые, овощные, плодовые и др. культуры, снижая урожай до 50 % с одновременным ухудшением качества продукции. Бактерии способны вызывать у растений пятнистости, некрозы, опухоли и гнили [2]. Ценность культур P. fluorescens для Белорусской коллекции непатогенных микроорганизмов заключается в том, что бактерии являются тест-культурами бактериофагов, на основе которых в институте разрабатываются препараты для нужд сельского хозяйства.
Вколлекционном фонде бактериофагов депонированы штаммы вирусов бактерий родов Pseudomonas, Lactococcus и Escherichia. Сохранность фонда культур бактериофагов обеспечивается методами лиофилизации, криоконсервации при -20 и -70 ºС и хранением лизатов в холодильной камере. В коллекции поддерживаются 34 штамма бактериофагов, активных в отношении бактерий P. fluorescens. В 2011 году коллекционный фонд пополнен 10 штаммами бактериофагов, 9 культур депонированы с целью патентной процедуры. Все выделенные штаммы бактериофагов, находящиеся
272

вколлекционном фонде, сохраняют высокий уровнь жизнеспособности как после лиофилизации, так и после низкотемпературной консервации.
Целью работы явилось выделение новых культур бактериофагов для пополнения коллекционного фонда Белорусской коллекции непатогенных микроорганизмов.
Материалы и методы исследования. Индикаторный штамм бактерий P. fluorescens БИМ В-582-Д культивировали в питательном бульоне гидролизата кильки на качалке при температуре 27 °C в течение 12–18 часов. Бактериофаги выделяли из образцов сельскохозяйственных растений с признаками бактериозов. Материал растирали в 30 мл свежей питательной среды и центрифугировали (8000 g в течение 30 мин). Надосадочную жидкость в количестве 20-25 мл переносили в колбы с 25 мл культуры индикаторного штамма, находящегося в логарифмической стадии роста. Смесь инкубировали 18-24 часов при 28 °С на качалке, после чего центрифугировали и надосадочную жидкость анализировали на наличие бактериофагов методом агаровых слоев.
Для приготовления лизатов использовали питательный бульон гидролизата кильки. В колбу с 50 мл свежей стерильной среды культивирования вносили 2-5 мл ночной культуры и инкубировали на качалке
втечение 1-3 часов для получения культуры в логарифмической стадии роста. Далее бактерии заражали бактериофагом с множественностью инфекции 1:10. Через 1,5-2 часа после наступления лизиса, лизат центрифугировали в течении 30 минут при 6000 g для удаления остатков бактерий.
Криоконсервация. Фаголизат переносили по 1,5 мл в стерильные
криопробирки и выдерживали на ледяной бане при 4 С в течение 15-20 мин. Фаговые частицы замораживали до температур -20 С, -70 С. В качестве криопротекторов использовали: 10 %-ный глицерол [3].
Лиофилизация. Фаговые лизаты смешивали с обезжиренным молоком так, чтобы конечная концентрация протектора составляла 10 %, и вносили в ампулы в количестве 200 мкл. Лиофилизацию осуществляли в установке для сублимационного высушивания Modulyo 4K («Edwards») в 2 этапа. На 1 этапе лиофилизацию проводили в течение 5 часов при температуре рефрижератора - 55 С и глубине вакуума 8 10-2 mbar. Удаление остаточной влаги осуществляли при комнатной температуре и глубине вакуума 8 10-2 mbar в течение 2 часов, после чего ампулы запаивали в пламени газовой горелки. Лиофилизированные культуры хранили при 4 С в холодильнике [1,3].
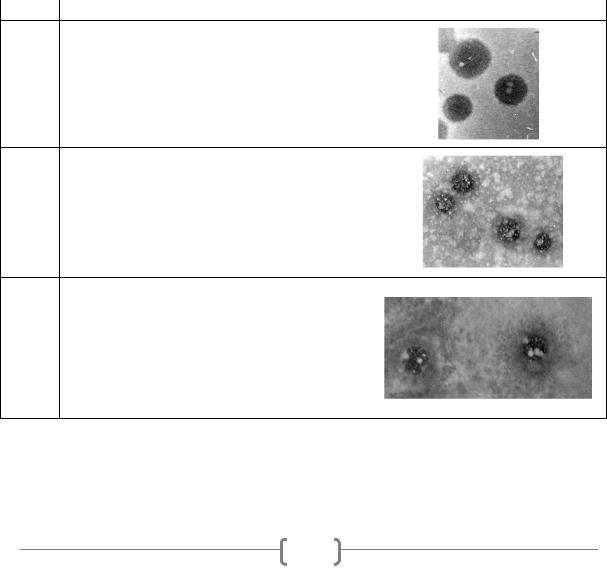
Результаты. Материалом для выделения бактериофагов, активных в отношении бактерий Pseudomonas fluorescens, послужили образцы растений сельскохозяйственных культур, имеющие признаки бактериального поражения. Фаги были обнаружены в плодах груши (Витебская область) и плодах яблок (Минская область). Выделенные бактериофаги были условно обозначены Pf5, Pf6, Pf7 (таблица 1).
Таблица 1 – Источники выделения фагов P. fluorescens.
273
Бактериофаги |
Источники выделения фагов |
|
Регион произрастания |
|
Pf5 |
груши, |
имеющие |
признаки |
Витебская обл. |
бактериального поражения |
|
|||
|
|
|
||
Pf6 |
яблоки, |
имеющие |
признаки |
Минская обл. |
бактериального поражения |
|
|||
|
|
|
||
Pf7 |
яблоки, |
имеющие |
признаки |
Минская обл. |
бактериального поражения |
|
|||
|
|
|
||
При изучении популяции, формируемых фагами на газоне индикаторной культуры, были обнаружены негативные колонии, отличающиеся друг от друга по морфологии, т.е. степени прозрачности и наличию ореола (таблица 2). Колонии, образуемые бактериофагом Pf5, были 5-7 мм в диаметре, характеризовались четко очерченным краем и отсутствием ореола. Середина бляшек была прозрачной, присутствовали признаки вторичного роста. Стерильные пятна, образуемые бактериофагом Pf6, характеризовались четко очерченным краем со слабо выраженным ореолом. Диаметр негативных колоний составлял 4-6 мм. Образуемые фагом Pf7 колонии, составили 4-6 мм в диаметре, характеризовались четко очерченным краем с хорошо выраженным ореолом. Середина бляшек фагов Pf6 и Pf7, также как и в предыдущем случае, была прозрачной с признаками вторичного роста.
|
Таблица 2 – Морфология негативных колоний бактериофагов |
Фаги |
Особенности морфологии негативных колоний |
крупные (5-7 мм), прозрачные, с Pf5 признаками вторичного роста, четко
очерченный край, без ореола
крупные (4-6 мм), прозрачные с четко очерченным краем, с признаками
Pf6 вторичного роста, со слабо выраженным ореолом
крупные (4-6 мм), с четко очерченным Pf7 краем, с признаками вторичного роста, с
хорошо выраженным ореолом вокруг колонии
Полученные бактериофаги помещены в коллекционный фонд, заморожены и лиофилизированы с целью их дальнейшего исследования.
274

Заключение. Из образцов плодовых культур, имеющих признаки бактериального поражения, выделено 3 бактериофага, активных в отношении бактерий P. fluorescens. Охарактеризованы их морфологические свойства. Полученные бактериофаги помещены в коллекционный фонд, заморожены и лиофилизированы с целью их дальнейшего исследования.
Литературные источники
1.Simões M. Monitoring the effects of biocide treatment of Pseudomonas fluorescens formed under different flow regimes / M. Simões, M. Pereira, M.J. Vieira // Water Sci. and
Technol. – 2003. – Vol. 47. № 5. – P. 217-223.
2.Микроорганизмы – паразиты растений / Дьяков Ю. Т. [и др.] // Фундаментальная фитопатология– Под ред. Дьяков Ю. Т. – URSS (Красанд): Москва, 2012. – С. 22-58.
3.Allison G.E. Phage resistance mechanisms in lactic acid bacteria / G.E. Allison, T.R. Klaenhammer // International Dairy Journal. – 1998. – № 8. – P. 207-226.
Pilipchuk T.A., Herasimovich A.D., Novik G. I.
ISOLATION OF NEW STRAINS OF BACTERIOPHAGES OF PSEUDOMONAS FLUORESCENS
Institute of Microbiology, National Academy of Sciences, Minsk
Summary
The article is devoted to isolation of bacteriophages of Pseudomonas fluorescens. Three phages were isolated from fruit samples in various regions of Belarus. Morphological properties of bacteriophage clear plaques were characterized. Isolated phages were freezed and freeze-dried for further investigation.
275

УДК 579.222
Семенчукова Е.А., Денисенко В.В., Найденко И.А.
ЧУВСТВИТЕЛЬНОСТЬ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ К ЭРИТРОМИЦИНУ
Институт микробиологии НАН Беларуси, Минск
Широкое использование антибиотиков в медицине, ветеринарии, сельском хозяйстве, пищевой промышленности привело к распространению антибиотикорезистентности среди микроорганизмов.
Накоплено большое количество данных об антибиотикорезистености |
|
патогенных микроорганизмов, в последнее время активно |
развиваются |
исследования, касающиеся устойчивости к антибиотическим |
соединениям |
представителей симбиотической микрофлоры, в первую очередь |
|
молочнокислых бактерий.
Антимикробные препараты группы макролидов — одни из самых высокоэффективных и наиболее безопасных антибиотиков, что обусловливает их широкое использование. В связи с этим важным является изучение антибиотикорезистентности практически ценных культур молочнокислых бактерий к представителям этой группы антибиотиков.
Исследовали чувствительность к эритромицину 25 штаммов молочнокислых бактерий рр. Lactobacillus, Lactococcus, Leuconostoc,
выделенных из разных природных источников и хранящихся в коллекции лаборатории молочнокислых и бифидобактерий Института микробиологии НАН Беларуси.
Молочнокислые бактерии поддерживали на слабо агаризованной среде
MRS [1]. Культивирование микроорганизмов осуществляли при |
|
37°C на |
||||
средах разного состава в зависимости от целей эксперимента. В |
качестве |
|||||
посевного |
материала использовали 18-часовые |
физиологически |
|
активные |
||
(инокулят |
III |
генерации) |
культуры |
бактерий. |
Основные |
|
физиолого-биохимические характеристики исследуемых культур определяли с использованием общепринятых методов. Оптическую плотность бактериальных суспензий измеряли турбидиметрически. Количество жизнеспособных клеток бактерий в 1 мл суспензии (число колониеобразующих единиц) определяли методом предельных разведений при высеве на слабо агаризованные питательные среды. Активность кислотообразования определяли титрометрическим и потенциометрическим
методами. |
|
|
|
|
Определение |
чувствительности |
молочнокислых |
бактерий |
к |
эритромицину проводили с помощью стандартного метода серийных двукратных разведений в жидкой питательной среде [2].
На начальном этапе исследований провели первичный скрининг чувствительности штаммов к антибиотику. Установлено, что большинство исследуемых культур (64%) были в той или иной степени чувствительны к эритромицину. Антибиотик подавлял рост бактерий видов
276
Leuconostoc mesenteroides, Lactococcus lactis, Lactobacillus acidophilus, Lactobacillus brevis. Устойчивые штаммы были обнаружены среди наиболее
многочисленной в |
нашем исследовании группы лактобацилл видов |
L. plantarum, L. paraplantarum, L. rhamnosus, L. paracasei и L. casei. |
|
Установленная |
нами низкая устойчивость большинства исследуемых |
штаммов к эритромицину согласуется с известными литературными данными о высокой чувствительности молочнокислых бактерий ко всем ингибиторам белкового синтеза, за исключением аминогликозидных антибиотиков [3, 4, 5].
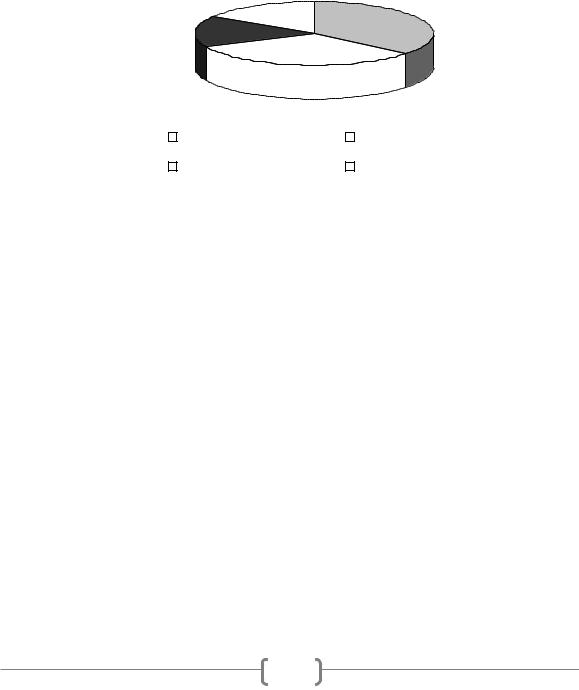
На основе данных, полученных в результате первичного скрининга штаммов, проводили определение минимальной ингибирующей концентрации (МИК) антибиотика. Полученные результаты позволили дифференцировать исследуемые бактерии на высокочувствительные, чувствительные, устойчивые и высокоустойчивые к действию эритромицина штаммы (рисунок).
16%
36%
16%
32% |
|
|
|
Высокоустойчивые |
Чувствительные |
|
||
|
||
|
Высокочувствительные |
Устойчивые |
|
||
|
||
Рисунок. Распределение штаммов МКБ по степени устойчивости к эритромицину
Наблюдаемый в нашем исследовании разброс значений МИК эритромицина для молочнокислых бактерий согласуется с данными, полученными другими авторами [5, 6].
Установлено, что наибольшие значения МИК эритромицина были характерны для некоторых представителей вида L. plantarum. Для бактерий L. paracasei и L. casei была характерна невысокая чувствительность к антибиотику, представители других таксономических групп были высокочувствительными (МИК эритромицина менее 1 мг/л).
Молочнокислые бактерии обладают бродильным типом метаболизма и характеризуются отсутствием цитохромсодержащих дыхательных систем [7]. В связи с этим исследовали влияние присутствия антиоксиданта (аскорбиновая кислота) в среде культивирования на чувствительность изучаемых штаммов к эритромицину. Выявлено, что при культивировании в присутствии аскорбиновой кислоты устойчивость к эритромицину увеличилась у трех из 25-ти исследуемых культур.
Установлено, что один из штаммов вида L. casei в опытном варианте был более устойчив к эритромицину, чем в процессе роста на среде, не содержащей аскорбиновую кислоту.
277

Значения МИК эритромицина в присутствии антиоксиданта по сравнению с контролем увеличились в два раза для восьми культур (пяти штаммов L. plantarum, двух штаммов L. paracasei и одного штамма L. casei) и
в4 раза для одной культуры (L. casei) после 24 часов культивирования.
Уодного штамма L. rhamnosus, в отличие от остальных культур, чувствительность к эритромицину повышалась в присутствии аскорбиновой кислоты: значение МИК снизилось в два раза.
В отношении 14 штаммов значения МИК эритромицина в контрольном и опытном вариантах не отличались на протяжении всего периода культивирования.
Таким образом, в нашем исследовании содержание антиоксиданта в среде культивирования наибольшее влияние оказало на лактобациллы видов
L. plantarum, L. paracasei и L. casei, у которых чувствительность к эритромицину в присутствии аскорбиновой кислоты снизилась в 2-4 раза.
В доступной литературе сведения о влиянии антиоксидантов на антибиотикочувствительность молочнокислых бактерий отсутствуют.
Полученные данные об устойчивости исследуемых культур к эритромицину будут учтены при подборе штаммов молочнокислых бактерий для препаратов разного назначения.
Литературные источники
1.Man de, J.D. A medium for the cultivation of lactobacilli / J.D. de Man, M. Rogosa, M.E. Sharpe // J Appl Bact. – 1960. – Vol. 23, № 1. – P. 130–135.
2.Методические указания. Определение чувствительности микроорганизмов к антибактериальным препаратам: МУК 4.2.1890-04. – Введ. 04.03.2004. – Клин микробиол антимикроб химиотер. – 2004. – Т. 1, № 1. – С. 40–50.
3.Antibiotic susceptibility of Lactobacillus rhamnosus strains isolated from Parmigiano Reggiano cheese / R. Coppola [et al.] // Lait. – 2005. – Vol. 85, № 3. – P. 193–204.
4.Antimicrobial susceptibilities of Lactobacillus, Pediococcus and Lactococcus human isolates and cultures intended for probiotic or nutritional use / I. Klare [et al.] // J. Antimicrob Chemother. – 2007. – Vol. 59, № 5. – P. 900–912.
5. Danielsen, M. Susceptibility of Lactobacillus spp. to antimicrobial agents /
M.Danielsen, A. Wind // Int J. Food Microbiol. – 2003. – Vol. 82, № 1. – P. 1–11.
6.Antimicrobial susceptibilities of Lactobacillus, Pediococcus and Lactococcus human isolates and cultures intended for probiotic or nutritional use / I. Klare [et al.] // J. Antimicrob Chemother. – 2007. – Vol. 59, № 5. – P. 900–912.
7. Квасников, Е.И. Общая характеристика молочнокислых бактерий / Е.И. Квасников, О.А. Нестеренко // Молочнокислые бактерии и пути их использования / Е.И. Квасников, О.А. Нестеренко. – М., 1975. – Гл. 1. – С. 6–58.
Semenchukova K.A., Denisenko V.V., Naidenko I.A.
ERYTHROMYCIN SUSCEPTIBILITY OF LACTIC ACID BACTERIA
Institute of Microbiology, National Academy of Sciences, Minsk
Summary
Erythromycin susceptibility of 25 strains of lactic acid bacteria from genera Lactobacillus, Lactococcus, Leuconostoc isolated from diverse natural sources was studied. It was found that most tested cultures (64%) turned out to be susceptible to erythromycin. Antibiotic resistance was typical for some representatives of Lactobacillus plantarum species. The majority of lactic acid bacteria from other taxonomic groups were hypersensitive to erythromycin.
278


