
- •1. Розрахунок основних параметрів хіміко-технологічного процесу
- •1.1. Основні закони хімічної технології, поняття і визначення
- •1 Моль 1 моль 1моль.
- •1 Моль 1 моль 1моль;
- •2 Моль 1 моль 1моль.
- •1.2. Закономірності газоподібних речовин
- •1.3. Визначення складу реакційних сумішей. Розрахунок молекулярної маси суміші
- •1.4. Способи виразу концентрації речовин. Змішування реагентів
- •1.5. Швидкість хімічної реакції. Розрахунок константи рівноваги
- •72 Кмоль : 36 кмоль : 72 кмоль
- •2Кмоль : 1 кмоль : 2кмоль
- •1.6. Рівновага в хімічній технології
- •1.7. Розрахунок об'єму продуктів згоряння газу. Коефіцієнт надлишку повітря
- •Склад повітря
- •2. Матеріальний баланс в хімічному виробництві
- •2.1. Розрахунок матеріального балансу хіміко-технологічного процесу
- •70 Кмоль (so2) – 1
- •68,6 Кмоль : 34,3 кмоль : 68,6 кмоль
- •2 Кмоль : 1 кмоль : 2 кмоль.
- •2.2. Розрахунок матеріального балансу процесів згоряння суміші газів
- •2.3. Складання матеріального балансу хіміко-технологічного процесу з заданої продуктивності апарата по цільовим продуктом
- •500 Кмоль : 250 кмоль : 500 кмоль
- •2 Кмоль : 1 кмоль : 2кмоль.
- •15,873 Кмоль : 31,746 кмоль 15,873 кмоль : 15,873 кмоль
- •2.4. Розрахунок матеріального балансу хіміко-технологічного процесу, що відбувається при змішуванні двох потоків
- •Матеріальний баланс процесу окиснення амоніаку для I потоку
- •Список літератури
1.7. Розрахунок об'єму продуктів згоряння газу. Коефіцієнт надлишку повітря
Згоряння газу (або його окиснення) – це процес взаємодії елементів газової суміші з киснем. Реакції горіння для суміші газів записують покомпонентно. До кожної речовини, яка може окиснюватися, додають кисень. При цьому важливо враховувати, що кисень не реагує з такими речовинами:
– сполуками у вищому ступені окиснення (СО2, Н2О, SO3);
– азотом і його оксидами за звичайних умов.
Стехіометрично розрахована кількість кисню за рівняннями реакції – це теоретично необхідна для згоряння кількість кисню. Через те, що процес окиснення в багатьох реакціях здійснюється киснем повітря, можна визначити теоретично необхідну кількість повітря, для згоряння. При цьому вважається, що повітря – це природна газова суміш, склад якої для технічних розрахунків наведено нижче (табл. 2.).
Таблиця 2
Склад повітря
|
Компонент повітря |
Мольна (об’ємна) частка (ni, i) |
Масова частка (gi) |
|
Оксиген |
0,21 |
0,23 |
|
Гідроген |
0,79 |
0,77 |
Коефіцієнт надлишку повітря характеризує відношення повітря, що практично подається на процес окиснення, до теоретично необхідного, згідно з рівнянням реакції.
Приклад 15. Розрахувати, який об'єм повітря буде потрібно для спалювання 1м3 технічного водяного газу наступного об'ємного складу: 50% Н2, 40%СО, 5% СО2, 5%N2. Визначити об’єм продуктів згорання.
Рішення. У відповідності до рівняння (11) знайдемо об’єм кожної складової технічного газу:
V(Н2) = 0,5 м3; V(СО) = 0,4 м3; V(СО2) = 0,05 м3; V(N2) = 0,05 м3.
Запишемо реакції горіння заданого газу (див. вище):
2Н2 + О2 = 2Н2О;
2СО + О2 = 2СО2.
Оскільки всі сполуки знаходяться у газовій фазі, з рівняння (8) можна розрахувати кількість водню і окису вуглецю для подальшого визначення кількості кисню. Також об’єм та кількість кисню розраховують безпосередньо за відомими об’ємами Н2 і СО, що витікає із закону Авогадро:
0,5 м3 0,25 м3 0,5м3 0,4 м3 0,2 м3 0,4 м3
2Н2 + О2 = 2Н2О 2СО + О2 = 2СО2
2 моль 1 моль 2моль 2 моль 1 моль 2 моль.
Визначимо витрачений об'єм кисню з обох рівнянь:
V(О2)теор = 0,5 2 + 0,4 2 = 0,45 м3.
Знайдений об’єм кисню складає 21% від об’єму повітря, яке подається на процес спалювання (див. табл.2.). Розрахуємо об’єм повітря:
V(пов.)= 0,45 0,21 = 2,14 м3.
За вказаними рівняннями окиснення та за умовами прикладу визначимо об'єм продуктів згоряння:
V(Н2О)= 0,5 м3
V(СО2)= 0,4 + 0,05 = 0,45 м3
V(N2)= 0,05 + (2,14 – 0,45) = 1,74 м3.
Відповідь: V(пов.)=2,14 м3; V(Н2О)=0,5 м3; V(СО2)=0,45 м3; V(N2)=1,74 м3.
Приклад 16. Розрахуйте об'єм повітря при його 10% надлишку, який необхідний для спалювання 1 м3 при н.у. технічного водяного газу наступного складу: (СO)= 40%; (Н2)= 50%; (СО2)= 5%; (N2)= 5%. Оформити прибуткову частину матеріального балансу і визначити щільність продуктів згоряння при Т = 3500 С.
Розв’язок. Розрахуємо об'єм, кількість і масу кожної речовини (рівняння 11, 10, 9, відповідно). Результати надамо в табличній формі (табл. 3.).
Таблиця 3
Кількісні параметри речовин (прибуткова частина матеріального балансу)
|
Речовина |
Мi, г/моль |
i, % |
Vi, л |
i, моль |
mi, кг |
gi |
|
Н2 |
2 |
50 |
500 |
22,32 |
44,64 |
0,063 |
|
СО |
28 |
40 |
400 |
17,86 |
500,08 |
0,709 |
|
СО2 |
44 |
5 |
50 |
2,23 |
98,12 |
0,139 |
|
N2 |
28 |
5 |
50 |
2,23 |
62,44 |
0,089 |
|
∑ |
|
100 |
1000 |
44,64 |
705,28 |
1 |
Проаналізуємо стехіометричні співвідношення:
17,86 кмоль : 8,93кмоль : 17,86кмоль 22,32 кмоль : 11,16кмоль : 22,32 кмоль
2СO + O2 = 2СO2; 2Н2 + O2 = 2НO2;
2моль : 1моль : 2моль 2моль : 1моль : 2моль
заг(О2)= 8,93 + 11,16 = 20,09 моль.
З урахуванням 10% надлишку кількість кисню складе:
'(O2)= 20,09 · 1,1 = 22,099 моль.
Склад повітря: (O2 )= 21% – 22,099 моль
(N2) = 79% – кмоль = 83,13 моль
Кількість повітря: (пов.)= 83,13 + 22,099 = 105,23 моль.
Об'єм повітря складе: V(пов.) = (пов.) · 22,4 = 105,23 · 22,4 = 2357 л.
Визначимо склад продуктів згоряння. Мольну частку сполук знайдемо за рівнянням (10).
Таблиця 4
Склад продуктів згоряння
-
Речовина
До реакції,
i моль
Хімічна реакція, i моль
Після реакції,
i моль
ni = I
 СО
СОН2
СО2
N2
N
 2
2О2
Н2О
17,86
22,32
2,23
2,23
83,13
22,099
–
-17,86
-22,32
17,86
–
–
-20,09
22,32
–
–
20,09
85,36
2,009
22,32
–
–
0,155
0,658
0,015
0,172
∑
149,869
129,779
1
Розрахуємо молярну масу продуктів реакції (рівняння 16):
Мсм
=
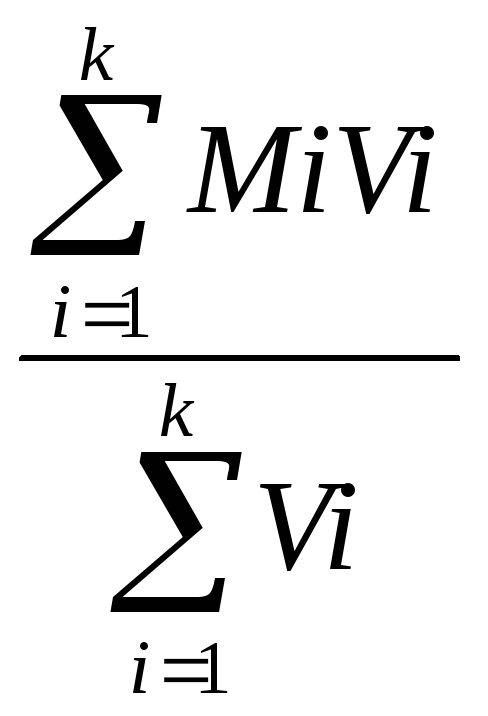 = 44 · 0,155 + 28 · 0,658 + 32 · 0,015 + 18 · 0,172 =
= 44 · 0,155 + 28 · 0,658 + 32 · 0,015 + 18 · 0,172 =
= 6,82 + 18,424 + 0,48 + 3,096 = 28,82 г/моль.
Знайдемо щільність газової суміші (рівняння 13, 17):
н.у.
= Мсм
/ 22,4;
= н.у.
![]()
н.у. = 28,82 / 22,4 = 1,29 г/л
=
н.у.
![]() = 1,29
= 1,29
![]() = 0,56 г/л.
= 0,56 г/л.
Відповідь: 0,56 г/л.
