
- •1. Розрахунок основних параметрів хіміко-технологічного процесу
- •1.1. Основні закони хімічної технології, поняття і визначення
- •1 Моль 1 моль 1моль.
- •1 Моль 1 моль 1моль;
- •2 Моль 1 моль 1моль.
- •1.2. Закономірності газоподібних речовин
- •1.3. Визначення складу реакційних сумішей. Розрахунок молекулярної маси суміші
- •1.4. Способи виразу концентрації речовин. Змішування реагентів
- •1.5. Швидкість хімічної реакції. Розрахунок константи рівноваги
- •72 Кмоль : 36 кмоль : 72 кмоль
- •2Кмоль : 1 кмоль : 2кмоль
- •1.6. Рівновага в хімічній технології
- •1.7. Розрахунок об'єму продуктів згоряння газу. Коефіцієнт надлишку повітря
- •Склад повітря
- •2. Матеріальний баланс в хімічному виробництві
- •2.1. Розрахунок матеріального балансу хіміко-технологічного процесу
- •70 Кмоль (so2) – 1
- •68,6 Кмоль : 34,3 кмоль : 68,6 кмоль
- •2 Кмоль : 1 кмоль : 2 кмоль.
- •2.2. Розрахунок матеріального балансу процесів згоряння суміші газів
- •2.3. Складання матеріального балансу хіміко-технологічного процесу з заданої продуктивності апарата по цільовим продуктом
- •500 Кмоль : 250 кмоль : 500 кмоль
- •2 Кмоль : 1 кмоль : 2кмоль.
- •15,873 Кмоль : 31,746 кмоль 15,873 кмоль : 15,873 кмоль
- •2.4. Розрахунок матеріального балансу хіміко-технологічного процесу, що відбувається при змішуванні двох потоків
- •Матеріальний баланс процесу окиснення амоніаку для I потоку
- •Список літератури
1.5. Швидкість хімічної реакції. Розрахунок константи рівноваги
Наука, яка займається вивченням швидкостей хімічних реакцій, їх протіканням в часі, залежністю швидкості від умов і механізму, називається кінетикою.
Знання швидкостей процесу має велике практичне значення. Діапазони швидкостей хімічних процесів широкі: від десятків років до доль секунди. Дуже важливо регулювати перебіг хімічних реакцій в часі. Наприклад, не можна покласти в основу технологічного процесу затвердіння будматеріалів реакцію, що протікає сотні років, а при горінні палива в двигуні внутрішнього згоряння потрібно добиватися миттєвого здійснення процесу. Небажані реакції (корозію металів при окисненні змащувальних масел, старіння полімерів) необхідно за можливістю уповільнювати. Таким чином, управління швидкістю хімічного процесу, змогло б вирішити багато виробничих і технологічних питань.
Швидкість реакції (r) – це зміна кількості речовини або концентрації (С) в заданому об'ємі в одиницю часу ():
![]() .
.
Швидкість хімічної реакції залежить від:
природи реагуючих речовин;
концентрації речовин;
температури і тиску;
площі поверхні контакту фаз (для гетерогенних реакцій);
наявності каталізатора;
освітлення, радіації, властивостей розчинника і тому подібне.
Природа реагуючих речовин значно впливає на швидкість реакції. Чим міцніші хімічні зв'язки в реагуючих молекулах, тим більша енергія активації і тим повільніше протікає реакція. Цим пояснюються малі швидкості більшості хімічних реакцій за участю водню, кисню, азоту – їх молекули стійкі при кімнатній температурі.
У 1876 р. норвезькі хіміки Гульдберг і Вааге відкрили закон дії мас: при постійній температурі швидкості хімічних реакцій прямо пропорційні концентраціям реагуючих речовин. Для хімічного перетворення A + B = C швидкість реакції можна надати так:
r = k [A] [B], (23)
де k – константа швидкості реакції, що дорівнює швидкості реакції за умови, що концентрації всіх реагентів рівні 1 моль/л. Залежить від природи реагентів, температури і наявності каталізатора;
[A], [B] – молярні концентрації реагуючих речовин А і В.
Багато хімічних процесів відбуваються через декілька проміжних стадій, при цьому стехіометричне рівняння описує тільки остаточний результат процесу. У таких випадках швидкість реакції може не підкорятися закону діючих мас.
Для оборотної реакції aA + bB cC + dD відповідно до рівняння (23) швидкість прямої реакції можна надати як:
r1 = k1 [A]а [B]b
а швидкість зворотної реакції:
r2 = k2 [C]с [D]d.
При рівності швидкостей прямої і зворотної реакції встановлюється хімічна рівновага. На вчення про хімічну рівновагу спирається вся сучасна хімічна технологія через те, що переважна більшість хімічних процесів мають оборотний характер. Відношення констант швидкостей цих реакцій є константою хімічної рівноваги (К). При встановленні рівноваги її можна розрахувати таким чином:
![]() , (24)
, (24)
де КС – константа хімічної рівноваги, виражена через молярні рівноважні концентрації речовин;
[C]с, [D]d, [A]а, [B]b – молярні концентрації речовин-учасників реакції у момент встановлення рівноваги, узяті в ступенях їх стехіометричних коефіцієнтів.
Таким чином, константа рівноваги КС дорівнює частці від ділення добутку рівноважних концентрацій продуктів реакції, узятих в ступенях їх стехіометричних коефіцієнтів, до аналогічного добутку для початкових речовин цієї ж реакції. Значення константи рівноваги залежить тільки від температури і природи реагуючих речовин. Воно не залежить від концентрації речовин, оскільки зміна концентрації одного з учасників реакції викличе такі зміни концентрації решти всіх речовин, що КС збереже своє чисельне значення.
При аналізі реакцій, що протікають в газовій фазі, константу рівноваги виражають через парціальний тиск:
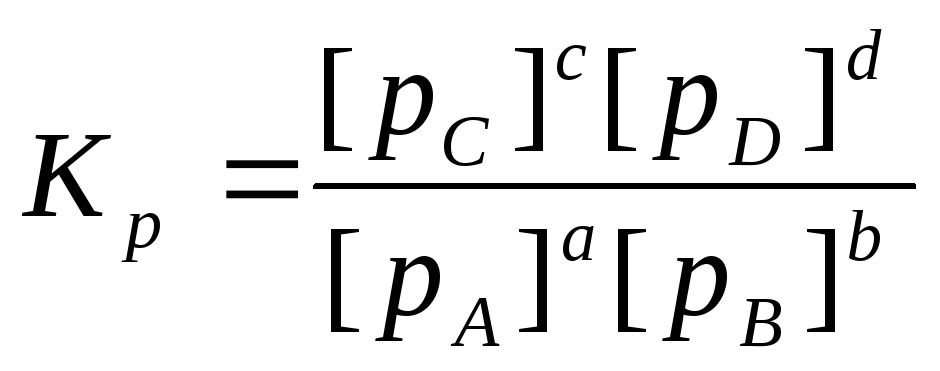 , (25)
, (25)
де Кр – константа хімічної рівноваги, виражена через парціальний рівноважний тиск речовин;
[рC]c,[рD]d, [рA]а,[рB]b – парціальний тиск газоподібних речовин у момент встановлення рівноваги, узятий в ступенях їх стехіометричних коефіцієнтів.
Приклад 13. Окиснення оксиду сульфуру (IV) протікає при тиску 1атм на ванадієвому каталізаторі. Визначити константу рівноваги, якщо витрата суміші склала 1000 кмоль, склад газового потоку: (SO2)= 0,09; (O2)= 0,11; (SO3)= 0,01; (N2)= 0,79. Врахувати ступінь перетворення по оксиду сульфуру (IV) – 0,8.
Розв’язок. Визначимо стехіометричне співвідношення реагентів та їх наявну кількість:
