
- •1. Розрахунок основних параметрів хіміко-технологічного процесу
- •1.1. Основні закони хімічної технології, поняття і визначення
- •1 Моль 1 моль 1моль.
- •1 Моль 1 моль 1моль;
- •2 Моль 1 моль 1моль.
- •1.2. Закономірності газоподібних речовин
- •1.3. Визначення складу реакційних сумішей. Розрахунок молекулярної маси суміші
- •1.4. Способи виразу концентрації речовин. Змішування реагентів
- •1.5. Швидкість хімічної реакції. Розрахунок константи рівноваги
- •72 Кмоль : 36 кмоль : 72 кмоль
- •2Кмоль : 1 кмоль : 2кмоль
- •1.6. Рівновага в хімічній технології
- •1.7. Розрахунок об'єму продуктів згоряння газу. Коефіцієнт надлишку повітря
- •Склад повітря
- •2. Матеріальний баланс в хімічному виробництві
- •2.1. Розрахунок матеріального балансу хіміко-технологічного процесу
- •70 Кмоль (so2) – 1
- •68,6 Кмоль : 34,3 кмоль : 68,6 кмоль
- •2 Кмоль : 1 кмоль : 2 кмоль.
- •2.2. Розрахунок матеріального балансу процесів згоряння суміші газів
- •2.3. Складання матеріального балансу хіміко-технологічного процесу з заданої продуктивності апарата по цільовим продуктом
- •500 Кмоль : 250 кмоль : 500 кмоль
- •2 Кмоль : 1 кмоль : 2кмоль.
- •15,873 Кмоль : 31,746 кмоль 15,873 кмоль : 15,873 кмоль
- •2.4. Розрахунок матеріального балансу хіміко-технологічного процесу, що відбувається при змішуванні двох потоків
- •Матеріальний баланс процесу окиснення амоніаку для I потоку
- •Список літератури
72 Кмоль : 36 кмоль : 72 кмоль
2SO2 + O2 = 2SO3
2Кмоль : 1 кмоль : 2кмоль
Зведемо ці значення та дані умови до табл. 1.
Таблиця 1
Розрахунок рівноважної кількості речовин
|
Речовина |
Початкова суміш |
Хімічна реакція, моль |
Момент рівноваги |
рi, атм | ||
|
i |
νi, моль |
νi, моль |
ni | |||
|
SO2 O2 N2 SO3 |
0,09 0,11 0,79 0,01 |
90 110 790 10 |
90 × 0,8 =72 72 2 = 36 – 72 |
18 74 790 82 |
0,019 0,077 0,820 0,085 |
0,019 0,077 0,820 0,085 |
|
∑ |
1 |
1000 |
|
964 |
1 |
1 |
Для розрахунку константи рівноваги (рівняння 25) знайдемо парціальний тиск речовин (рівняння 19), дані якого зведемо у табл. 1:
Кр.
=
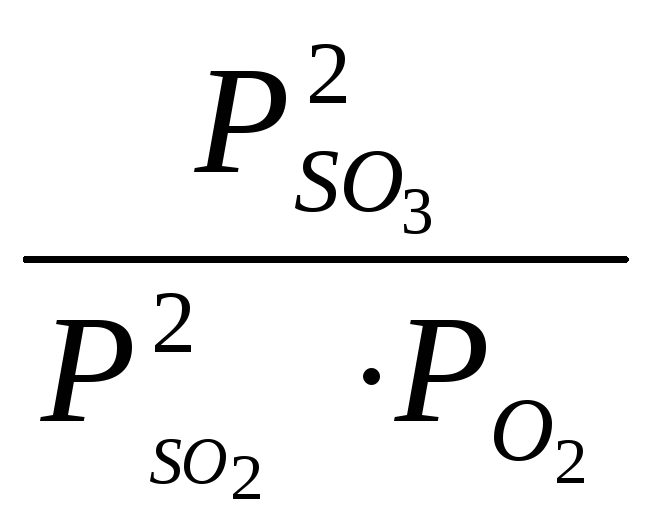 =
=![]() =
260.
=
260.
Відповідь: Кр = 260.
1.6. Рівновага в хімічній технології
Як показано в попередньому розділі, мірою оборотності процесу слугує константа рівноваги – чим вона більша, тим більшою мірою протікає прямий процес. Через те, що оборотна реакція не може протікати повністю до кінця, стан рівноваги зберігається як завгодно довго при постійності зовнішніх умов. На стан хімічної рівноваги впливає концентрація реагуючих речовин, температура і тиск (для газів). При зміні одного з цих параметрів рівновага порушується і концентрації всіх реагуючих речовин змінюється до тих пір, поки не наступить нова рівновага. Зміна зовнішніх умов і характер їх впливу на стан рівноваги можна передбачити на підставі принципу Ле Шательє:
якщо на систему, яка знаходиться в стані рівноваги, діяти ззовні (змінювати концентрації речовин, температуру, а для газів – і тиск), то положення рівноваги зміщується у бік тієї реакції, яка ослабляє зовнішню дію.
Як система реагує на збільшення концентрації речовини? Згідно з розглянутим принципом, вона повинна прагнути зменшити цю концентрацію, тому переважно повинен протікати процес, в якому ця речовина витрачається.
Підвищення тиску повинне викликати переважно перебіг процесу, результатом якого є пониження тиску газу. Останнє пропорційне кількості молей газоподібної речовини (див. рівняння 7) і залежить від кількості цього газу в одиниці об'єму. Тому зміна парціального тиску газу якого-небудь з газоподібних учасників оборотної реакції діє на стан рівноваги так само, як зміна його концентрації.
Підвищення загального тиску в рівноважній системі зміщує положення рівноваги у бік процесу, що зменшує число молей газоподібних речовин. Інакше кажучи, підвищення тиску зміщує рівновагу у бік менших об'ємів. При цьому вважаються об'єми тільки газоподібних речовин!
Зміна тиску не впливає на стан рівноваги реакцій, в ході яких не змінюється число молей газів (не змінюється об'єм газоподібних речовин). Як, наприклад, для реакції N2 + O2 2NO.
Константи швидкості залежать від температури. Будь-яка реакція супроводжується енергетичним (тепловим) ефектом – позитивним (+ Q) або негативним (-Q), тому зміна температури повинна викликати переважання одного з них. Згідно з принципом Ле Шательє, підвищення температури підсилює ендотермічний напрям процесу. Або: при підвищенні температури переважно відбувається процес, сприяючий охолоджуванню системи, положення рівноваги зміщується у бік ендотермічного процесу, і навпаки.
Приклад 14. Проаналізувати умови протікання процесу синтезу амоніаку:
N2 + 3H2 2NH3 + Q.
Розв’язок. За звичайних умов переважає зворотна реакція. Використовуємо принцип Ле Шательє для знаходження умов, при яких рівновага зміститься у бік прямої реакції.
Оскільки реакція протікає зі зменшенням кількості молей газоподібних речовин (зменшенням об'єму), то збільшення тиску змістить рівновагу праворуч або у бік прямої реакції.
Синтез амоніаку – реакція екзотермічна (+ Q), тому змістити рівновагу праворуч можна зменшенням температури.
Вплив концентрації речовин на положення рівноваги в принципі аналогічно для всіх оборотних реакцій: зсув рівноваги у бік продукту реакції відбувається при підвищенні концентрації початкових речовин (у даному прикладі – нітрогену і гідрогену) і зниженні концентрації продуктів реакції (у даному прикладі – відведенні з реакційної зони амоніаку).
Таким чином, сприятливі для протікання прямої реакції умови можна представити так:
P
T
C (N2 ), C (H2 ), C(NH3 ) .
