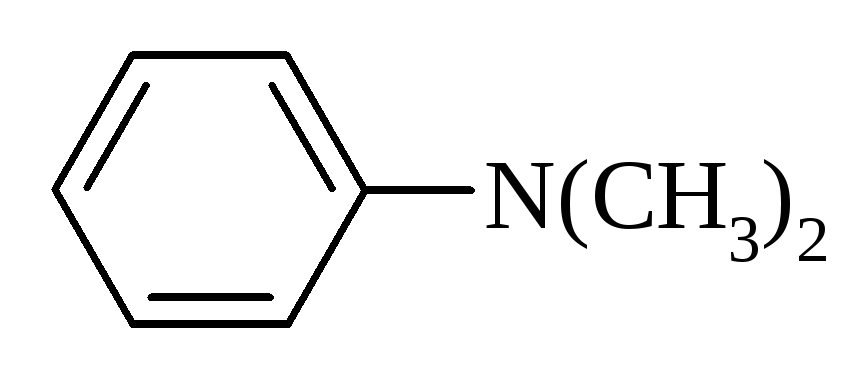
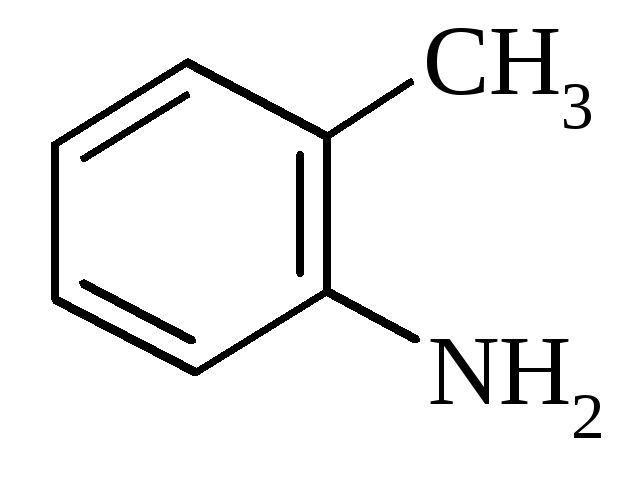
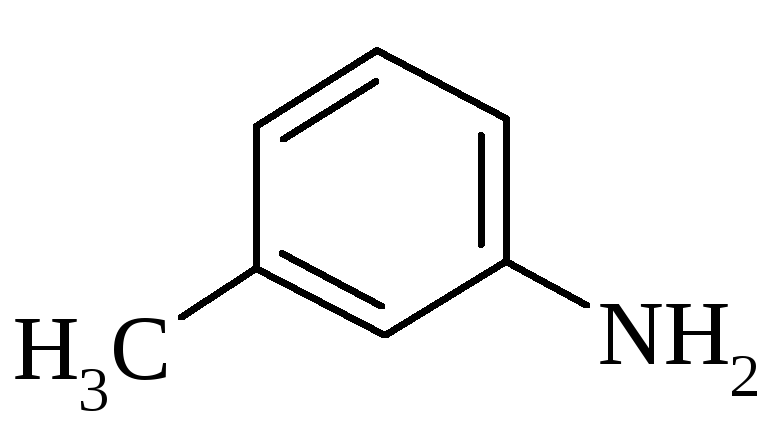
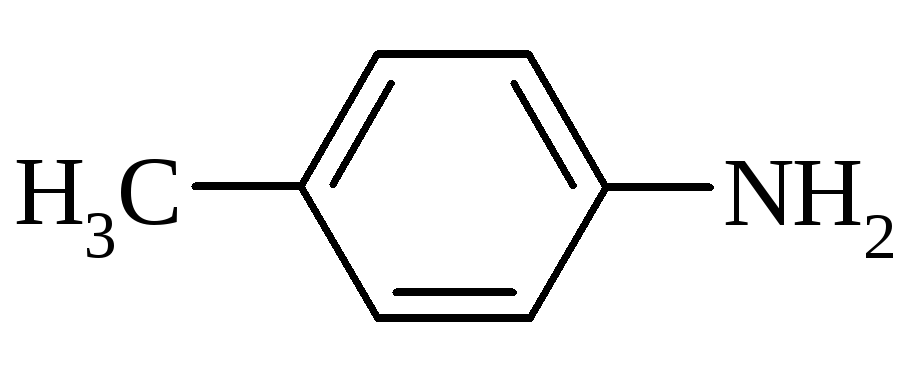
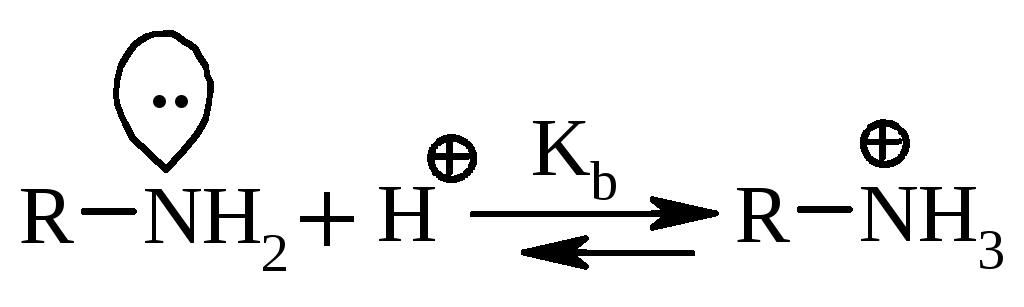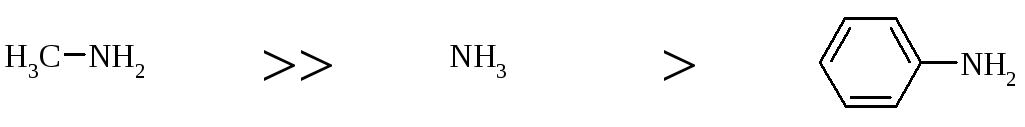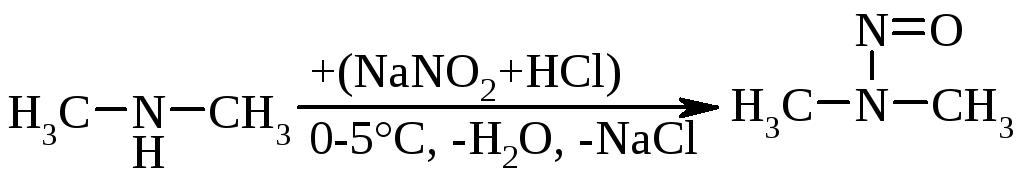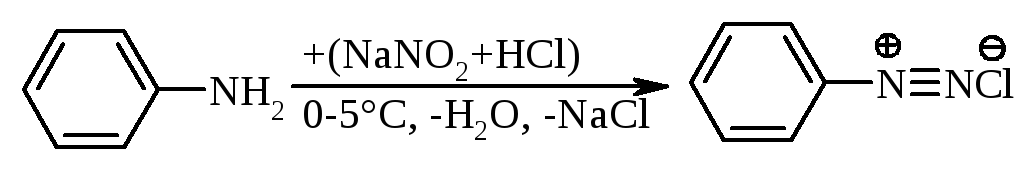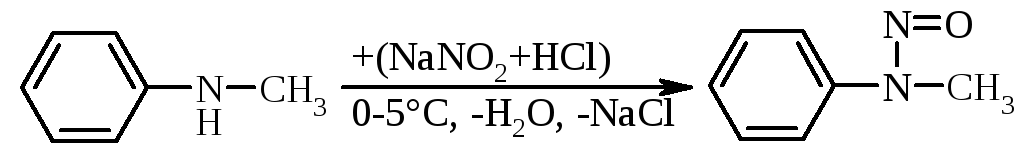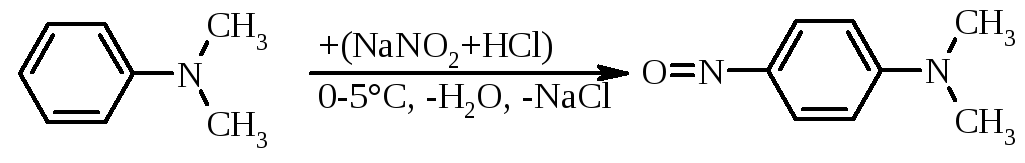3. Будова амінів.
Третинні аліфатичні аміни мають тетраедричну будову. Кут C–N–C, в залежності від замісника R складає 106-108°. При цьому атом нітрогену знаходиться у sp3-гібридному стані.
|
|
|
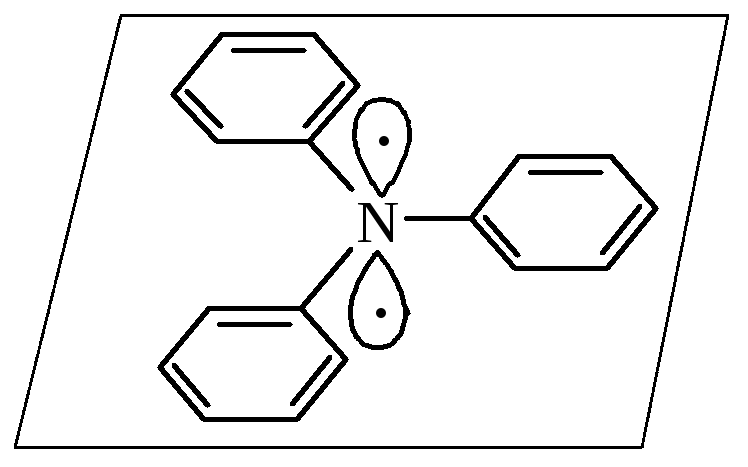
у третинних ариламінів атом нітрогену приближується до sp2-гібридного стану |
Характеристика зв’язків амінів аліфатичного ряду:
|
|
EC–N |
329 кДж/моль |
=1,46 D | |
|
|
EN–H |
431 кДж/моль |
=1,17 D | |
|
|
|
|
=0,86 D | |
|
|
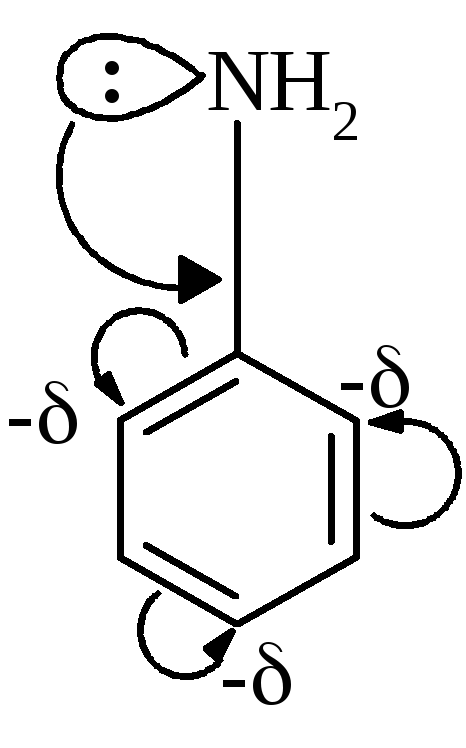
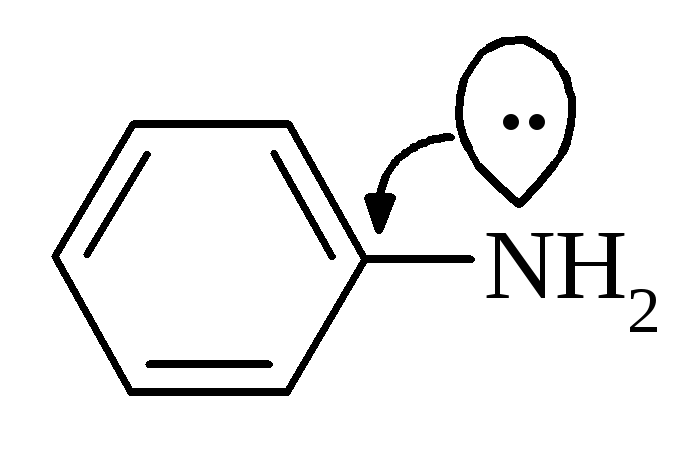
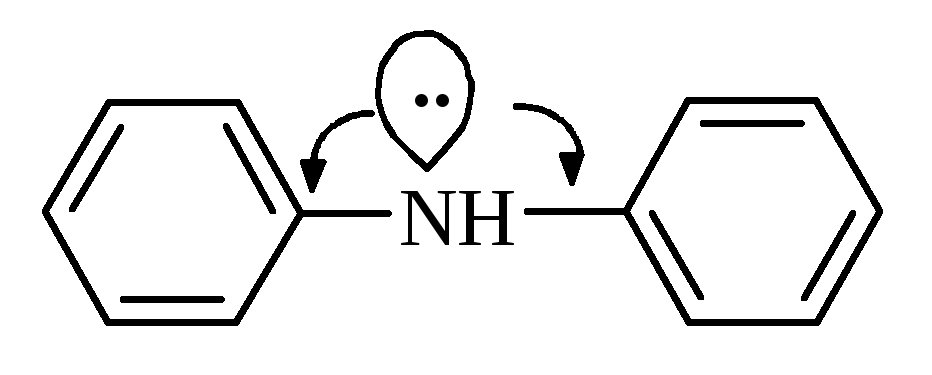
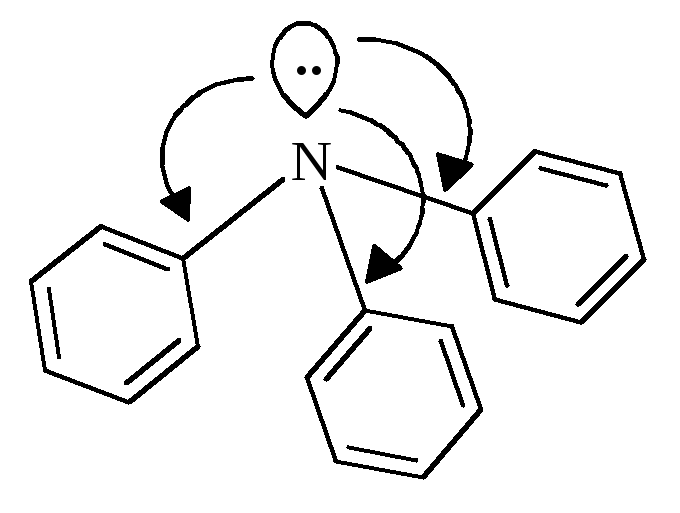
У
ароматичних амінів зв’язок
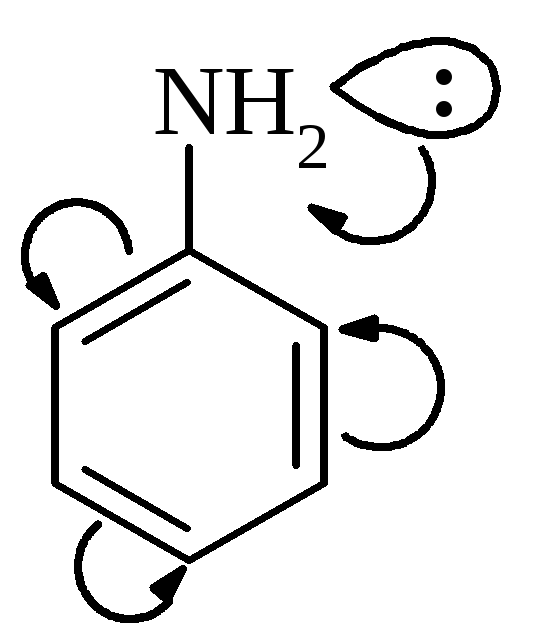
Завдяки цьому зменшуються у порівнянні з аліфатичними амінами, основні властивості ариламінів. | |||
4. Фізичні властивості.
Нижчі аміни (метиламін, ди- та триметиламін) – гази, при збільшенні вуглеводневого ланцюга – рідини, вищі – тверді речовини. Збільшення молекулярної маси амінів супроводжується підвищенням температури кипіння та зменшенням розчинності у воді (табл. 24.1). Молекули амінів утворюють асоціати за рахунок утворення водневого зв’язку, подібно до молекул води, але менш міцного за рахунок меншої їх полярності.
Таблиця 24.1
Фізичні властивості амінів.
|
Назва |
Формула |
Ткип., С |
|
|
Метиламін |
|
-6,5 |
10,6 |
|
Диметиламін |
|
7,4 |
10,8 |
|
Триметиламін |
|
3,5 |
9,8 |
|
Етиламін |
|
16,6 |
10,6 |
|
Диетиламін |
|
55,8 |
10,9 |
|
Триетиламін |
|
89,5 |
10,8 |
|
Гексиламін |
|
133,0 |
10,7 |
|
Етилендіамін |
|
116,5 |
10,0 |
|
Гексаметилендіамін |
|
204,5 |
10,9 |
|
Анілін |
|
184,4 |
4,58 |
|
N-Метиланілін |
|
196,3 |
4,85 |
|
N,N-Диметиланілін |
|
192,5 |
5,06 |
|
о-Толуїдин |
|
199,7 |
4,39 |
|
м-Толуїдин |
|
203,2 |
4,69 |
|
п-Толуїдин |
|
200,4 |
5,12 |
5. Хімічні властивості.
5.1. Основні властивості обумовлені наявністю у амінів неподіленої електронної пари, здатної протонуватись:
|
|
|
A priori вважається, що збільшення основних властивостей алкіламінів пов’язане з +І-ефектом алкільних груп, що приводить до збільшення електронної густини на атомі азота (табл. 23.1). У водних розчинах окрім електронних ефектів враховують і сольватаційні ефекти розчинника. У цьому випадку основність змінюється у ряду:
|
| |||
|
Kb 5,210-4 |
4,410-4 |
5,510-5 |
1,810-5 |
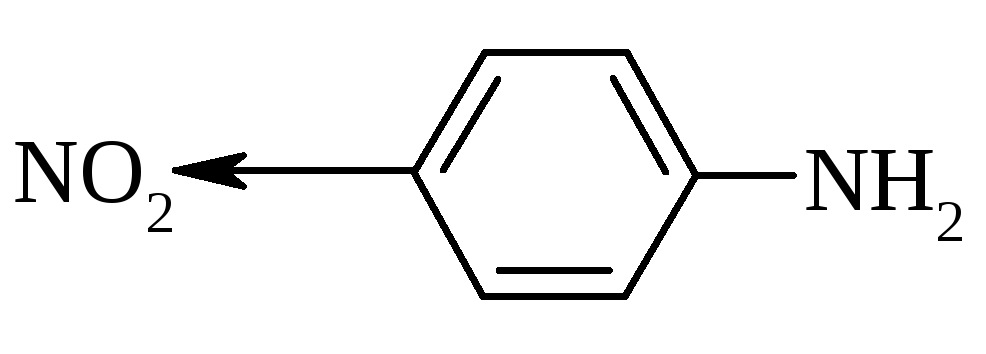
Ароматичні аміни за основними властивостями слабкіші, ніж аміни жирного ряда, або навіть аміак. Зниження основних властивостей обумовлено супряженням неподільної електронної пари нітрогена з -електронною системою ароматичного ядра. При цьому основні властивості змінюються у ряду:
|
|
|
| ||||
|
Kb: |
4,410-4 |
|
1,810-5 |
|
4,210-10 | |
відповідно, заміщення атомів гідрогену в молекулі аміака на ароматичні радикали ще більше зменшує їх основність:
|
|
|
|
|
Kb=4,210-10 |
Kb=1,010-13 |
практично
не має основних властивостей, взаємодіє
лише з HClO4,
утворюючи при цьому сіль
|
Вплив електронодонорних та електроноакцепторних замісників в ароматичному ядрі на основні властивості ариламінів обумовлений також їх електронними ефектами:
|
|
|
|
|
|
|
+І-ефект |
|
-І-ефект |
|
Kb |
7,110-10 |
4,210-10 |
1,010-13 |
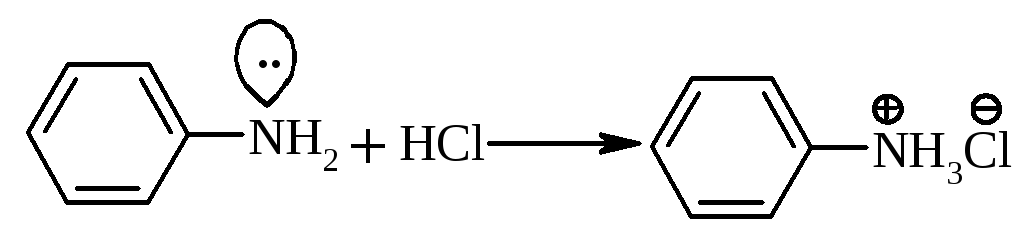
електронодонорні замісники (+І-ефект) збільшують основність, а електроноакцепторні (‑І‑ефект) її зменшують в ароматичних амінах. З мінеральними кислотами аміни утворюють відповідні солі:
|
|
етиламоній хлорид |
|
|
феніламоній хлорид |
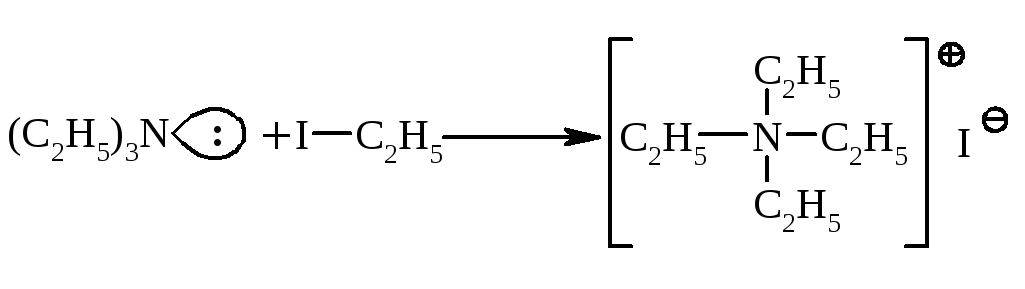
Третинні аміни з алкілгалогенідами взаємодіють за схемою:
|
|
солі амонія можна розглядати як координаційні сполуки, у яких азот має координаційне число рівне 4. |
Наявність зовнішньосферного іодид-аніона легко підтверджується реакцією із лугами:
![]()
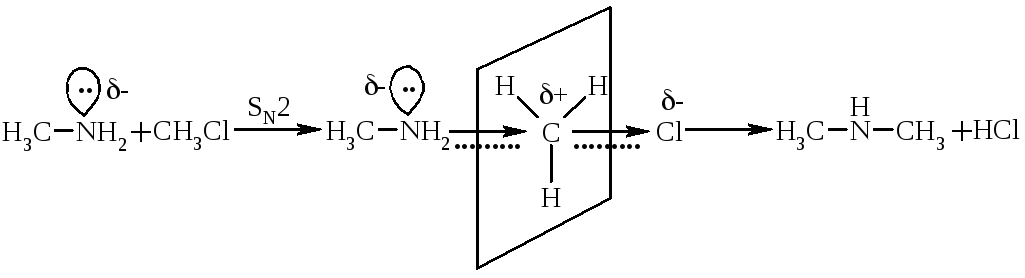
5.2. Алкілування та ацилюванняамінів – це реакції заміщення атома гідрогену біля нітрогену на алкільний (Alk) або ацильний (R–C(=O)–) радикали. Реакції алкілування розглянуті у підрозділі „Отримання амінів”. При цьому аміни являються активними нуклеофілами:
|
| ||
|
|
перехідний комплекс |
|
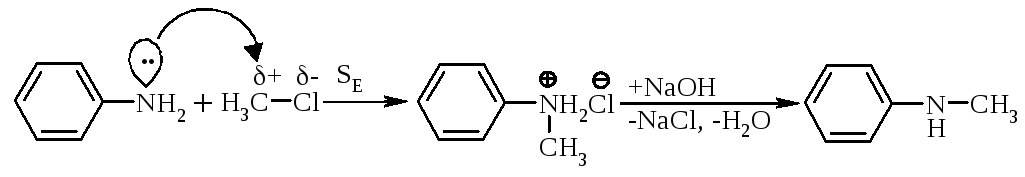
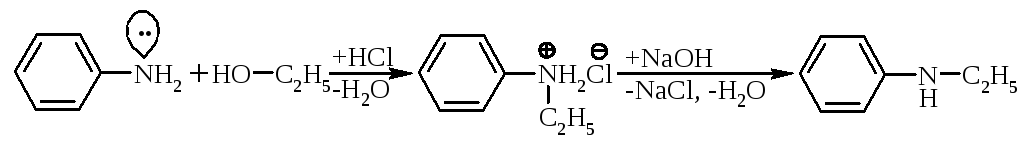
Ароматичні аміни алкілують галогеналканами або аліфатичними спиртами (промисловий метод):
|
| |||
|
|
N-метиланіліній хлорид |
|
N-метиланілін |
|
| |||
|
|
N-етиланіліній хлорид |
|
N-етиланілін |
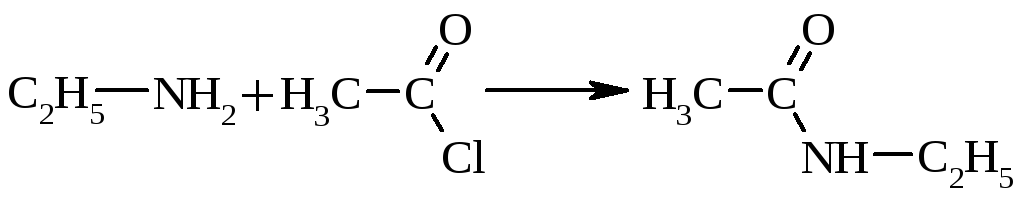
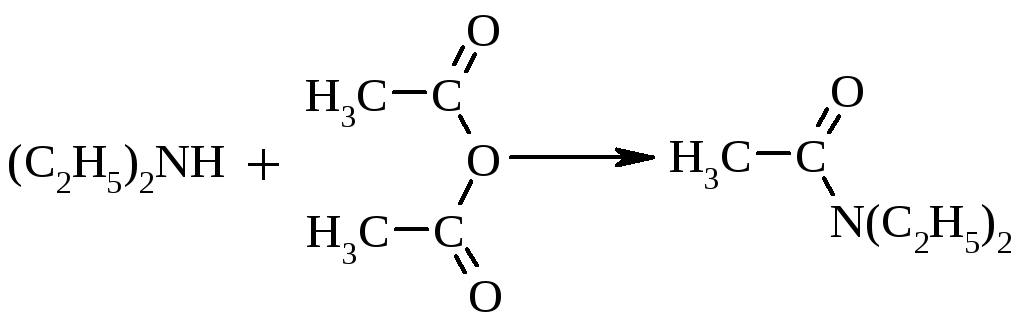
Первинні та вторинні алкіламіни легко ацилюються похідними карбонових кислот (ангідридами, хлорангідридами) з утворенням амідів:
|
|
N-етилацетамід |
|
|
N,N -диетилацетамід |
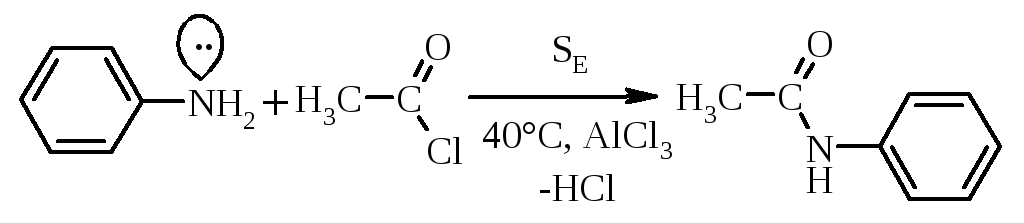
Ацилювання ариламінів, що значно менш основні, проходить від дією ангідридів або хлорангідридів кислот, а у випадку карбонових кислот потребує жорстких умов перебігу реакції.
|
|
ацетанілід |
Ацилювання по Фриделю-Крафтсу (SE-реакція) в залежності від умов проведення проходить під дією комплекса складу 1:1, або ацетил-катіону:
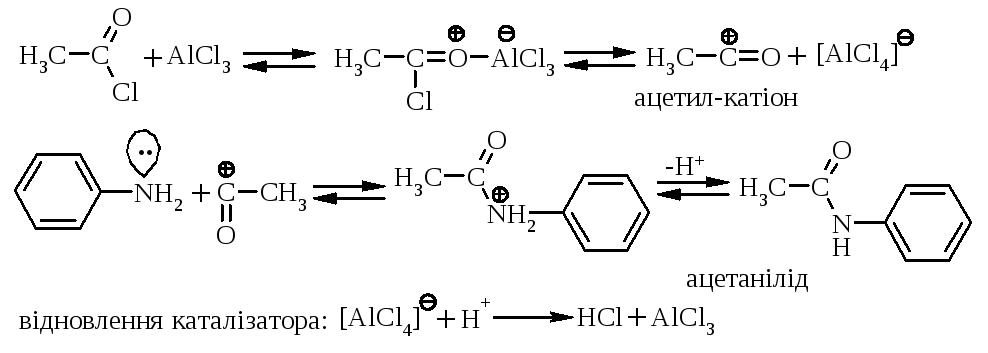
Аміди кислот легко гідролізуються (середовище Н+ або ОН–) з відновленням аміногрупи.
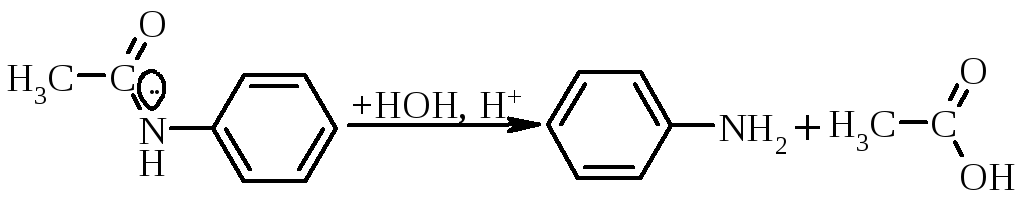
тому такий підхід використовують в синтетичній практиці для захисту аміногрупи, або для зменшення її донорського впливу на ароматичне ядро.
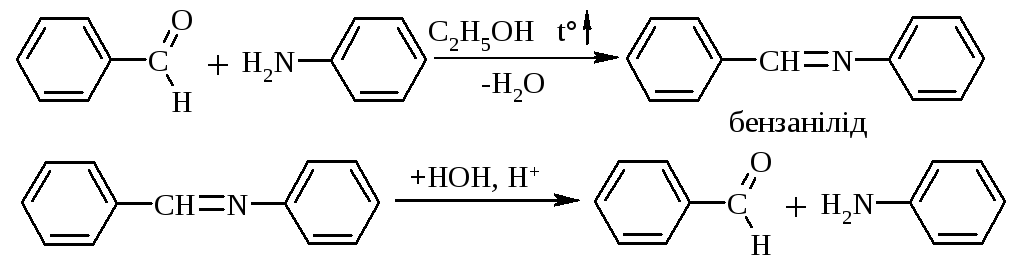
5.3. Реакцію ариламінів та арилальдегідів, що проходить з утворенням основ Шифа (азометинів), теж можна використовувати для захисту аміногрупи:
5.4. Взаємодія з нітритною кислотою.
Реакція має важливе аналітичне значення, так як дозволяє розрізнити первинні, вторинні та третинні алкіламіни. Вважається, що реагентом в реакції є азотистий ангідрид N2O3, що існує у рівновазі:
![]()
5.4.1. Первинні алкіламіни взаємодіють із виділенням азоту N2 та утворенням, переважно, відповідних спиртів:
|
| ||
|
|
нестійкий метилдіазоній хлорид |
|
За механізмом це – реакція електрофільного заміщення – SE:
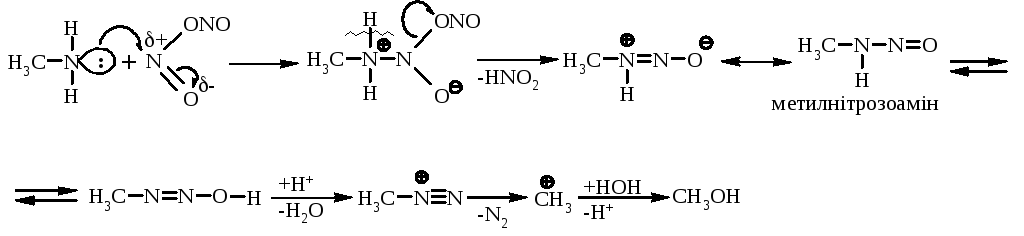
Вторинні алкіламіни при взаємодії з нітритною кислотою зупиняються на стадії утворення диалкілнітрозамінів:
|
|
диметилнітрозамін (N-нітрозодиметиламін) |
Третинні алкіламінипри 0-5°С утворюють нестійкі солі, які при підвищенні температури розкладаються.
5.4.2. Ароматичні первинні аміни(на відміну від аліфатичних) утворюють стійкі солі діазонія за реакцією П. Гріса (1858 р.):
|
|
фенілдіазоній хлорид |
Вторинні ароматичні аміни, як і аміни жирного ряду, при взаємодії з нітритною кислотою зупиняються на стадії утворення арилалкіл- або діарилнітрозамінів:
|
|
N-нітрозо-N-метиланілін |
Третинні жирноароматичні аміни перетворюються при дії нітритної кислоти в зелені кристалічні N,N-діалкіл-4-нітрозоариламіни:
|
|
4-нітрозо-N,N-диметиланілін |