
- •Дипломна робота
- •Реферат
- •Розділ 1 техніко - економічне обгрунтування
- •Розділ 2 Огляд літературних джерел
- •2.1. Характеристика макролідних антибіотиків
- •2.1.1. Особливості макролідів та азалідів
- •2.1.3. Характеристика напівсинтетичного антибіотику Азитроміцину
- •2.2. Технологія виробництва Еритроміцину як напівпродукту отримання Азитроміцину
- •2.2.1. Характеристика біологічного агенту
- •2.2.2. Опис технологічного процесу
- •2.2.3. Отримання антибіотику Азитроміцину із Еритроміцину
- •Розділ 3 Удосконалення технологічної схеми виробництва Азитроміцину
- •3.1. Характеристика кінцевої продукції виробництва
- •3.2. Технологічна схема виробництва таблеток Азитроміцину
- •3.2.1. Санітарна обробка та підготовка обладнання
- •3.2.2. Опис технологічного процесу
- •3.2.3. Матеріальний баланс виробництва
- •3.2.4. Контроль виробництва
- •3.3. Удосконалення технології виробництва Азитроміцину в таблетках
- •3.4. Розрахунок техніко-економічних показників
- •3.4.1. Технологічний розрахунок сушарки-гранулятора
- •3.4.2. Розрахунок економії після впровадження сушарки-гранулятора
- •Розділ 4 Охорона праці
- •4.1. Небезпечні та шкідливі виробничі фактори при виробництві таблеток Азитроміцину
- •4.2. Технічні та організаційні заходи для зменшення рівня впливу небезпечних та шкідливих виробничих факторів в процесі виробництва препарату Азитроміцину
- •4.2.1. Електробезпека
- •4.2.2. Повітря робочої зони
- •4.2.3. Захист від виробничого шуму та вібрації
- •4.2.4. Виробниче освітлення
- •4.3. Забезпечення пожежної та вибухової безпеки в процесі виробництва антибіотику Азитроміцину
- •Розділ 5 Охорона навколишнього середовища
- •5.1. Утилізація відходів фармацевтичної промисловості в Україні
- •5.2. Аналіз нормативних документів у галузі поводження з відходами
- •5.3. Поводження з відходами виробництва антибіотика Азитроміцину
- •Висновки
- •Список використаних джерел
2.2.3. Отримання антибіотику Азитроміцину із Еритроміцину
Азитроміцин отримують метилуванням 11-аза-10-деоксо-10-дигідроеритроміцину при кип’ятінні в середовищі хлорованого вуглеводню у присутності мурашиної кислоти у кількості від 0,1 до 0,2 вагових частин на вагову частину 11-аза-10-деоксо-10-дигідроеритроміцину (Рис. 2.5). В якості метилюючого агента використовують параформ (СН2O)n, де n від 8 до 100, який є твердою, сухою, нетоксичною речовиною з температурою плавлення 120°-170°С, в кількості від 0,05 до 0,2 вагових частин на вагову частину 11-аза-10-деоксо-10-дигідроеритроміцину [17].
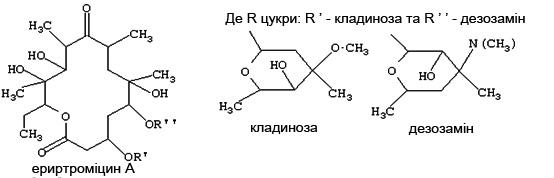
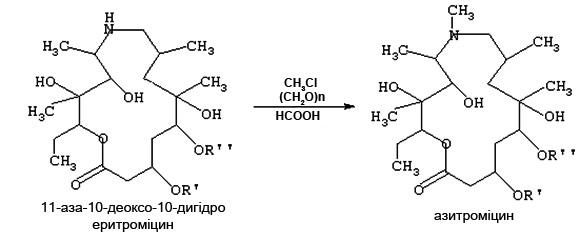
Рис. 2.5 Отримання антибіотика азитроміцину із еритроміцину
Для модифікації еритроміцину здійснюють Бекманівське перегрупування 9 (E)-оксима та відновлення отриманого іміноефіру у 11-аза-10-деоксо-10-дигідроеритроміцин, що супроводжується перетворенням 14-членного кетолактонового кільця у 15-членне азолактонне кільце.
Для реалізації цього методу 10 кг 11-аза-10-деоксо-10-дигідроеритроміцину розчиняють у 100 л хлористого метилену, присипають 0,7 кг параформу, приливають 1,1 л 99% мурашиної кислоти, нагрівають зі зворотним холодильником до кип’ятіння та кип’ятять протягом 10 годин. Суміш охолоджують, відфільтровують, прозорий фільтрат упарюють під вакуумом до отримання в’язкого залишку, до якого приливають 150 л 5% розчину карбонату натрію та інтенсивно перемішують при температурі 50°С до отримання однорідної суспензії. Суспензію відфільтровують, пасту промивають 50 л води та сушать під вакуумом при температурі 50°С до постійної ваги [17]. Отримують 9,8 кг білого аморфного порошку, що містить азитроміцин з хроматографічною чистотою 95% та вологою 2,0%. Вихід азитроміцину від аза-еритроміцину – 89,5%.
Розділ 3 Удосконалення технологічної схеми виробництва Азитроміцину
3.1. Характеристика кінцевої продукції виробництва
Назва продукції – «АЗИМЕД», таблетки, вкриті плівковою оболонкою, по 500 мг №3 або №10 у блістері, 1 блістер у пачці.
Категорія та номер діючого НТД та реєстраційний номер - ДФУ Х, ст. 573, препарат дозволений до випуску наказом Міністерства охорони здоров’я №596 від 21 липня 2010 р. номер реєстраційного посвідчення №UA/7234/02/01 від 21.07.2010.
Фармакотерапевтична група. Антибактеріальні засоби для системного застосування. Макроліди, лінкозаміди та стрептограміни. Азитроміцин. Код АТС J01F A10;
Склад і співвідношення інгредієнтів на одну таблетку азитроміцину 500 мг вказані в таблиці 3.1.
Таблиця 3.1
Склад і співвідношення інгредієнтів
|
№ пп |
Найменування інгредієнтів |
Вміст у таблетці азитроміцину 500 мг | |
|
в мг |
в % | ||
|
1 |
Азитроміцину дигідрат |
500,0 |
64,10 |
|
2 |
Целюлоза мікрокристалічна М-102 або МС-102 |
223,7 |
28,68 |
|
3 |
Кальцію гідро фосфат безводний |
3,9 |
0,50 |
|
4 |
Гіпромелоза |
8,2 |
1,05 |
|
5 |
Натрію крохмалят (тип А) |
11,7 |
1,50 |
|
6 |
Натрію лаурилсульфат |
24,2 |
3,10 |
|
7 |
Магнію стеарат |
3,9 |
0,50 |
|
|
ВСЬОГО: |
780,0 |
100,00 |
Таблетки азитроміцину 500 мг, вкриті плівковою оболонкою, світло-блакитного кольору, овальної форми з двоопуклою поверхнею, з рискою з одного боку таблетки (Рис. 3.1). На поперечному зрізі помітно ядро білого кольору. Таблетки не повинні кришитись і повинні володіти необхідною міцністю, повинні бути стійкими до механічних дій при пакуванні і транспортуванні.
Рис. 3.1 Вигляд кінцевої продукції
Середня маса таблетки азитроміцину 500 мг – від 756,2 до 835 мг.
Вміст азитроміцину (C38H72N2O12) в одній таблетці має бути від 475 мг до 525 мг, у перерахунку на середню масу таблетки.
Хімічна назва: 9-деоксо-9а-аза-9а-метил-9а-гомоеритроміцин А.
Хімічна формула - C38H72N2O12.
Молекулярна маса - 748,98.
Субстанція містить не менше 98,0% і не більше 102,0% C38H72N2O12 у перерахунку на суху речовину.
Зберігання – в оригінальній упаковці при температурі не вище 25оС
Упаковка. Таблетки азитроміцину 500 мг розфасовують по 3 таблеток у блістери із плівки полівінілхлоридної і фольги алюмінієвої з друком, закованої. 1 блістер разом з інструкцією для медичного застосування поміщають у пачку з картону [9].
Маркування. На етикетці вказують: Міністерство, завод-виробник і його товарний знак, назву препарату на латинській і українській мові, дозування, кількість таблеток в одній упаковці, номер серії, номер реєстраційного посвідчення, термін придатності, умови зберігання [9].
Термін придатності – 2 роки.
