
Laboratorn_Roboti
.pdf
Таблиця 3.3 - Обробка результатів дослідів
Величина |
Розрахункова |
|
Заміри |
|
|||
Позна- |
Одиниця |
1 |
2 |
3 |
4 |
||
формула |
|||||||
чення |
|
|
|
|
|
||
|
|
|
|
|
|
||
p1м |
|
9,81 10-3 z1 |
|
|
|
|
|
p3м |
|
9,81 10-3 z3 |
|
|
|
|
|
p2 |
кПа |
0,1333 pб |
|
|
|
|
|
p1 |
|
p1м+p2 |
|
|
|
|
|
p3 |
|
p3м+p2 |
|
|
|
|
|
zб |
мм.вод.ст. |
13,6 pб |
|
|
|
|
|
k1 |
- |
ln(p1/p2)/ln(p1/p3) |
|
|
|
|
|
k2 |
- |
z1/(z1-z3) |
|
|
|
|
|
k3 |
- |
[1-(z3/z1)(2zб-z3)/(2zб-z1)]-1 |
|
|
|
|
|
k |
- |
(k1+k2+k3)/3 |
|
|
|
|
|
k |
- |
1,4 - k |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
% |
100 k/1,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
K |
tн.с. + 273 |
|
|
|
|
|
v1 |
м3/кг |
RnT1 /p1 |
|
|
|
|
|
T2 |
K |
T1(p2 /p1)(k-1)/k |
|
|
|
|
|
v2 |
м3/кг |
RnT2 /p2 |
|
|
|
|
|
T3 |
K |
T1 |
|
|
|
|
|
v3 |
м3/кг |
RnT3 /p3 |
|
|
|
|
|
cvm |
Дж/(кг К) |
Rn/(k-1) |
|
|
|
|
|
cpm |
Дж/(кг К) |
kcvm |
|
|
|
|
|
Абсолютний тиск повітря в балоні:
P 0,1333P 9,81 10 3 z , |
(3.9) |
б |
|
де P - абсолютний тиск повітря, кПа; Pб - барометричний тиск, мм.рт.ст.; z - надлишковий тиск, мм.вод.ст.;
Питомий об’єм повітря в балоні:
RПT P , |
(3.10) |
де - питомий об’єм, м3/кг; Rп - питома газова стала повітря, кДж/(кг К); T- термодинамічна температура, К. Для повітря
30

Rп=287 Дж/(кг К).
Дослідний показник адіабати:
k ln P |
P |
ln P |
P , |
(3.11) |
|
i |
1 |
2 |
1 |
3 |
|
де P1, P2, P3 - абсолютний тиск повітря в балоні відповідно у стані, що відповідає характерним точкам процесу (рис.2.1), кПа.
Показник адіабати першого наближення:
ki z1 |
(z1 z3 ) , |
(3.12) |
де z1, z3 – надлишковий тиск в балоні відповідно перед адіабатним розширенням і в кінці ізохорного процесу, мм.вод.ст.
Показник адіабати другого наближення:
|
|
|
z3 |
|
2zб |
z3 |
1 |
|
|
|
k 1 |
|
|
|
, |
(3.13) |
|||||
z |
2z |
z |
||||||||
i |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
1 |
|
б |
1 |
|
|
|||
де zб – барометричний тиск, мм.рт.ст.
Термодинамічна температура повітря на початку адіабатного розширення:
T1 t0 273 . |
(3.14) |
Розрахункова температура повітря в кінці адіабатного розширення:
T T |
P |
P |
k 1 |
|
||
k |
. |
(3.15) |
||||
2 |
1 |
2 |
1 |
|
|
|
Середній дослідний показник адіабати:
n |
|
k ki n , |
(3.16) |
i 1
де n – число замірів.
Абсолютна похибка визначення показника адіабати:
k 1,4 k . |
(3.17) |
Відносна похибка визначення показника адіабати, %:
k 100 k /1,4 , |
(3.18) |
У формулах (3.17) і (3.18) число 1,4 – це середнє значення показника адіабати повітря в діапазоні температури (0-50) C.
31
3.6 Контрольні запитання
1.Що називається термодинамічним процесом?
2.Який стан газу називається рівноважним?
3.Яка принципова відмінність між термічними і калоричними параметрами стану?
4.Що являють собою і для чого служать термодинамічні діаграми?
5.Що називається термодинамічною системою?
6.Чим відрізняється закрита термодинамічна система від адіабатної?
7.В чому відмінність між адіабатною термодинамічною системою та ізольованою?
8.В чому відмінність між адіабатним і ізотермним процесами?
9.Запишіть формули для визначення зміни внутрішньої енергії та ентальпії ідеального газу в довільному політропному процесі?
10.Чому дорівнює відношення роботи газу в ізотермному процесі до теплоти цього процесу?
11.В якому процесі не змінюється ентропія ідеального газу?
12.Як називається процес, в якому відношення зміни ентальпії ідеального газу до теплоти процесу дорівнює показнику адіабати?
13.З яких основних конструктивних елементів складається лабораторна установка?
14.Для чого використовується компресор у лабораторній установці?
15.Для чого здійснюється швидкий випуск повітря із балона при виконанні лабораторної роботи?
16.Які формули використовуються для визначення показника адіабати при обробці дослідних даних?
17.Що називається показником адіабати?
18.Чому після випуску частини повітря з балона і закриття крана ВН1 тиск в балоні починає зростати?
19.Що називається роботою процесу і як вона обчислюється?
20.Що називається теплотою процесу і як вона обчислюєть-
ся?
21.Що називається енергією?
32
4 Лабораторна робота №4
Визначення ізобарної теплоємності повітря при атмосферному тиску
4.1 Мета і задачі проведення лабораторної роботи
Засвоєння і закріплення теоретичного розділу з теплоємності дослідне визначання середньої ізобарної теплоємності речовини набуття навиків обробки дослідних даних.
У результаті виконання лабораторної роботи студент повинен:
знати:
-визначення поняття теплоємності
-класифікацію теплоємностей методи визначення теплоємності речовини
-призначення елементів лабораторної установки
-методику обробки дослідних даних;
вміти
-виконувати необхідні вимірювання визначати середню теплоємність
-виконувати перерахунок з однієї теплоємності на іншу;
-користуватися таблицями теплоємностей
-виконувати розрахунок похибок і оцінювати точність
дослідних даних робити висновки з виконаної роботи.
4.2 Теоретичні основи
Багато процесів зміни стану робочого тіла супроводжується теплообміном з навколишнім середовищем. У цьому випадку теплота або підводиться до робочого тіла або відводиться від нього. Для дослідження таких процесів необхідно вміти визначити кількість підведеної або відведеної теплоти.
Теплоємність являє собою відношення кількості теплоти
Q одержаної речовиною при нескінченно малій зміні її стану в будь-якому процесі, до зміни температури речовини dT.
Сх=( Q/dT)х. |
(4.1) |
Теплоємність речовини є величиною екстенсивною, тобто залежить від кількості речовини. Теплоємність, віднесена до одиниці маси називається масовою (С), до одиниці об’єму,
33

взятої за нормальних умовах - об’ємною (С ), до одного кмоля речовини - мольною (С ), тобто
С=С / m= Q / (m ·dT), |
(4.2) |
C =C/v= Q/(VdT), |
(4.3) |
C =C/N= Q/(NdT), |
(4.4) |
де m - маса речовини, кг; V - об’єм речовини, м³; N - кількість речовини, кмоль.
Теплоємність речовини не є величиною постійною, а залежить від температури і характеру процесу.
Розрізняють істинну теплоємність,тобто теплоємність при даній (конкретній) температурі, і середню теплоємність – в інтервалі температур.
Істинна теплоємність визначаються за формулою (4.1), а середня за формулою
Сm=Q/ Tx. |
(4.5) |
Зв’язок між істинною і середньою теплоємностями встановлюється співвідношенням:
T2cx dT
Схm= T1 |
T T . |
(4.6) |
|
|
2 |
1 |
|
Значення теплоємності речовини залежить від характеру процесу підводу теплоти. В розрахунках найчастіше всього використовують ізобарну Cp і ізохорну Сv теплоємності.
Cp=( Q/dT)p |
(4.7) |
Cv=( Q/dT)v |
(4.8) |
Залежність між масовою ізобарною і масовою ізохорною теплоємностями ідеального газу встановлюється рівнянням Майєра:
Сp=Cv+R, |
(4.9) |
де R- питома газова стала, Дж/(кг К)
Залежність між теплоємностями Сp i Сv реальних газів встановлюється за допомогою диференціальних рівнянь термодинаміки і може бути записана у вигляді:
Сp-Cv=T( P/dT)v( V/dT)p |
(4.10) |
34
Для твердих і рідких тіл різниця між теплоємностями Сp і Cv мала, так як об’єм цих тіл мало змінюється при нагріванні.
Теплоємність можна визначити різними методами. Наприклад, за формулою Ейнштейна, одержаної на основі квантової теорії Планка:
С =i1R /2+ R ( /T)²(e /T/(e /T-1)²), (4.11)
де i1 - число степеней вільності поступального і обертального
руху молекул; R - універсальна газова стала, кДж/(кмоль К) i2 - число степеней вільності внутрішньомолекулярних
коливань - характерна температура коливального руху, К е - основа натуральних логарифмів Т - абсолютна температура
газу, К Ця формула не є абсолютно точною, так як при її
виведенні були зроблені деякі допущення.
Для наближення розрахунків при не дуже високих температурах можна використати теплоємності Сp і Cv, які одержані на основі молекулярно-кінетичної теорії теплоємності.
Точні значення теплоємностей ідеальних газів використовуються на основі спектроскопічних даних з використанням математичного апарату квантової статистики. Значення цих теплоємностей приводяться в спеціальних таблицях.
Теплоємності реальних газів і речовин частіше всього визначаються дослідним шляхом. Основними дослідними методами є: метод нагріву окремої порції речовини і метод протоку.
Дослідним шляхом найпростіше визначати масову і об’ємну ізобарну теплоємності.
Значення теплоємностей на основі дослідних даних можна визначити за формулами:
Сpm=Q/(m T)=Q/(m(T2-T1)), |
(4.12) |
C pm=Q/(V0 T)=Q/(V0(T2-T1), |
(4.13) |
де Q - теплота,яка підводиться до речовини при Р=сonst, кДж; m - маса речовини, кг; T - зміна температури речовини, К; T1 - початкова температура речовини, С; T2 - кінцева
температура речовини, С; V0 – об’єм речовини, приведений до нормальних умов, м³.
У відповідності з розрахунковими формулами (4.12) і (4.13) лабораторна установка для визначення теплоємності
35
повинна мати пристрій для підведення теплоти до дослідної речовини, а також вимірювальні пристрої для визначення
значень Q, m, V0, T1, T2 або Т.
У більшості випадків підведення теплоти до дослідної речовини здійснюються за допомогою електронагрівача. Для визначення теплоти Qe, яка виділяється електронагрівачем, необхідно знати силу струму І, спад напруги U і час
нагрівання . Маса m речовини може бути визначена ваговим і об’ємним способами. Значення температур на початку t1 i в кінці t2 підведення теплоти здійснюється за допомогою термопар або термометрів опору і відповідних вторинних приладів (потенціометрів, логометрів).
Об’єм газу V0 визначається за допомогою газового лічильника або витратоміра.
4.3 Опис лабораторної установки
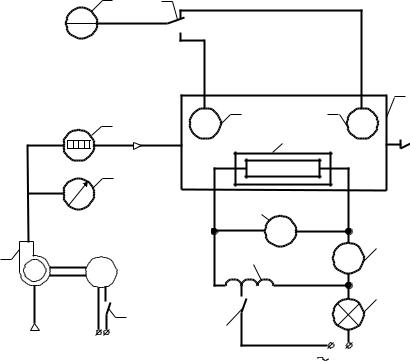
Принципова схема лабораторної установки представлена на рис.4.1.
Повітря за допомогою нагнітача 1 прокачується через калориметр 9, де нагрівається за рахунок теплоти, яка виділяється електричним нагрівачем 8, який живиться змінним струмом. За допомогою вимикача 13, регулювання теплового потоку від нагрівника повітря здійснюється трансформатором 12.
Падіння U напруги на нагрівника визначається за допомогою вольтметра 10, сила струму І в ланцюгу нагрівника – амперметром 11.
Нагнітач підключається до мережі з допомогою вмикача 4. Об’єм повітря, який пройшов через калориметр за час , вимірюється за допомогою лічильника 2 при різниці показників в кінці V1 i на початку заміру V2.
Температура повітря на вході в калориметр і на виході з нього вимірюється за допомогою термометрів опору 7 і визначається за показами логометра 5. Підключення термометрів опору до логометра здійснюється за допомогою перемикача 6.
Надлишковий тиск повітря pм за нагнітачем 1 вимірюється тягонапороміром 3.
36
5 6
TR
|
|
|
|
|
|
9 |
|
2 |
|
7 |
|
7 |
|
|
|
TE |
|
TE |
Гаряче |
|
|
|
|
|
|
||
|
|
|
|
8 |
|
повітря |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
V |
|
11 |
1 |
|
|
|
|
|
|
|
|
12 |
|
A |
|
|
К |
М |
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
|
14 |
|
|
4 |
13 |
|
|
|
|
|
|
|
|
|
|
Холодне |
|
|
|
|
|
|
повітря |
|
|
|
|
220 В |
|
|
|
|
|
|
|
1 – нагнітач; 2 – лічильник газу; 3 – тягонапоромір; 4 – вмикач; 5 – логометр; 6 – перемикач; 7 – термометр
опору; 8 – нагрівник; 9 – калориметр; 10 – вольтметр; 11 – амперметр; 12 – трансформатор; 13 – вмикач; 14 – лампочка.
Рисунок 4.1 – Принципова схема лабораторної установки
37
4.4 Порядок виконання роботи
Ознайомтесь з лабораторним стендом і призначенням приладів.
Занесіть в табл.4.1 характеристики вимірювальних приладів, а в табл.4.2 - значення барометричного тиску pб і температури навколишнього середовища tн.с..
Встановіть ручку трансформатора обертанням проти годинникової стрілки в стан “0”.
З дозволу викладача увімкніть установку в мережу включателем 13. Повинна загорітися лампочка 14. В протилежному випадку повідомте викладача.
Встановіть за допомогою ручки трансформатора 12 падіння напруги на нагрівачі U (за вказівкою викладача). Включіть нагрівач 1 вмикачем 4.
Досягніть встановленого режиму, при якому різниця темпе-
ратур не буде змінюватися на протязі 5 хвилин ( = t2 – t1 = = const).
Таблиця 4.1 - Характеристика вимірювальних приладів
Прилад |
Марка |
Діапазон |
Клас |
|
приладу |
шкали |
точності |
|
|
приладу |
приладу |
Амперметр |
|
|
|
Вольтметр |
|
|
|
Логометр |
|
|
|
Газовий лічильник |
РГ-40 |
40 м3/год |
2,5* |
Тягонапоромір |
|
|
|
Барометр |
|
|
|
* - При витраті повітря від 4 до 8 м3/год приведена похибка дорівнює 3%.
38
Таблиця 4.2 – Дослідні дані
Вели |
Одиниця |
|
|
Заміри |
|
|
чина |
величини |
1 |
2 |
3 |
4 |
5 |
tн.с. |
0C |
|
|
|
|
|
pб |
мм.рт.ст |
|
|
|
|
|
|
Па |
|
|
|
|
|
pм |
кгс/м2 |
|
|
|
|
|
|
Па |
|
|
|
|
|
U |
В |
|
|
|
|
|
I |
А |
|
|
|
|
|
t1 |
0C |
|
|
|
|
|
t2 |
0C |
|
|
|
|
|
|
с |
|
|
|
|
|
V1 |
м3 |
|
|
|
|
|
V2 |
м3 |
|
|
|
|
|
Проведіть 5 замірів. Час заміру 1-2 хвилини. Час між замірами - 5 хвилин. Результати замірів занесіть в табл.4.2.
Після закінчення експерименту відключіть установку від мережі. Ручку трансформатора встановіть в положення “0”.
Зробіть обробку дослідних даних за методикою, викладеною нижче. Результати обробки дослідних даних занесіть в табл.4.3. Результати оцінки похибки досліду занесіть в табл.4.4.
4.5 Обробка дослідних даних
Теплота , яка виділяється електронагрівачем за час заміру
, Дж.
Q=IU , |
(4.14) |
де I - сила струму в електронагрівачі, А; U - спад напруги на
електронагрівачі, В; - час заміру, с.
Об’єм повітря, який пройшов через калориметр за час заміру:
V=V2-V1, |
(4.15) |
де V2 - покази лічильника в кінці заміру, м3; V1 - покази |
|
лічильника на початку заміру, м3. |
|
Абсолютний тиск повітря на вході в калориметр: |
|
p=pб+pм, |
(4.16) |
де pб - барометричний тиск повітря, Па; pм - надлишковий
39
