
- •Тема 4. Фазовые равновесия
- •4.1. Основные понятия и определения
- •4.2. Правило фаз Гиббса
- •4.3. Понятие о физико-химическом анализе. Термический анализ
- •4.4. Однокомпонентные гетерогенные системы. Уравнение Клапейрона – Клаузиуса
- •4.5. Фазовые диаграммы однокомпонентных гетерогенных систем
- •4.5.1. Фазовая диаграмма воды
- •4.5.2. Полиморфизм
- •4.5.3. Фазовая диаграмма серы
4.5.2. Полиморфизм
Кристаллическая структура вещества определяется не только его химическим составом, но и условиями образования. В природе существует множество примеров, когда в зависимости от условий образования, вещества могут иметь различную структуру кристаллов, т.е. тип решетки, и поэтому различные физические свойства. Это явление называется полиморфизмом.Присутствие той или иной модификации вещества может таким образом характеризовать условия его образования. Полиморфные модификации обозначают греческими буквами,,,.
Возможны два типа полиморфизма: энантиотропный и монотропный.
Энантиотропияхарактеризуется обратимым самопроизвольным переходом при определенных Р и Т одной формы в другую. Этот переход сопровождается снижением энергии Гиббса при изменении термодинамических условий (Р,Т). На рис. 4.2 показан энантиотропный переход от фазык фазепри (Р,Т)↔. До температуры и давления фазового перехода (левее точки (Р,Т)↔) более устойчива-модификация вещества, т.к. она обладает меньшим запасом свободной энергии G. В точке пересечения кривых G=G, обе фазы находятся в равновесии. За этой точкой, т.е. при высоких Р и Т, устойчивее-фаза. Таким образом,-фаза является низкотемпературной, авысокотемпературной модификацией вещества.
Рис.
4.2.
Изменение функции Гиббса при энантиотропии
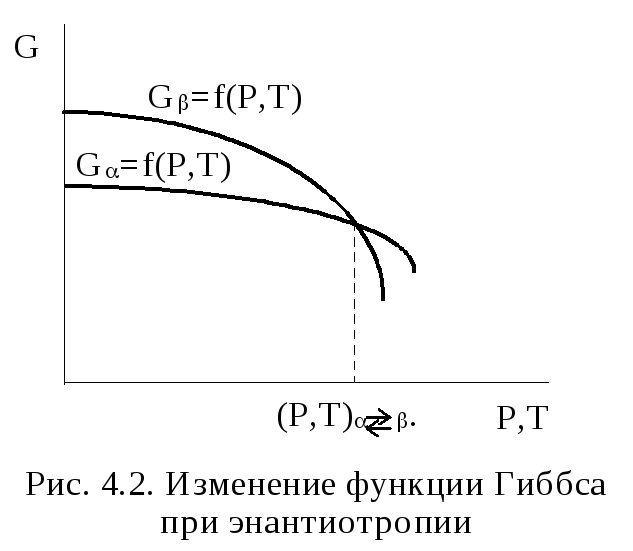
Энантиотропные превращения характерны для углерода, серы, двуокиси кремния и многих других веществ.
Если во всем интервале Р и Т стабильна только одна фаза, то фазовый переход не связан с определенными значениями Р и Т и является необратимым. Такой тип полиморфизма называется монотропией (рис.4.3).Более стабильна та фаза, энергия Гиббса которой ниже (на рис. 4.3. фаза ). Монотропные формы в природных условиях встречаются реже; примером может служить система
Fe2O3Fe2O3
маггемит гематит
Рис.
4.3.
Изменение энергии Гиббса при монотропии

На фазовой диаграмме полиморфизм вещества характеризуется дополнительными линиями, ограничивающими области существования отдельных полиморфных модификаций.
4.5.3. Фазовая диаграмма серы
В качестве примера рассмотрим диаграмму состояния серы, которая может существовать в виде ромбической или моноклинной серы, т.е. она диморфна. На фазовой диаграмме серы (рис. 4.4), в отличие от диаграммы воды, два поля твердых фаз: область ромбической серы (слева от линии EABD, поле 1) и моноклинной (внутри треугольника АВС, поле 2). Поле 3 – область расплавленной серы, поле 4 – парообразная сера.
ВС кривая плавления моноклинной серы,
BDкривая плавления ромбической серы,
АВ кривая полиморфного превращения: Sромб ↔ Sмонокл
ЕА и АС кривые возгонки ромбической и моноклинной серы, соответственно,
СК кривая испарения жидкой серы.
Пунктирные линии отражают возможность существования метастабильных фаз, которые можно наблюдать при резком изменении температуры:
А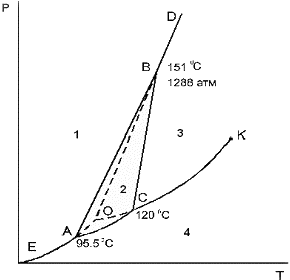 О:
[Sромб] ↔ (S);
СО: {S}↔ (S);
ВО: [Sромб] ↔ {S}.
О:
[Sромб] ↔ (S);
СО: {S}↔ (S);
ВО: [Sромб] ↔ {S}.
Рис. 4.4. Диаграмма состояния серы
Тройные точки соответствуют трехфазным равновесиям: А ромбическая, моноклинная и парообразная сера; Смоноклинная, жидкая и парообразная; Вромбическая, моноклинная и жидкая сера. В точке О (точка пересечения пунктирных линий внутри треугольника)метастабильное равновесие трех фаз: ромбической, жидкой и парообразной.
Таким образом, пользуясь фазовой диаграммой, можно определить фазовое состояние вещества в данных условиях или, наоборот, обнаружив ту или иную полиморфную модификацию вещества (например, сплава или минерала), охарактеризовать условия его образования.
