
Занятие 17
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Учебная цель: сформировать понимание физической сущности уравнения состояния идеального газа. Привить навыки самостоятельного решения задач по данной теме.
Литература
Основная: Детлаф А.А., Яворский Б.М. Курс физики. - М.: Высшая школа, 1989. - Гл.8, § 8.4.
Дополнительная: Савельев И.В. Курс общей физики. - М.: Наука, 1987. - Т.1. - гл. 10, § 86.
Контрольные вопросы для подготовки к занятию
1. Какой газ называется идеальным?
2. Какие физические величины характеризуют идеальный газ? Дайте их определения и единицы измерения.
3. Что называется процессом, изопроцессом?
4. Сформулируйте и запишите уравнения изопроцессов. Начертите диаграммы в координатах рV, VT, рT.
5. Запишите уравнение состояния идеального газа для произвольной массы.
6. Запишите выражение и сформулируйте закон Дальтона.
Краткие теоретические сведения и основные формулы
В молекулярно-кинетической теории пользуются моделью идеального газа, в котором:
- молекулы газа считаются материальными точками;
- столкновения молекул газа между собой и со стенками сосуда абсолютно упругие;
- потенциальной энергией взаимодействия между молекулами по сравнению с их кинетической энергией пренебрегают.
Модель идеального газа можно применять и при изучении реальных газов, так как многие газы (азот, водород, гелий, кислород, воздух и др.) в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки на собственный объем (размеры) молекул и действующие молекулярные силы (потенциальную энергию), можно перейти к теории реальных газов.
Состояние заданной массы газа определяется значениями трех его параметров: давления р, объема V и термодинамической температуры Т. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение других. Указанная связь может быть задана аналитически в виде функции
f (р, V, T) = 0. (17.1)
Соотношение (17.1), определяющее связь между параметрами, представляет собой уравнение состояния данной массы газа.
Уравнением состояния идеального газа является уравнение Менделеева – Клапейрона:
![]() .
(17.2)
.
(17.2)
где R
= 8,31
![]() – молярная (универсальная) газовая
постоянная.
– молярная (универсальная) газовая
постоянная.
Отношение массы вещества к его молярной массе равно числу молей:
![]() .
(17.3)
.
(17.3)
Моль
– единица количества вещества, равная
такому его количеству, в котором
содержится столько же структурных
элементов (атомов, молекул, ядер), сколько
содержится атомов в 0,012 кг изотопа
углерода
![]() .
Из определения моля следует, что 1 моль
различных веществ (газообразных, жидких,
твердых) содержит одинаковое число
АвогадроNА
= 6,022.1023
моль-1
структурных элементов.
.
Из определения моля следует, что 1 моль
различных веществ (газообразных, жидких,
твердых) содержит одинаковое число
АвогадроNА
= 6,022.1023
моль-1
структурных элементов.
Молярная масса – это масса одного моля вещества:
![]()
![]() (17.4)
(17.4)
Процессы, протекающие при каком-либо постоянном термодинамическом параметре, называются изопроцессами.
Процесс, протекающий при постоянной температуре, называется изотермическим.
Для данной массы
(т
= const)
определенного (
= const)
газа произведение
![]() ,
и тогда уравнение (17.2) можно записать в
виде
,
и тогда уравнение (17.2) можно записать в
виде
![]() или
или
![]() ,
(17.5)
,
(17.5)
что является выражением опытного закона Бойля - Мариотта. Кривая, изображающая зависимость между давлением и объемом при Т = const, называется изотермой (рис.17.1).
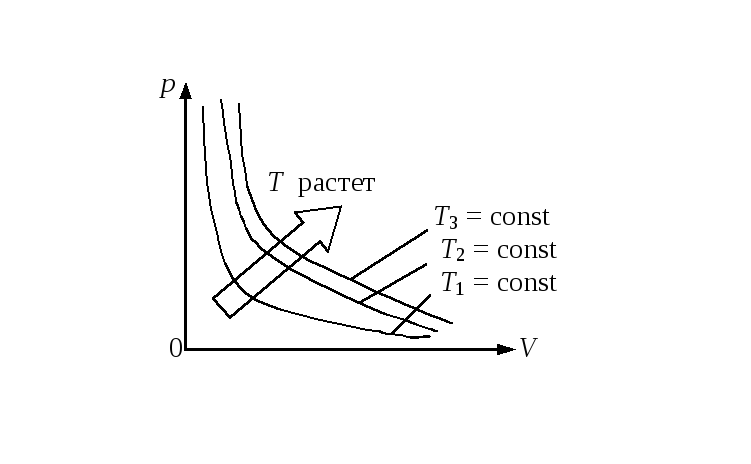
Рис. 17.1
Процесс, происходящий при постоянном внешнем давлении, называется изобарным. Он подчиняется закону Гей-Люссака
![]() или
или
![]() (17.6)
(17.6)
при m = const, = const.
На диаграмме в координатах V, T этот процесс изображается прямой, называемой изобарой (рис.17.2).

Рис.17.2
Процесс, происходящий при постоянном объеме, называется изохорным. Он подчиняется закону Шарля
![]() или
или
![]() (17.7)
(17.7)
при m = const, = const.
На диаграмме в координатах р, Т он изображается прямой, называемой изохорой (рис.17.3)
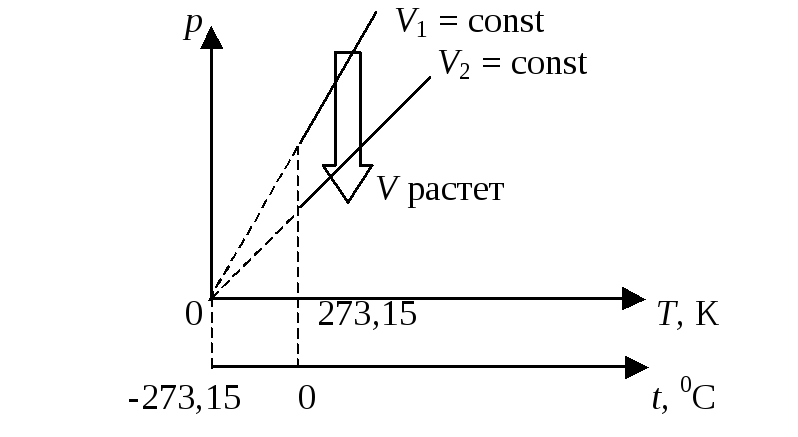 Рис.17.3
Рис.17.3
Для смеси идеальных газов справедлив закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений, входящих в нее газов, т.е.
![]() ,
,
где
![]() – парциальные давления - давления,
которые оказывали бы газы смеси, если
бы они одни занимали объем, равный объему
смеси при той же температуре.
– парциальные давления - давления,
которые оказывали бы газы смеси, если
бы они одни занимали объем, равный объему
смеси при той же температуре.
И тогда уравнение
состояния для смеси газов с массами
![]() и молярными массами
и молярными массами
![]() можно записать также в виде (17.2),
где
можно записать также в виде (17.2),
где![]() ,
,![]() ,
а молярная масса смеси газов (согласно
ее определению) равна
,
а молярная масса смеси газов (согласно
ее определению) равна
![]() .
(17.8)
.
(17.8)
Согласно определению числа Авогадро, число молекул, содержащихся в молях, равно
N = NA . . (17.9)
И тогда уравнение
(17.2) примет вид (![]() )
)
![]() ,
(17.10)
,
(17.10)
где
![]()
![]() – постоянная Больцмана.
– постоянная Больцмана.
Поделив обе части равенства (17.9) на объем V, получим уравнение состояния идеального газа в виде
р = n k T, (17.11)
где
![]() - концентрация частиц – число частиц в
единице объема. Давление газа прямо
пропорционально концентрации молекул
и его температуре.
- концентрация частиц – число частиц в
единице объема. Давление газа прямо
пропорционально концентрации молекул
и его температуре.
Уравнения (17.2) и (17.11) описывают равновесные состояния идеального газа.
Равновесным состоянием газа называется такое состояние, при котором все его параметры имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго.
Соотношение между температурой Т, измеренной по термодинамической шкале, и температурой t, измеренной по шкале Цельсия, следующее: Т = t + 273,15 К.
Единица градуса Цельсия равна единице кельвина (1 К = 1 0С).
