
fiz_osnovy_elektroniki_КЛ[1]
.pdf
3.2. Дефекты кристаллической решѐтки
Тепловые колебания атомов, которые мы рассмотрели выше, играют важную роль в таких свойствах, как теплоѐмкость, теплопроводность, тепловое расширение тел. Но они не приводят к серьѐзным нарушениям идеальной структуры кристалла, так как атомы находятся на среднем собственном месте. Условие идеальной структуры:
1)каждый атом окружѐн необходимым числом ближайших соседей;
2)атомы располагаются на средних расстояниях друг от друга. Если эти условия не выполняются, то образуются дефекты кри-
сталлической решѐтки. Эти дефекты в зависимости от их геометрии делят на 3 группы: точечные, линейные и поверхностные.
3.2.1. Точечные дефекты
Это дефекты нарушения решѐтки в изолированных друг от друга точках решѐтки. Например:
1. Наличие вакансий – узлы решѐтки, в которых отсутствуют атомы
(рис. 3.7 а).
а) |
б) |
в) |
|
Рис. 3.7. Точечные дефекты |
|
2.Атомы внедрения – лишние атомы, которые поместились между узлами (рис. 3.7 б).
3.Атомы примеси – инородные атомы, занимающие узлы кристаллической решѐтки (рис. 3.7 в).
Размеры этих дефектов примерно равны атомному диаметру.
3.2.2. Линейные дефекты
Такие дефекты называют дислокациями – это искажение кристаллической решѐтки вдоль определѐнного направления.
Видов дислокаций много, но в основном различают:
1. Краевые дислокации – искажение кристаллической структуры, вызванное тем, что в часть объѐма кристалла введена лишняя атомная плоскость (рис. 3.8). Искажения сосредоточены в основном вблизи нижней “полуплоскости” лишних атомов. Значок означает, что линия, перпендикулярная плоскости листа, – это линия искажения кристалла.
31

Вдоль этой линии число ближайших соседей отличается от координационного числа, через несколько атомных радиусов искажение исчезает.
Рис. 3.8. Линейный дефект (дислокация)
2. Винтовые дислокации. Вид этой дислокации можно представить из следующей модели. Возьмѐм кристалл, сделаем тонкий надрез на некоторую глубину, затем сдвинем материал по одну сторону надреза вниз на одно межатомное расстояние и снова сомкнѐм ряды атомов. Поверхность по стрелке есть винтовая поверхность.
3.2.3. Поверхностные дефекты
Они бывают двух типов: наружные и внутренние. Наружные дефекты – это несовершенство, обусловленное тем, что поверхность твердого тела граничит с другой фазой (металл воздух, вода, другой металл и т.д.). Внутренние дефекты – это несовершенство на границе от одной пространственной ориентации решѐтки к другой (например на границах зѐрен).
3.3. Общие свойства для всех видов дефектов
При тепловых колебаниях решетки дефекты могут смещаться, преобразовываться, выходить на поверхность и т.д.
Дефекты оказывают влияние на механические свойства (прочность, упругость, пластичность); электрические свойства (влияние на число свободных электронов, их подвижность в кристалле и т.д.); магнитные свойства (на ферро- и ферримагнетизм).
32

4. ЗОННАЯ ТЕОРИЯ ТВЁРДОГО ТЕЛА (ЭЛЕКТРОННЫЕ СОСТОЯНИЯ В ТВЁРДЫХ ТЕЛАХ)
Первой удачной попыткой объяснения электрических и магнитных свойств твѐрдых тел, в первую очередь металлов, была теория свободных электронов (электронный газ). Это позволило объяснить такие явления, как электро- и теплопроводность металлов, термоэлектронную эмиссию, термоэлектронный эффект и т.д. Но теория свободных электронов оказалась бессильной при рассмотрении свойств твѐрдых тел, зависящих от их внутренней структуры. Она не давала ответа, почему одни тела – проводники, а другие – изоляторы. Дальнейшим развитием электронной теории является зонная теория твѐрдых тел.
4.1.Основные понятия о состоянии электронов
всвободных атомах
Основное уравнение квантовой механики – уравнение Шредингера:
x, y, z |
2m |
E U x, y, z |
, |
(4.1) |
||
|
2 |
|||||
|
|
|
|
|||
|
! |
|
|
|
||
где m – масса электрона; Е – полная энергия электрона; U – потенциаль-
ная энергия электрона; 


 ; (x,y,z) называется
; (x,y,z) называется
амплитудной волновой функцией.
Рис. 4.1. Ориентация орбитального момента (а) и спина (б) относительно выбранного направления Н
33

Состояние электрона в атоме определяется четырьмя квантовыми числами: главное – n (1, 2, …), определяющее энергию атома стационарно; орбитальное – l [0, 1, 2, … (n-1)], определяющее орбитальный момент количества движений электрона; магнитное – ml [-l, -(l-1), … 0, 1, 2, …, l], определяющее ориентацию орбитального момента количества движений электрона относительно Н, и спиновое – S, определяющее ориентацию собственного момента количества движений электрона.
pl ! |
l |
l |
|
(4.2) |
|
lн |
|
l ! |
|
(4.3) |
|
psн |
s |
s |
1 |
(4.4) |
|
2 |
|||||
|
|
|
|
Таблица 4.1
Схема расположения энергетических уровней в свободных атомах
Энергетические |
Кратность |
Полное число |
Расщепление уровней |
|
|||
уровни |
вырождения |
электронов |
|
при снятии |
ml |
||
и их обозначение |
g=(2l+1) |
на уровне |
вырождения g=(2l+1) |
||||
|
|||||||
Е(n,l) |
уровней |
n=2(2l+1) |
|
подуровней |
|
||
|
|
|
|
|
|
||
E(1,0) 1s |
1 |
2 |
1s |
____________________ |
0 |
||
|
|
|
|
|
|
||
E(2,0) 2s |
1 |
2 |
2s |
____________________ |
0 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
____________________ |
+1 |
|
E(2,1) |
2p |
3 |
6 |
2p |
_____________ |
0 |
|
|
|
|
|
|
___________ |
-1 |
|
|
|
|
|
|
|
|
|
E(3,0) |
3s |
1 |
2 |
3s |
____________________ |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
____________________ |
+1 |
|
E(3,1) |
3p |
3 |
6 |
3p |
_____________ |
0 |
|
|
|
|
|
|
___________ |
-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
____________________ |
+2 |
|
|
|
|
|
|
_____________ |
+1 |
|
E(3,2) |
3d |
5 |
10 |
3d |
___________ |
0 |
|
|
|
|
|
|
_____________ |
-1 |
|
|
|
|
|
|
___________ |
-2 |
|
|
|
|
|
|
|
|
|
Уровни s – невырожденные.
Вырождение – число состояний электрона, имеющих одинаковую энергию. Вырождение снимается при помещении атома в сильное поле (например магнитное поле).
34
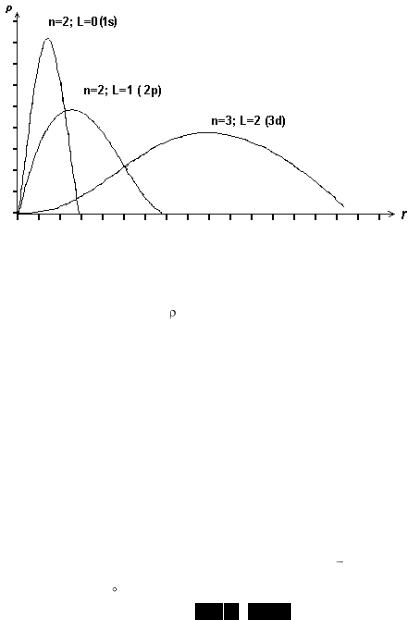
Рис. 4.2. Плотность вероятности нахождения электрона от r для некоторых орбит
Вероятность нахождения электрона в атоме или плотность вероятности нахождения электрона на расстоянии r от ядра атома имеет вид, изображенный на рис. 4.2, т.е. орбита электрона определяется не траекторией, как модели Бора, а в виде облака вероятности.
4.2.Обобществление электронов в кристалле
Вкристалле расстояния между атомами малы и каждый атом испытывает сильное воздействие от поля соседних атомов. Чтобы проследить это воздействие, рассмотрим идеализированный пример. Расположим N атомов Na в виде пространственной решѐтки, но на столь больших расстояниях, что взаимодействие их будет пренебрежимо мало. В этом случае энергетические состояния в каждом атоме будут такие, как
всвободном атоме (Na – 11 электронов).
На рис. 4.3 а показана энергетическая схема двух таких атомов. Каждый из них представляет собой потенциальную яму, внутри которой уровни 1s2, 2s2, 2p6, и 3s4. Высота потенциального барьера U для разных электронов разная, она равна расстоянию этих уровней 0 0. Потенциальный барьер препятствует свободному переходу электронов от атома к атому. При r=30 A переход 3s электронов от атома к атому может
быть в среднем 1 раз за 1020 лет: |
r 2 |
. |
|
35 |
|

a) |
б) |
Рис. 4.3. Энергетическая схема атомов Na при r > a и в кристаллической решетке при r = a
Теперь будем сжимать решѐтку. По мере сближения между атомами растѐт взаимодействие. Потенциальные кривые (рис. 4.3 б) соседних атомов перекрываются и налагаются друг на друга. Получаются результирующие кривые, проходящие ниже уровня 0  0. Таким образом, уменьшается высота потенциального барьера. Для электронов 3s потенциальный барьер отсутствует. Поэтому эти электроны могут беспрепятственно перемещаться от одного атома к другому. Электронные облака 3s настолько перекрыты, что образуют равномерную плотность в промежутке между атомами. Эти электроны называют свободным или электронным газом. Для 2p и 2s высота потенциального барьера тоже уменьшилась. Поэтому у них тоже появляется вероятность освободиться.
0. Таким образом, уменьшается высота потенциального барьера. Для электронов 3s потенциальный барьер отсутствует. Поэтому эти электроны могут беспрепятственно перемещаться от одного атома к другому. Электронные облака 3s настолько перекрыты, что образуют равномерную плотность в промежутке между атомами. Эти электроны называют свободным или электронным газом. Для 2p и 2s высота потенциального барьера тоже уменьшилась. Поэтому у них тоже появляется вероятность освободиться.
4.3. Энергетический спектр электронов в кристалле (энергетические зоны)
Из предыдущей главы следует, что за счѐт взаимодействия атомов, энергетические уровни, бывшие у свободных атомов, расщепляются. Движение электронов в атоме описывается уравнением Шредингера (4.1). Если обобществлѐнные электроны сохраняют достаточно сильную связь с атомами, то их потенциальную энергию можно представить:
U |
a |
U , |
(4.5) |
|
|
|
где Uа – потенциальная энергия электрона в свободном атоме; а – поправочный член, учитывающий влияние соседей;
Ua – периодическая функция с периодом, равным параметру решѐтки (рис. 4.4).
36

Рис. 4.4. Периодичность функции Uа в кристалле
В качестве нулевого приближения принимаем U = 0, тогда можно использовать волновую функцию как и для свободного атома. Различие между кристаллом и изолированным атомом в следующем: если в изолированном атоме уровень энергии Е(nl) является единственным, то в кристалле из N атомов он повторяется N раз, иначе говоря, каждый уровень изолированного атома оказывается N кратно вырожденным. Такое вырождение называется перестановочным. Если теперь учесть U, то при сближении атомов и образовании решѐтки каждый атом испытывает влияние соседей. Это приводит к снятию вырождения, поэтому каждый энергетический уровень E(nl) свободного атома расщепляется на N близко расположенных подуровней, образуя энергетическую зону. Если энергетический уровень имел кратность вырождения g = (2l + 1), то, следовательно, зона будет иметь Ng подуровней. Так уровень s даѐт зону S, состоящую из N подуровней, способную вместить 2N электронов в p–зоне – 3N подуровней с 6N электронами. Расстояние между подуровнями мало; так, в кристалле объѐмом 1м3 имеется 1028 атомов, при ширине зоны ~1эВ расстояние между подуровнями ~ 10-28эВ, т.е. настолько мало, что зону можно считать непрерывной. Однако учитывая, что число уровней конечно, следует иметь в виду их дискретный характер (рис. 4.5).
Рис. 4.5. Схема образования энергетических зон и дискретных уровней
37

Между разреженными зонами расположены запрещѐнные зоны шириной Eg. На рис. 4.6 (а, б и в) приведены энергетические зоны для
Li, Be и {С, Si и Be}.
а) |
б) |
в) |
Рис. 4.6. Энергетические зоны и уровни для лития (а), бериллия (б) и кремния (в)
С увеличением энергии электрона ширина разрешенных зон увеличится, а запрещенных – уменьшится.
4.4. Зависимость энергии электрона от волнового вектора
Итак, энергетический спектр электронов в кристалле имеет зонный характер. Выясним, как зависит энергия электронов от их импульса р внутри каждой зоны.
4.4.1. Электроны в кристалле совершенно свободны
Это простейший случай, тогда уравнение (4.1) для одномерного случая (U = 0):
|
d 2 |
|
2m |
E |
. |
(4.6) |
|||
|
dx2 |
|
|
! |
|||||
|
|
|
|
|
|
||||
Решением (4.6) является |
|
|
|
|
|
|
|
||
|
|
|
A l ikx |
|
(4.7) |
||||
и |
|
|
|
|
|
|
|
||
|
|
E |
|
p 2 |
|
|
|||
|
|
|
|
|
, |
|
(4.8) |
||
|
|
|
2m |
|
|||||
то есть электрон обладает только кинетической энергией.
38

Согласно уравнению де Бройля,
|
p |
h |
2 |
|
|
!k , |
(4.9) |
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
где k – волновое число. |
|
|
|
|
|
|
|
|
|
Подставив (4.9) в (4.8), получим |
|
|
|
|
|||||
|
|
|
|
2 |
|
|
|
|
|
|
|
E |
! |
k2 |
, |
(4.10) |
|||
|
|
|
|
||||||
|
|
2 |
|||||||
|
|
|
|
|
|
|
|
||
то есть |
(рис. 4.7). |
|
|
|
|
|
|
|
|
Рис. 4.7. Дисперсия Е = f(k) |
|
и вероятность обнаружения электрона |
* = f(x) |
A2 cos 2 kx sin 2 kx A2 |
(4.11) |
Вероятность нахождения электрона в координатах х можно найти из (4.7) (4.11), т.е.  * не зависит от х. Это означает, что для свободного электрона все точки х равновероятны.
* не зависит от х. Это означает, что для свободного электрона все точки х равновероятны.
4.4.2. Почти свободные электроны
На самом деле электроны в кристалле не совсем свободны и двигаются в периодическом потенциальном поле кристалла. На рис. 4.8 показана зависимость потенциальной энергии U в кристалле:
|
d 2 |
|
E |
U |
2m |
. |
(4.12) |
|
dx2 |
! |
|||||
|
|
|
|
|
|||
Энергия U периодически изменяется вдоль оси х, поэтому можно |
|||||||
записать: |
|
|
|
|
|
||
|
U x |
|
na |
|
x , |
(4.13) |
|
где а – параметр решѐтки (n=1,2,3…).
39

Рис. 4.8. Периодическая функция |
|
* в кристалле |
|
|
В связи с этим следует ожидать, что вероятность нахождения элек- |
||||
трона будет тоже периодической, поэтому для |
можно записать: |
|
||
|
x eikx |
– |
|
(4.14) |
функция Блоха, и вероятность |
|
|
|
|
* x |
2 x eikx |
e ikx |
(4.15) |
|
является периодической функцией.
Периодичность  * повторяется через а, т.е. вероятности одинаковы в точках А и А , а в точках С и С
* повторяется через а, т.е. вероятности одинаковы в точках А и А , а в точках С и С вероятность
вероятность  * различна. Энерге-
* различна. Энерге-
тический спектр имеет зонный характер. Внутри каждой зоны энергия
C
оказывается периодической функцией от волнового вектора и будет соответствовать энергии
E k Ea
Ea 
 Acos ka E
Acos ka E Acos ka , (4.16)
Acos ka , (4.16)
где Еа – энергия атомного уровня; С – сдвиг уровня под влиянием соседних атомов; А – так называемый обменный интеграл, появление которого обусловлено переходом электронов от атома к атому (т.е. обмен электронами между атомами). Обменный интеграл тем больше, чем больше перекрываются волновые функции атомов, то есть чем с большей частотой атомы обмениваются электронами. Для s-состояний
AS |
0, для p-состояний AP |
0, поэтому целесообразно уравнение (4.16) |
|||
записать отдельно для s- и p–зон: |
|
|
|||
|
Es |
k |
Es |
As cos(ka) |
(4.17) |
и |
|
|
|
|
|
|
E p |
k |
p |
Ap cos(ka) , |
(4.18) |
где |
, E p Eap |
p , AS и AP – абсолютные значения А. |
|||
Для s-состояний при k = 0 |
Es min |
Es |
As , с увеличением k уменьша- |
||
|
|
|
40 |
|
|
