
Приближенные формулы для вычисления коэффициентов активности f при разной ионной силе τ раствора
|
τ ≤ 0,01 |
0,01 < τ ≤ 0,05 |
|
|
|
Таблица 4.5
Формулы для вычисления рН растворов сильных кислот и оснований
|
Кислота |
Основание |
|
|
|
|
|
|
|
В очень разбавленных растворах (при С≤10-2моль/л)fi ≈ 1 | |
|
pH = -lg [H+] |
pH = 14 + lg [OH-] |
Пример 4.7. Вычислите
активность ионов Н+
и NO![]() ,
а также рН 0,3 М раствора
HNO3.
,
а также рН 0,3 М раствора
HNO3.
Решение. Так как концентрация азотной кислоты достаточно велика, рН раствора вычисляем с учетом коэффициента активности f (см. табл. 4.5). Коэффициент активности рассчитываем согласно табл. 4.4 в зависимости от ионной силы раствора τ, которую вычисляем по формуле (4.5).
HN03 = H+ + NO3-; τ = 0,5 (0,3 • 12 + 0,3 • (-1)2) = 0,3
![]() ;
;
![]()
![]()
Активность ионов определяем по формуле (4.13):
[Н+]
= [![]() ]
=
]
=![]() =0,3
моль/л
=0,3
моль/л
![]()
Согласно табл. 4.5, рН = -lg(0,66• 0,3) = 0,7.
Пример 4.8. Вычислите рН раствора ацетата натрия, если в 250 мл раствора содержится 0,1 г соли.
Решение. В водном растворе ацетата натрия имеет место равновесие:
СН3СОО- + Н2О ↔ СН3СООН + ОН-,
т. е. гидролиз соли по аниону
(см. табл. 4.6).
![]() (см.
приложение 1).
(см.
приложение 1).
Определяют молярную концентрацию раствора CH3COONa: С CH3COONa =ν . 1000/250, ν = 0,1/82 = 0,001 моль — количество вещества, содержащееся в 250 мл раствора (82 — молярная масса СН3COONa). Следовательно, ССНзС00№ =0,001.1000/250 = 0,004 моль/л.
Согласно табл. 4.6, pH
= 7 +
![]() 4,76
+
4,76
+![]() lg
0,004 = 8,18.
lg
0,004 = 8,18.
Пример 4.9. Сколько миллилитров 0,1 М раствора NH4Cl надо добавить к 50 мл 0,1 М раствора аммиака, чтобы получился буферный раствор с рН 9,3?
Решение. Концентрация NH4OH в буферной смеси NH4OH + NH4Cl будет определяться соотношением: N1 • V1 = N2 • V2, следовательно,
СNн4он =0,1-50/(50 + VC), СNH4Cl =0,1.VC/(50 + VC),
где VC — добавленный объем раствора соли NH4Cl (мл).
Учитывая pKNH4OH = 4,76 (см. приложение 1), согласно табл. 4.7, можно записать:
9,3 = 14 - 4,76 + lg (0,1 . 50/0,1 . VC);
lg (50/Vc) = 0,06; 50/VC =100,06; Vc = 43,5 мл.
Пример 4.10. Приготовьте 20 мл буферного раствора с рН 4,0.
Решение. Выбирают уксусную или муравьиную кислоту (так как рКсн3 соон = 4,76, а рКHС00Н = 3,75 , то есть близко к задаваемому значению рН) и соль CH3COONa или HCOONa. Допустим, выбрали СН3СООН и CHaCOONa равных концентраций. В этом случае концентрации компонентов в уравнении табл. 4.7 можно заменить на соответствующие объемы:
![]() ;
;
 ;
;
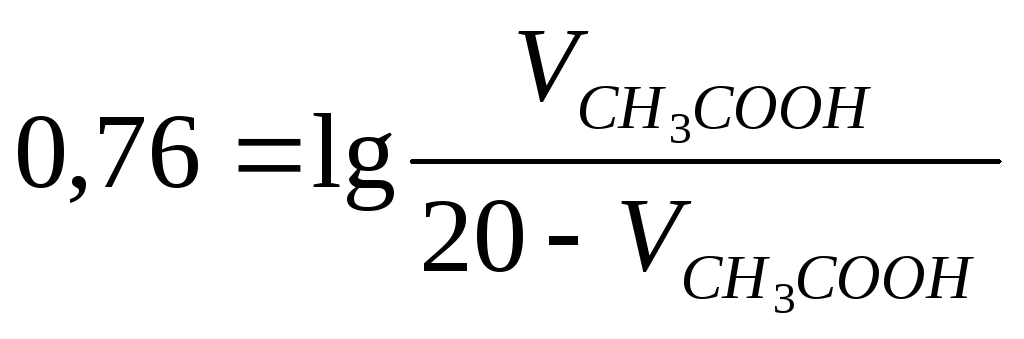 ;
100,76=
;
100,76= ;
5,75=
;
5,75=

Откуда
![]() =17,04
мл, следовательно,
=17,04
мл, следовательно,![]() =20-17,04=2,96
мл.
=20-17,04=2,96
мл.
Выполнить задания
1. Вычислите рН следующих растворов:
• 0,4% гидроксида натрия, плотность 1,002 г/см3;
• 0,74% гидроксида калия, плотность 1,004 г/см3;
• 0,1 М азотистой кислоты;
• 0,2 М цианистоводородной кислоты;
• 0,01 М муравьиной кислоты;
• 0,1 М фенола;
• 0,02 М бензойной кислоты;
• 0,1 М гидроксиламина;
• 0,2 М анилина.
2. Вычислите рН среды в 0,1 М растворах следующих протолитов: цианида калия; сульфита натрия; гидросульфита натрия; карбоната натрия; гидрокарбоната натрия; карбоната аммония; фосфата натрия.
3. Вычислите рН среды, если навеску 0,05 г нитрата аммония растворили в 100 мл раствора.
4. Вычислите степень диссоциации в 0,01 М растворах: азотистой кислоты; уксусной кислоты; синильной кислоты; гидроксида аммония; анилина; гидроксиламина.
5. Вычислите кажущуюся степень диссоциации в 0,5 М растворах: а) соляной кислоты при рН 0,37; б) гидроксида калия при рН 13,5.
6. Вычислите концентрацию ионов водорода и гидроксила в растворе, рН которого равен: 2; 9; 6.
7. Вычислите рН смеси, содержащей равные объемы 5% растворов уксусной кислоты и ее натриевой соли.
8. Вычислите рН 0,001 М раствора гидроксида аммония в присутствии 0,1 М раствора хлорида аммония.
9. Вычислите рН 0,01 М раствора иодноватистой кислоты (НIO) в присутствии О,1 М раствора ее соли (NaIO).
10. Вычислите рН смеси аммиака и хлорида аммония, если она приготовлена из 0,1 М растворов этих веществ в отношении 1 : 9.
11. Вычислите рН смеси, если к 200 мл 0,1 М раствора NH40H добавить 2,14 г хлорида аммония.
Творческие задания
1) Какую навеску хлорида аммония следует растворить в 100 см3 раствора, чтобы рН раствора был равен 6?
2) В каком объеме следует растворить навеску ацетата натрия 0,03 г, чтобы получить раствор с рН 8?
3) Приготовьте 30 мл буферного раствора с рН 9,0.
4) Сколько граммов безводного ацетата аммония надо добавить к 200 мл 0,1 М раствора уксусной кислоты, чтобы получился буферный раствор с рН 3,87?
5) Вычислите рН 0,0625 М раствора этиламина C2H5NH3OH, если подвижность иона C2H5NH3+ равна 58,6, а эквивалентная электрическая проводимость этого раствора составляет 20,99 Ом-1 . см2.
6) Вычислите рН 0,1 М раствора НIO3, если удельная электропроводимость этого раствора 4,02 Ом-1 . см2, а подвижность иона IO3- равна 41 Ом-1 . см2.
7) Вычислите константу диссоциации гидроксида аммония, если эквивалентная электрическая проводимость 0,0082 М раствора NH4OH равна 12,43 Ом-1 . см2.
Приложение 1
Константы диссоциации важнейших кислот и оснований при 250 С
|
|
Название |
Формула |
Константа диссоциации (К) |
pK=-lg K |
|
Кислоты | ||||
|
1 |
Азотистая |
HNO2 |
5,1 .10-6 |
5,3 |
|
2 |
Бензойная |
C6H5COOH |
6,3 .10-5 |
4,2 |
|
3 |
Йодноватистая |
HIO |
2,3 .10-11 |
10,64 |
|
4 |
Кремниевая (орто) К1 К2 |
H2SiO3 |
1,0 .10-10 2,0 .10-12 |
10,0 11,70 |
|
5 |
Муравьиная |
HCOOH |
1,8 .10-4 |
3,75 |
|
6 |
Сернистая К1 К2 |
H2SO3 |
1,7 .10-2 6,2 .10-8 |
1,76 7,30 |
|
7 |
Сероводородная К1 К2 |
H2S |
1,0 .10-7 1,3 . 10-13 |
6,99 12,89 |
|
8 |
Цианистоводородная |
HCN |
6,2 . 10-10 |
9,21 |
|
9 |
Угольная К1 К2 |
CO2(ag) + H2O |
4,5 .10-7 4,8 .10-11 |
6,35 10,32 |
|
10 |
Уксусная |
CH3COOH |
1,74 .10-5 |
4,76 |
|
11 |
Фенол |
C6H5OH |
1,0 .10-10 |
10,0 |
|
12 |
Фосфорная (орто) К1 К2 К3 |
H3PO4 |
7,6 .10-3 6,2 .10-8 4,2 .10-13 |
2,12 7,21 12,38 |
|
13 |
Хлорноватистая |
HClO |
5,0 .10-8 |
7,30 |
|
14 |
Хромовая К1 К2 |
H2CrO4 |
1,1 .10-1 3,2 .10-7 |
0,98 6,50 |
|
15 |
Щавелевая К1 К2 |
H2C2O4 |
5,6 .10-2 5,4 .10-5 |
1,25 4,27 |
|
Основания | ||||
|
1 |
Аммиака раствор |
NH3 + H2O |
1,76 .10-5 |
4,755 |
|
2 |
Анилин |
C6H5NH2 |
4,2 .10-10 |
9,38 |
|
3 |
Гидроксиламин |
NH2OH + H2O |
9,6 .10-9 |
8,02 |
Занятие 3
Схема 5.1
1. Составляют уравнения диссоциации электролитов, присутствующих в растворе, ионы которых участвуют в реакции осаждения.
2. Составляют ионное уравнение образования или растворения осадка в зависимости от условия задачи.
3. Записывают выражение произведения растворимости в соответствии с ионным уравнением, описывающим диссоциацию осадка, одновременно находят значение ПР по таблице.
4. Вычисляют значения равновесных концентраций ионов либо по заданным концентрациям, исходя из 100%-ной диссоциации в случае сильных электролитов, либо с учетом константы диссоциации (для слабых электролитов). Концентрацию, выраженную по условию задачи в граммах на литр или в любых других единицах, пересчитывают в моль/л.
5. Сопоставляя заданные концентрации и условия задачи, составляют алгебраическое уравнение, по которому определяют искомую величину.
Пример 5.1. Вычислите произведение растворимости BaS04, если
в 100 мл насыщенного раствора при 20 °С содержится 0,23 мг соли.
Решение. Вычисления начинают в данном случае с пункта 2 схемы 5.1.
2. BaS04↔Ba2++S042-.
3. ПРBaSO4=[Ba2+][SO42-].
4. Пересчитывают концентрацию соли, выраженную в миллиграммах на 100 мл раствора, в моль/л. Для этого количество грамм соли в литре (0,0023 г/л) делят на молярную массу BaS04, равную 233 г/моль: 0,0023/233 – 10-5 моль/л.
Следовательно, [Ba2+] = [S042-] = 10-5 моль/л.
5. ПРBaSO4= [Ва2+].[SO42-] = 10-5 • 10-5 = 10-10.
Пример 5.2. Произведение растворимости РЬ3(Р04)2 при 25° С равно 7,9 • 10-43. Вычислите растворимость этой соли.
Решение. Вычисления начинают в данном случае с пункта 2 схемы 5.1.
2. РЬ3(Р04)2↔ЗРЬ2++2РО43-.
3 ПР РЬ3(Р04)2 ↔[РЬ2+]3 . [РО43- ]2
4. Если молярную концентрацию насыщенного раствора РЬ3(Р04)2 обозначить через х, то на основании уравнения диссоциации (см. пункт 2)равновесные концентрации ионов будут равны: [Pb2+] = 3x, [PO43-] =2x.
5. ПР РЬ3(Р04)2 =(3x)3(2x)2 108x5 = 7,9 .10 -43, откуда
х =
![]() моль/л,
что соответствует растворимостиданной соли.
моль/л,
что соответствует растворимостиданной соли.
Пример 5.3. Определите последовательность осаждения из раствора, содержащего одинаковые концентрации ионов Са2+, Ва2+, Sr2+, при действии разведенной серной кислоты.
Решение. Поскольку исходные концентрации осаждаемых ионов равны, сопоставляют величины произведений растворимости образующихся малорастворимых соединений:
![]() (см. приложение 2).
(см. приложение 2).
Следовательно, в равных условиях первым должен осаждаться BaS04, далее SrS04, затем CaS04.
Если концентрации однотипных ионов не равны, то задачи такого рода решаются на основании расчетов.
Пример 5.4. Может ли образоваться осадок Mg(OH)2, если смешать равные объемы 0,5 М MgCI2 и 0,1 М раствора NH4OH?
Решение. Согласно схеме 5.1,
1. MgCl2 ↔Mg2+ +2C1-, NH4OH ↔NH+ +OH-.
При сливании двух равных объемов общий объем увеличивается вдвое, а концентрация уменьшается в два раза, т. е. концентрация:
![]() ;
;
![]()
2. Mg2+ +20H-↔↓Mg(OH)2
3. ПРMg(OH)2 = [Mg2+] • [ОН-]2; ПРMg(OH)2 = 6 • 10-10 (см. приложение 2).
4. Для приближенных расчетов реакциями образования аммиачных комплексов магния можно пренебречь. Следовательно, учитывая, что MgCl2 — сильный электролит, [Mg2+] = 0,25 моль/л (см. пункт 1).
NH4OH является слабым электролитом. Концентрацию ионов аммония определяют с учетом константы диссоциации, принимая во внимание, что [NH4+] = [OH-] = x, [NH4ОН] = 0,05-x,
![]()
или
![]() ,
так как х<<0,05, величиной х в знаменателе
можно пренебречь, отсюда
,
так как х<<0,05, величиной х в знаменателе
можно пренебречь, отсюда
![]() или х=[ОН-]
= 9,5.
10-4
моль/л
или х=[ОН-]
= 9,5.
10-4
моль/л
5. Используя найденные значения начальных концентраций, вычисляют произведение концентрации ионов по уравнению для ПР:
[Mg2+].[OH-]2 = 0,25. (9,5.10-4)2=2,26.10-7,
полученная величина превышает табличное значение ПРMg(OH)2 =6.10-10 (см. пункт 3), т. е. раствор пересыщен, следовательно, в данных условиях будет наблюдаться образование осадка.
Пример 5.5. При каком значении рН начнется выпадение осадка Fe(OH)2 из 0,1 М раствора FeS04 при добавлении раствора NaOH?
Решение. В соответствии со схемой 5.1
1. FeS04=Fe2++S042-, NaOH = Na++OH-.
2. Fe2+ + 20H-↔↓Fe(OH)2.
3. ПРFe(OH)2= [Fe2+] . [ОН-]2; ПРFe(OH)2= 1,1 . 10-15 (см. приложение 2).
4. FeS04 — сильный электролит, [Fe2+]=0,1 моль/л (см. пункт 1).
5. Исходя из выражения для ПР, получают:
0,1 [ОН-]2
= 1,1 • 10-15,
откуда [ОН-]
=
![]() =10-7
=10-7
Величину рН вычисляют по формуле:
pH = 14+lg[OH-]; pH = 14 + lgl0-7 = 14-7=7.
Таким образом, при рН 7 из данного раствора начнется осаждение Fe(OH)2.
Пример 5.6. Рассчитайте растворимость сульфата свинца: а) в воде при 25 0С; б) в присутствии 0,1 М раствора KN03.
Решение. Ход вычислений и в случае «а», и в случае «б» соответствует схеме 5.1, начиная с пункта 2.
а) Растворимость соли в воде:
2. PbSO4↔Pb2++S042-
3. ПРPbSO4 = [Pb2+] • [ SO42-], ПРPbSO4 = 1,6 • 10-8 (см. приложение 2).
4. Пусть молярная концентрация насыщенного раствора PbSO4 равна x, тогда [РЬ2+] = [SO42-] = х, согласно пункту 2.
5
ПРPbSO4
= x2
= l,6.10-8,
откуда x
=
![]() =1,27.
10-4
моль/л, что соответствует растворимости
данной соли в воде.
=1,27.
10-4
моль/л, что соответствует растворимости
данной соли в воде.
б)Растворимость сульфата свинца в 0,1 М растворе нитрата калия:
В этом случае необходимо
учесть коэффициенты активности. Для
этого находят ионную силу раствора τ,
она будет определяться концентрацией
KNO3
в растворе. Концентрации ионов [РЬ2+]
и [SO42-],
образующихся при растворении PbS04,
настолько малы, что не будутвлиять
на величину ионной силы раствора. По
формуле τ =
![]() ,τ
= 0,5 • (0,1 • 12
+ 0,1 • (-1)2)
= 0,1. При ионной силе 0,1 коэффициенты
активности ионов РЬ2+
и SO42-
равны 0,33.
,τ
= 0,5 • (0,1 • 12
+ 0,1 • (-1)2)
= 0,1. При ионной силе 0,1 коэффициенты
активности ионов РЬ2+
и SO42-
равны 0,33.
В соответствии с уравнением (5.2) в данных условиях
ПРPbSO4
=
![]() или
или
ПРPbSO4
=
![]()
учитывая пункт 4, ПРPbSO4
=
![]() 1,6.
10-8 =
х .
х .
0,33 .
0,33
1,6.
10-8 =
х .
х .
0,33 .
0,33
откуда х =
![]() моль/л,
что соответствует растворимости
сульфата свинца в 0.1М
растворе нитрата
калия.
моль/л,
что соответствует растворимости
сульфата свинца в 0.1М
растворе нитрата
калия.
Таким образом, растворимость PbS04 в 0,1 М растворе KN03 b З раза больше (3,8 • 10-4• / 1,27 . 10-4 = 3), чем в чистой воде.
Пример 5.7. Растворимость оксалата кальция СаС204 в воде равна 4,8 • 10-5 моль/л. Вычислите растворимость этой соли в 0,01М растворе (NH4)2C204.
Решение. Расчет выполняют по схеме 5.1.
1. (nh4)2c2o4↔2NН4++ С2О42-
2 СаС2О4↔ Са2++ С2О42-
ПРСаС2О4 = [Са2+] [С2О42-], ПРСаС2О4 = 2,3 • 10-9 (см. приложение 2).
3. Если молярную концентрацию насыщенного раствора СаС204 обозначить через х, тогда [Са2+] = х (в соответствии с пунктом 2); а общая концентрация оксалат-ионов будет равна 0,01 моль/л за счет диссоциации оксалата аммония (см. пункт 1) и х моль/л за счет растворимости оксалата кальция (см. пункт 2), т. е. [C2O42-] = (0,01 + х) моль/л.
4 ПРСаС2О4= x(0,01+х) = 2,3 .10-9.
Поскольку х < 0,01, можно сделать упрощение х . 0,01 = 2,3 • 10-9, отсюда х= 2,3 . 10 -7 моль/л, что соответствует растворимости осадка СаС204 в 0,1 М растворе (NH4)2C204. Сравнивая это значение с растворимостью данного осадка в воде, находят, что растворимость снизилась почти в 210 раз (4,8 • 10 -5 / 2,3 • 10-7 ≈ 210).
Однако следует отметить, что в некоторых случаях при введении в раствор избыточного количества ионов, одноименных с осадком, растворимость осадка может увеличиться вследствие образования растворимых комплексов.
Пример 5.8. Определите концентрацию раствора аммиака, необходимую для полного растворения осадка AgCl. Концентрация образовавшегося раствора комплексной соли должна быть не ниже 0,01 моль/л.
Решение. Осадок AgCl в аммиачном растворе будет растворяться за счет связывания ионов Ag+ в виде комплекса [Ag(NH3)2]+
Вычисления выполняются по схеме 5.1.
В образовавшемся 0,01 М растворе комплексной соли будут протекать следующие процессы:
[Ag(NH3)2]Cl ↔[Ag(NH3)2]+ + Cl-,
[Ag(NH3)2]+↔Ag+ + 2NH3.
Это равновесие характеризуется константой диссоциации комплекса КД=9,3 . 10-8.
2. AgCl↔Ag++Cl-, Ag++2NH3+↔[Ag(NH3)2]+ (для упрощения расчетов не учитывают ступенчатый характер образования комплексного иона).
3. ПРAgCl = [Ag+]• [CI-], ПРAgCl = 1,78 • 10-10 (см. приложение 2).
4. Исходя из 100%-ной диссоциации комплексной соли (первое уравнение пункта 1),
[С1-] = 0,01 моль/л, следовательно,
![]()
Согласно уравнению 2 пункта
1,
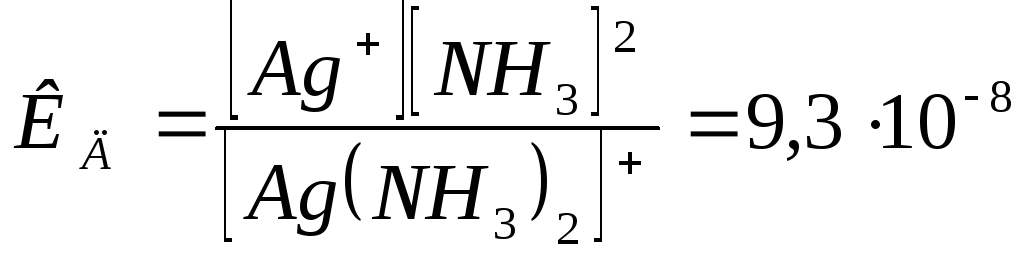 ,
,
отсюда [NH3]
=![]() = 0,228 моль/л.
= 0,228 моль/л.
5. Таким образом, концентрация раствора аммиака должна быть не ниже 0,228 моль/л.
Вопросы и задания
1. В каком случае растворимость указанных веществ больше и почему: Mg(OH)2 при рН 7 или 10;
Fe(OH)2 при рН 5 или 12; Fe(OH)3 при рН 6 или 9; CoS при рН 2 или 7.
2. Определите произведение растворимости указанных веществ, если:
• растворимость AgCl равна 1,33 • 10-5 моль/л;
• растворимость AgBr равна 7,3 • 10-7 моль/л;
• растворимость СаС204 равна 4,8 • 10-5 моль/л;
• растворимость Fe(OH)3 равна 2 • 10-8 г/л;
• растворимость Ag3P04 равна 1,94 • 10-3 г/л;
• растворимость Рb3(Р04)2 равна 1,5 • 10-9 моль/л.
3. По соответствующим величинам ПР рассчитайте:
• растворимость CaS04 в моль/л;
• растворимость FeS в г/л;
• растворимость PbS04 в г/л;
• сколько грамм ВаСг04 содержится в 500 мл насыщенного раствора этой соли;
• сколько моль PbS04 содержится в 200 мл насыщенного раствора этой соли;
• растворимость AgCl в 0,01 М растворе NaCl;
• растворимость СаС204 в 0,01 М растворе (NH4)2C204;
• растворимость РЫ2 в 0,02 М растворе A1(N03)3;
• влияние на растворимость СаС204 присутствия в растворе 0,1 моль/л КС1;
• во сколько раз повысит растворимость AgCNS присутствие в растворе 0,01 М KN03;
• каково влияние присутствия в растворе 2,9 г/л NaCl на растворимость BaS04.
Творческие задания
1) В каком из указанных растворов будет более полное осаждение (укажите почему):
• бария хроматом в 2 М СН3СООН или 2 М НС1;
• ионов магния щелочью в чистой воде или в NH4C1;
• ионов бария сульфатом в НС1 или NaCl.
2) Вычислите произведение растворимости, если:
• насыщенный раствор содержит 3,84 мг PbSO4 в 100 мл;
• для насыщения 200 мл раствора требуется 0,57 мг ВаСг04;
• в 2 л насыщенного раствора содержится 0,124 г СаС03.
3) Рассчитайте, сколько граммов вещества содержится в 500 мл насыщенного раствора: CdC03; PbS04; AgCl; Co(OH)2; Fe(OH)2; SrCr04; AgSCN; Pb(OH)2; PbI2; Ag2S03.
4) Выпадет ли осадок AgCl, если к 10 мл 0,01 М раствора AgN03 прибавить 10 мл 0,01 М раствора NaCl?
5) Образуется ли осадок SrS04, если смешать равные объемы 0,001 М растворов SrCl2 и K2SQ4?
6) При какой величине рН начнется осаждение Fe(OH)3 из 0,1 М раствора FeCl3 при добавлении раствора NaOH?
7) Вычислите концентрацию ионов ОН-, при которой возможно осаждение Mg(OH)2 из 0,1 М раствора MgS04.
8) В 1 л раствора содержится 20 мг Ag+ и 20 мг РЬ2+. Какая соль выпадет в осадок первой при добавлении к этому раствору по каплям К2СгО4?
