
- •У генетической информации – свой код.
- •Трансляция - один из сложнейших механизмов синтеза макромолекул.
- •Активирование аминокислот происходит в два этапа
- •Существуют два пути узнавания инициирующего кодона
- •Диссоциация рибосомы – необходимая предпосылка для инициации.
- •Малая рибосомная субъединица –главный исполнитель в сценарии инициации
- •Ингибиторы синтеза белков
- •Синтезированные на рибосомах белки доставляются к местам их деятельности разными путями.
- •Ограниченный протеолиз - обязательный механизм посттрансляционной модификации белков
- •Присоединение углеводов наиболее популярный способ пострибосомальной ковалентной модификации белков
- •Углеводы белков клеточных поверхностей ответственны за клеточную специфичность.
- •Ацилирование помогает белкам встраиваться в мембраны
- •Метилирование аминокислотных остатков в белках встречается редко
- •Фосфорилирование белков в большинстве случаев обратимый процесс
- •Сульфатирование белков пример необратимой ковалентной модификации структуры белка.
- •Пренилирование – способ «заякоривания» белка в мембранах
- •Витамин с – кофактор гидроксилирования белков.
- •Витамин к помогает белкам приобрести свойство связывать кальций.
- •Регуляция экспрессии генов
- •Регуляция на уровне транскрипции требует специфического взаимодействия днк и белков
- •Инициация транскрипции - основное место действия регуляторов на синтез белков у прокариот
- •Для инициации транскрипции у эукариот требуются дополнительные факторы
- •Регулировать экспрессию генов можно и после транскрипции
- •Аттенуация транскрипции один из возможных механизмов регуляции экспрессии генов.
- •Альтернативный сплайсинг рнк -своеобразная форма регуляции экспрессии генов
- •Транспорт рнк из ядра и последующее редактирование рнк могут быть объектом регуляции.
- •Продолжительность «жизни» иРнк можно регулировать .
Углеводы белков клеточных поверхностей ответственны за клеточную специфичность.
Антигены групп крови АВО - это углеводные половиныгликолипидов на поверхности клеток или углеводные части гликопротеинов сыворотки. Углеводная часть поверхностных антигенов эритроцитов связана со сфинголипидами, формируя класс гликосфинголипидов. Те же углеводные компоненты в составе гликопротеинов сыворотки крови названы секреторными формами. Групповая принадлежность обеспечивается особенностями структуры углеводной части
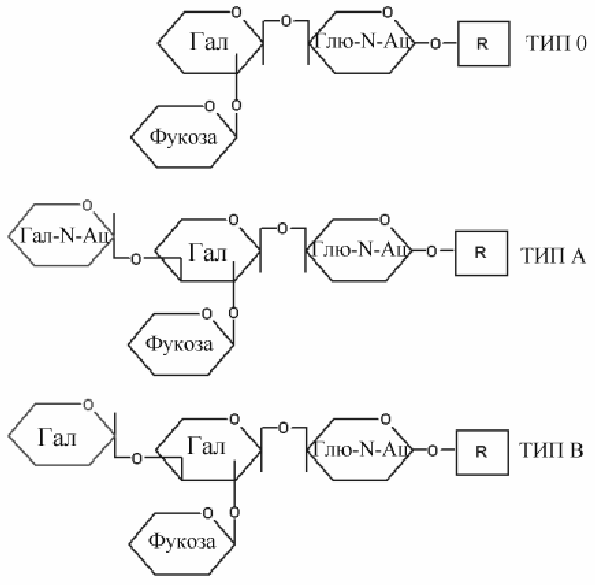
Рис.Структура углеводной части антигенов групп крови системы АВ0.
Углеводы могут присоединяться к белкам при участии липидов. Некоторые мембранные гликопротеины соединяются с мембраной при помощи липидов: белок соединяется с углеводом через фосфатидилэтаноламин, а углевод в свою очередь присоединяется к мембране через связь с фосфоатидилинозитолом. Последний выполняет роль мембранного якоря для всего гликолипопротеина. Связь называют гликозилфосфатидилинозитольгным (GPI) якорем. Один из белков, стабилизированый таким якорем к мембране эритроцитов DAF (decay-acceleratingfactor) – белок, предотвращающий лизис эритроцитов системой комплемента. Нарушение связи этого белка с мембраной отмечено при пароксизмальной ночной гемоглобинурии. Известны и другие белки использующие GPI якорь для проявления активности - ферменты АХЭ, кишечная и плацентарная щелочная фосфатаза и 5 ' нуклеотидаза, молекулы клеточной агезии N-CAM(neuralCellAdhesionMolecule) и T- Клеточные маркеры Thy1 и LFA-3 ((LymphocyteFunctionassociatedAntigen-3).
.
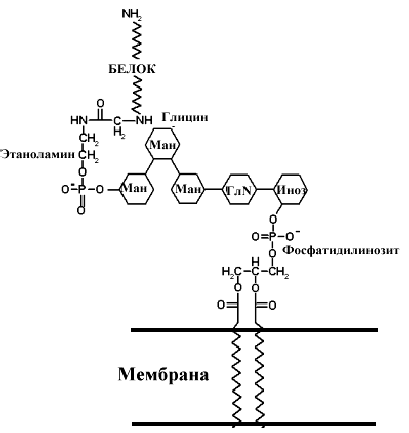
Рис.. Участие липидов в связывании углеводов и белков в белково-углеводных комплексах.
Некоторые вирусы бактерии и простейшие используют гликопротеины для проникновения в клетки. Возбудитель малярииPlasmodiumvivax, связывается с эритроцитарным хемокиновым рецептором (рецептор интерлейкина-8) при проникновении в клетку. С той же целью риновирусы используют присоединение к молекуле, участвующей в межклеточной адгезии ICAM-1. MNсистема групп крови - хорошо характеризованный набор поверхностных антигенов эритроцитов, представляющие углеводные модификации трансмембранного гликопротеина гликофорина. Гликофорин - клеточный рецептор для вируса гриппа и рецептор для вторжения эритроцита малярийным паразитомPlasmodiumfalciparum.. Helicobacter pylori - бактерия, ответственная за хронический активный гастрит и язвенную болезнь желудка и двеннадцатиперстной кишки может быть причиной аденокарциномы желудка. Эта бактерия присоединяется к гликопротеину на поверхности слизистых клеток желудка (антиген группы крови системы Льюиса),.
Нарушение распада белково-углеводных комплексов проявляется в форме тяжелых заболеваний.Распад гликопротеинов протекает в лизосомах при участии специфических гидролаз, называемых гликозидазами. Экзогликозидазы удаляют последовательно моносахариды с нередуцирующего конца олигосахарида и проявляют выраженную субстратную специфичность. Эндонуклеазы, напротив, расщепляют гликозидные связи внутри молекулл и проявляют более широкую субстратную специфичность. Несколько врожденных заболеваний, включающих накопление продуктов распада гликопротеинов, были идентифицированы у людей. Эти болезни результат дефектов в генах кодирующих специфические гликозидазы, что приводит к неполному распаду и последующему накоплению частично разрушенных гликопротеинов. Как общий класс, такие болезни известны как лизосомные болезни накопления и включают болезни известные как муколипидозы как следствие неполного распада углеводной части гликолипидов.
Распад белково-углеводных комплексов катализируется с участием большого набора лизосомальных гидролаз, включающих a-нейраминидазу, -галактозидазу, -гексозаминидазу, - и -маннозидазы, -фукозидазу, эндо- -N-ацетилглюкозаминидазу и аспартилглюкозаминидазу.
Генетически детерминированный дефект указанных ферментов приводит к нарушению распада углеводной части гликопротеинов. Накопление последних в лизосомах приводит к различным проявлениям заболеваний.
Основные признаки болезней связанные с недостаточностью гликозидаз выглядят следующим образом:
Аутосомно-рецессивное наследование.
Различные проявления и нарушения психики.
Варианты форм от медленного до быстрого прогрессирования.
Вакуолизация некоторых клеток, видимая под микроскопом.
Присутствие ненормальных продуктов распада в моче.
Постановка диагноза по исследованию активности соответствующих ферментов (чаще всего в лейкоцитах).
Возможна пренатальная диагностика анализируя соответствующие ферменты.
Из наиболее известных заболеваний этого типа можно выделить маннозидозы, фукозидозы, сиалидозы и аспартилглюкозаминурия. Их причиной является недостаточность соответственно -манозидазы, --фукозидазы, -нейраминидазы и аспартилглюкозаминидазы. Эти заболевания проявляются по разному, иногда их относят к муколипидозам
|
Таблица. Заболевания, связанные с недостапточностью ферментов, катализирующих распад N-связанных гликопротеинов | ||
|
Заболевание |
Дефицит фермента |
Проявление и комментарий |
|
Аспартилгликозаминурия |
аспартилгликозаминидаза |
Прогрессивное замедление умственного и физического развития, замедленная речь, грубые черты лица |
|
-Маннозидоз |
-маннозидаза |
Прежде всего неврологические дефекты, ухудшение речи |
|
-Маннозидоз |
-Маннозидаза |
Замедление умственного развития, множественный дистоз, гепатоспленомегалия , потеря слуха, замедленная речь |
|
GM1 Ганглиозидоз |
-галактозидаза |
Также обозначаемая как болезнь накопления гликосфинголипидов |
|
GM2 Ганглиозидоз (болезнь Sandhoff-Jatzkewitz) |
-N-ацетилгексозаминидазы A и B |
также обозначаемая как болезнь накопления гликосфинголипидов |
|
Сиалидоз (муколипидоз I) |
нейраминидаза |
Врожденный асцит, гепатоспленомегалия, замедление умственного и физического развития |
|
Фукозидоз |
-фукозидаза |
Прогрессивное замедление умственного развития , замедление роста, инфекции пазух носа и легких |
Туникамицин, дезоксиноджиримицин и сваинсонин - это примеры соединений, влияющих на гликозилирование. Их используют в эксперименте для ингибирования различных этапов синтеза гликопротеинов. Например, если клетки растут в присутствии туникамицина, нарушается процесс гликозилирования. При этом увеличивается чувствительность таких белков к протеолизу, хотя механизмы секреции значительно не нарушаются
