
- •У генетической информации – свой код.
- •Трансляция - один из сложнейших механизмов синтеза макромолекул.
- •Активирование аминокислот происходит в два этапа
- •Существуют два пути узнавания инициирующего кодона
- •Диссоциация рибосомы – необходимая предпосылка для инициации.
- •Малая рибосомная субъединица –главный исполнитель в сценарии инициации
- •Ингибиторы синтеза белков
- •Синтезированные на рибосомах белки доставляются к местам их деятельности разными путями.
- •Ограниченный протеолиз - обязательный механизм посттрансляционной модификации белков
- •Присоединение углеводов наиболее популярный способ пострибосомальной ковалентной модификации белков
- •Углеводы белков клеточных поверхностей ответственны за клеточную специфичность.
- •Ацилирование помогает белкам встраиваться в мембраны
- •Метилирование аминокислотных остатков в белках встречается редко
- •Фосфорилирование белков в большинстве случаев обратимый процесс
- •Сульфатирование белков пример необратимой ковалентной модификации структуры белка.
- •Пренилирование – способ «заякоривания» белка в мембранах
- •Витамин с – кофактор гидроксилирования белков.
- •Витамин к помогает белкам приобрести свойство связывать кальций.
- •Регуляция экспрессии генов
- •Регуляция на уровне транскрипции требует специфического взаимодействия днк и белков
- •Инициация транскрипции - основное место действия регуляторов на синтез белков у прокариот
- •Для инициации транскрипции у эукариот требуются дополнительные факторы
- •Регулировать экспрессию генов можно и после транскрипции
- •Аттенуация транскрипции один из возможных механизмов регуляции экспрессии генов.
- •Альтернативный сплайсинг рнк -своеобразная форма регуляции экспрессии генов
- •Транспорт рнк из ядра и последующее редактирование рнк могут быть объектом регуляции.
- •Продолжительность «жизни» иРнк можно регулировать .
Трансляция - один из сложнейших механизмов синтеза макромолекул.
Н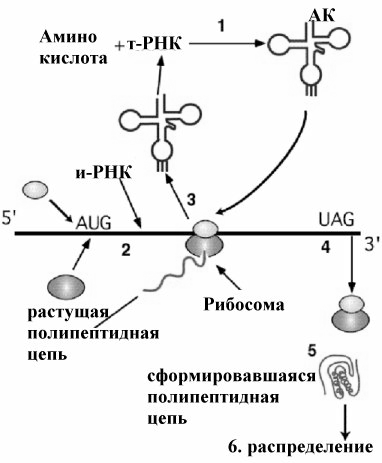 есмотря
на кажущуюся простоту образования
пептидной связи, механизм трансляции
оказался одним из самых сложных
биосинтетических процессов в клетке.
Он включал и
есмотря
на кажущуюся простоту образования
пептидной связи, механизм трансляции
оказался одним из самых сложных
биосинтетических процессов в клетке.
Он включал и
Рис.. Основные этапы синтеза белков в клетке.
процессы, протекающие в цитозоле и процессы, протекающие на рибосомах. Можно выделить несколько этапов процесса синтеза молекулы белка. (см рис ).
процессы, протекающие в цитозоле и процессы, протекающие на рибосомах. Можно выделить несколько этапов процесса синтеза молекулы белка. (см рис ).
Процесс трансляции начинается с активирования аминокислот, в котором участвуют тРНК, аминокислоты и специфические ферменты аминоацил-т-РНК синтетазы (АРСазы). Образующиеся на этом этапе аминоацил-тРНК вступают во второй этап – инициацию, при которой молекула иРНК соединяется с малой рибосомной субъединицей.
Особая инициирующая тРНК связывает малую рибосомную субъединицу со специфическим инициирующим кодоном на иРНК. Присоединение большой субъединицы завершает образование инициирующего комплекса. специальные внерибосомные факторы инициации способствуют протеканию этому этапу. Образование инициирующего комплекса - один из самых медленных этапов в синтезе. Далее следует этап элонгации. Каждая очередная аминокислота присоединяется к карбоксильному концу растущего полипептида с помощью циклического процесса, состоящего из трех последовательных этапов: связывания аминоацил-тРНК, образования пептидной связи и транслокации рибосомы. Рибосома перемещается вдоль молекулы иРНК в направлении 5'3' от одного кодона к другому до тех пор, пока не будет достигнут какой-либо из трех терминирующих кодонов. Этот этап один из самых быстрых. Этап терминации начинается с присоединения к терминирующим кодонам фактора освобождения , останавливающего трансляцию и способствующего отделению образованного полипептида от рибосомы. Энергия для биосинтеза белка обеспечивается гидролизом ГТФ.
Заключительный этап - формирование пространственной структуры и процессинг белковой молекулы с целенаправленным перемещением молекул к местам их функционирования. На этом этапе молекула приобретает все необходимые структурные особенности для выполнения своих функций.
Активирование аминокислот происходит в два этапа
Р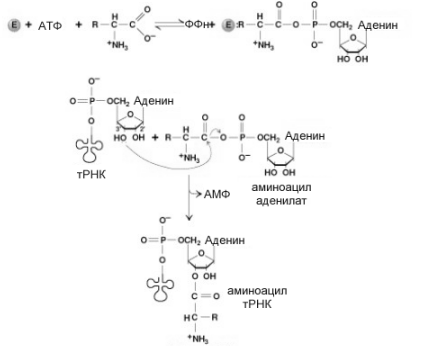 ис.
Реакции, катализируемые АРСазой.
ис.
Реакции, катализируемые АРСазой.
Активный центр АРС-азы (акивирующий фермент) имеет 4 сайта, каждый из которых специфически узнает одну из трех молекул: специфическую аминокислоту, специфическую тРНК, молекулу АТФ , используемую в качестве источника энергии и молекулу воды, используемую для гидролиза ошибочно образованного аминоациладенилата..
 На
первом этапе аминокислота взаимодействует
с АТФ, образуя промежуточное соединение
аминоацил аденилат. АТФ распадается
при этом с образованием пирофосфата,
На
первом этапе аминокислота взаимодействует
с АТФ, образуя промежуточное соединение
аминоацил аденилат. АТФ распадается
при этом с образованием пирофосфата,
Р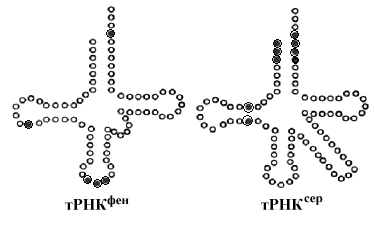 ис.
Нуклеотиды тРНК (обозначены затемненными
кружочками), участвующие в механизме
узнавания АРСазами.
ис.
Нуклеотиды тРНК (обозначены затемненными
кружочками), участвующие в механизме
узнавания АРСазами.
гидролиз которого делает этот этап необратимым. На втором этапе аминокислота в активном центре АРСазы переносится на тРНК с образованием связи между СООН группой аминокислоты и 2’или 3’ ОН группами рибозы концевого аденилового нуклеотида акцепторного участка тРНК. Сформированная таким способом аминоацил тРНК покидает активный центр АРСазы. Этому этапу принадлежит важная роль в процессах синтеза белка. По меньшей мере, в синтезе белка участвуют 20 различных аминоацил-тРНК синтетаз. Узнавание аминокислот обеспечивается специальным участком, комплементарным радикалу аминокислот. Узнавание соответствующей тРНК связано с особенностями нуклеотидного состава всей молекулы тРНК (не только структуры антикодона). На рисунке 10-5 показаны нуклеотиды транспортных РНК, придающих им специфичность при узнавании соответствующими АРСазами.
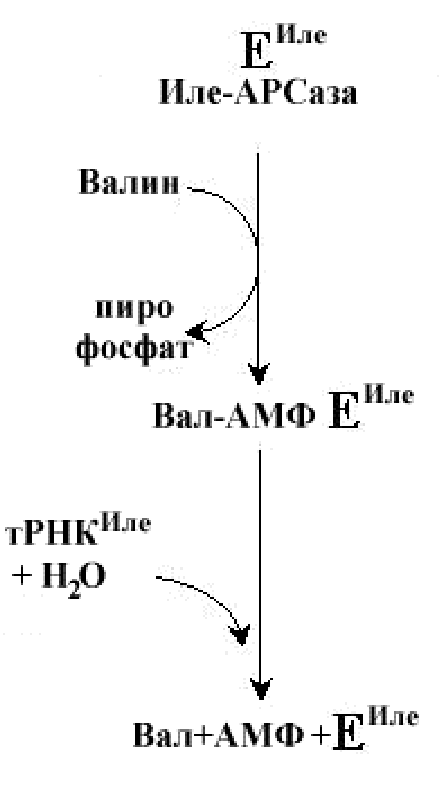
Поскольку включение аминокислоты в белок определяется кодон-антикодоновым взаимодействием, Природа отняла у АРСазы право на ошибку. Активный центр АРСазы обладает способностью узнавать ошибочное взаимодействие между аминокислотой и тРНК и исправлять ошибку, гидролизуя промежуточный продукт реакции, причем это происходит до высвобождения ферментом аминоацил-тРНК. Например, валин и изолейцин структурно похожи друг на друга и это может быть причиной ошибочного узнавания Еиле валина на первом этапе реакции, однако изолейциновая АРСаза исправляет свою ошибку, подключая гидролазную активность своего активного центра во время соединения с РНКиле. Восстановительное десульфирование свободной ЦИС- тРНКцис приводит к образованию АЛА-тРНКцис.
Последняя включала АЛА вместо ЦИС в синтезируемую молекулу белка, что указывает на важность правильного узнавания аминокислоты специфической тРНК и исправление ошибок во время работы АРСазыИнициация трансляции играет ключевую роль в сборке белка на рибосоме
Инициация трансляции - это серия молекулярных событий, происходящих с рибосомой, которая приводит к взаимодействию рибосомы с началом кодирующей нуклеотидной последовательности иРНК и последующему считыванию [трансляции] этой последовательности. Такое определение инициации трансляции дает известный специалист в области синтеза белков А.Н.Спирин. Выделяют три основных аспекта фунционального предназначения инициации трансляции
1.формирование пептидил –тРНК в качестве основного субстрата реакций транспептизации.
2.Узнавание рибосомой стартовой точки трансляции иРНК
3. Регуляция процесов трансляции.
Способность рибосомы к трансляции иРНК и направляемому ей синтезу полипептидной цепи белка требует присутствия пептидил-тРНК в качестве одного из субстратов реакции транспептидации. Однако в самом начале трансляции нет пептидил-тРНК. Для решения этой проблемы используется специальная инициирующая аминоацил-тРНК, специальные белки [факторы инициации] и специальный инициирующий участок иРНК на рибосоме. При этом инициирующая аминоацил-тРНК служит донором субстрата для образования первой пептидной связи. Эта аминоацил-тРНК играет роль пептидил-тРНК, что и позволяет решить трудность начала элонгации пептида. У прокариот [бактерий] инициирующая аминоацил-тРНК даже химически похожа на пептидил-тРНК Аминогруппа аминокислоты связывается с формильной группой амидной связью. Т.о., введение инициирующей аминоацил-тРНК на специальный участок рибосомы названный Р (пептидильный) участок и есть одна из основных функций механизма инициации трансляции .
Второе назначение инициации это обеспечение начала считывания иРНК, которое происходит всегда со строго фиксированной точки матричного полинуклеотида. Начало считывания обычно не совпадает с началом полинуклеотидной цепи иРНК [с 5’ нуклеотидом ], а находится порой на довольно значительном растоянии от этого нуклеотида. Отсюда вытекает потребность в механизме точного узнавания того кодона на иРНК, который кодирует первый аминокислотный остаток. Всякое отклонение от этого кодона даже на один нуклеотид может привести к нарушению образования белка.
И, наконец, инициация является объектом действия регуляторных механизмов, определяющих интенсивность трансляции различных мРНК и, значит, образование белков в клетке, останавливающих трансляцию или, наоборот, способствующих индукции трансляции ранее не используемых иРНК .
