
- •У генетической информации – свой код.
- •Трансляция - один из сложнейших механизмов синтеза макромолекул.
- •Активирование аминокислот происходит в два этапа
- •Существуют два пути узнавания инициирующего кодона
- •Диссоциация рибосомы – необходимая предпосылка для инициации.
- •Малая рибосомная субъединица –главный исполнитель в сценарии инициации
- •Ингибиторы синтеза белков
- •Синтезированные на рибосомах белки доставляются к местам их деятельности разными путями.
- •Ограниченный протеолиз - обязательный механизм посттрансляционной модификации белков
- •Присоединение углеводов наиболее популярный способ пострибосомальной ковалентной модификации белков
- •Углеводы белков клеточных поверхностей ответственны за клеточную специфичность.
- •Ацилирование помогает белкам встраиваться в мембраны
- •Метилирование аминокислотных остатков в белках встречается редко
- •Фосфорилирование белков в большинстве случаев обратимый процесс
- •Сульфатирование белков пример необратимой ковалентной модификации структуры белка.
- •Пренилирование – способ «заякоривания» белка в мембранах
- •Витамин с – кофактор гидроксилирования белков.
- •Витамин к помогает белкам приобрести свойство связывать кальций.
- •Регуляция экспрессии генов
- •Регуляция на уровне транскрипции требует специфического взаимодействия днк и белков
- •Инициация транскрипции - основное место действия регуляторов на синтез белков у прокариот
- •Для инициации транскрипции у эукариот требуются дополнительные факторы
- •Регулировать экспрессию генов можно и после транскрипции
- •Аттенуация транскрипции один из возможных механизмов регуляции экспрессии генов.
- •Альтернативный сплайсинг рнк -своеобразная форма регуляции экспрессии генов
- •Транспорт рнк из ядра и последующее редактирование рнк могут быть объектом регуляции.
- •Продолжительность «жизни» иРнк можно регулировать .
Регуляция на уровне транскрипции требует специфического взаимодействия днк и белков
Модель пространственной структуры ДНК предложенная Криком и Уотсоном в 1953 г на первый взгляд казалась монотонно устроенной структурой с жестко детерминированными расстояниями и углами поворота между основаниями. Однако более детальное исследование показало существование локальных особенностей структуры, позволяющих специфически узнавать эти особенности молекулам белков. Химические группы пар азотистых оснований хорошо «просматриваются» в большой и малой бороздках молекулы ДНК, создавая неповторимые сочетания, которые могут выполнять роль специфических знаков для узнавания белками.
Р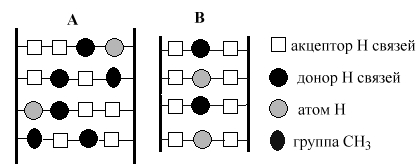 ис.
Схема расположения групп, участвующих
в белков-нуклеиновокислотном узнава
Выделены и исследованы сотни
последовательностей нуклеотидов,
используемых для специфического
узнавания белками. Это обычно небольшие
отрезки ДНК, некоторые из них приводятся
ниже в таблице 10-9.
ис.
Схема расположения групп, участвующих
в белков-нуклеиновокислотном узнава
Выделены и исследованы сотни
последовательностей нуклеотидов,
используемых для специфического
узнавания белками. Это обычно небольшие
отрезки ДНК, некоторые из них приводятся
ниже в таблице 10-9.
|
. Белки регуляторы и узнаваемая ими последовательность нуклеотидов на ДНК | ||
|
|
Белок |
Последовательность |
|
E.Coli |
Lac-репрессор |
ААТТГТГАГЦГГАТААЦААТТ ТТААЦАЦТЦГЦЦТАТТГТТАА |
|
|
САР |
ТГТГАГТТАГЦТЦАЦТ АЦАЦТЦААТЦГАГТГА |
|
Дрожжи |
GAL-4 |
ЦГГАГГАЦТГТЦЦТЦЦГ ГЦЦТЦЦТГАЦАГГАГГЦ |
|
Животные |
Oct-1 |
АТГЦАААТ ТАЦГТТТА |
|
|
GATA-1 |
ТГАТАГ АЦТАТЦ |
В основе молекулярного узнавания лежит принцип комплемнтарности между поверхностями двух молекул. В случае взаимодействия регуляторного белка и молекулы ДНК между поверхностью белка и структурой ДНК образуется множество специфических контактов (по меньшей мере, в 20 точках) при участии водородных связей, ионного и гидрофобного взаимодействий. Слабые взаимодествия в таком количестве делают это взаимодействие достаточно прочным. Исследование структуры многих белков, участвующих в регуляции экспрессии генов, позволило выделить несколько групп белков, объединенных общими признаками в структурной организации.
Спираль-поворот-спираль. Первой изученной связывающей ДНК структурой в белке была структура названная спираль- поворот- спираль. Подобная структура, обеспечивающая специфическое связывание белка и ДНК обнаружена в сотнях ДНК связыващих белков и у прокариот и у эукриот. 2 спиральных участка молекулы согнутые под углом в области короткого линейного отрезка располагались таким образом, что С-концевой отрезок вписывался в большую бороздку ДНК и специфически узнавал определенную последовательность нуклеотидов. Как правило, все белки с такой структурой выполняли свою функцию в виде димеров. К этой группе белков относятся и гомеодомен:гомеодомен - высоко консервативный домен из 60 аминокислот, обнаруженный среди большого семейства факторов транскрипции. Это семейство было сначала идентифицировано уDrosophila (до 60 белков),а впоследующем обнаружены у всех живых организмов от дрожжей до человека. Эти белки кодируются группой генов, изменение которых, может вызвать нарушение номального формирования организма ( преобразования одной части тела в другую, так называемые гомеотические преобразования). Этот класс генов был идентифицирован как у беспозвоночных так и позвоночных. Сам гомеодомен формирует структуру, высоко подобную бактериальным белкам типа спираль-поворот-спираль.
Ц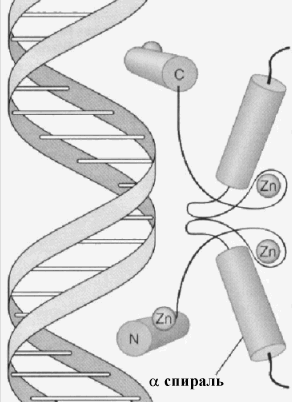 инковые
пальцы:Если структура спираль-поворот-спираль
состоит только из аминокислот, второй
тип наиболее часто встречающихся типов
структур узнающих ДНК содержит в качестве
стабилизирующего элемента ион цинка.
Существует целое семейство таких белков,
наиболее простой из которых составлен
изспирального отрезка цепи и отрезка сструктурой, связанных между собой ионами
цинка. Этот тип белков участвует в
регуляции транскрипции рибосомных РНК
(фактор транскрипции РНКpolIII,TFIIIA). Второй вариант
такой структуры составлен из 2-хспиральных участков, также связанных
ионами цинка. К ним относятся
внутриклеточные рецепторы стероидных
гормонов и гомонов щитовидной железы.
Атомы цинка связываются с остатками
цистеина и гистидина, способствуя
формированию пальцевидных структур. И
тот и другой варианты используют-спиральные структуры для узнавания
участков. Области пальца могут "вставляться
" в главное углубление спирали ДНК.
Интервал цинковой области пальца в этом
классе факторов транскрипции совпадает
с полуповоротом двойной спирали.
инковые
пальцы:Если структура спираль-поворот-спираль
состоит только из аминокислот, второй
тип наиболее часто встречающихся типов
структур узнающих ДНК содержит в качестве
стабилизирующего элемента ион цинка.
Существует целое семейство таких белков,
наиболее простой из которых составлен
изспирального отрезка цепи и отрезка сструктурой, связанных между собой ионами
цинка. Этот тип белков участвует в
регуляции транскрипции рибосомных РНК
(фактор транскрипции РНКpolIII,TFIIIA). Второй вариант
такой структуры составлен из 2-хспиральных участков, также связанных
ионами цинка. К ним относятся
внутриклеточные рецепторы стероидных
гормонов и гомонов щитовидной железы.
Атомы цинка связываются с остатками
цистеина и гистидина, способствуя
формированию пальцевидных структур. И
тот и другой варианты используют-спиральные структуры для узнавания
участков. Области пальца могут "вставляться
" в главное углубление спирали ДНК.
Интервал цинковой области пальца в этом
классе факторов транскрипции совпадает
с полуповоротом двойной спирали.
С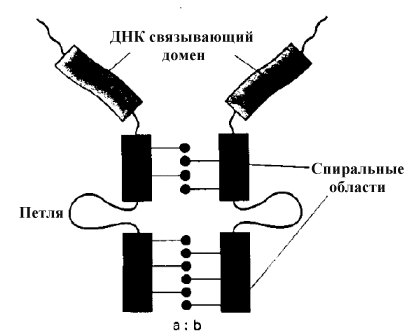 пираль-петля-спираль
(HLH):HLHдомен формирует димеры.HLHдомен составлен из двух-
спиральных областей , разделенных
областью переменной длины, которая
формирует петлю между 2– спиралями. Этот домен подобен структуре
спираль-поворот-спираль,спиральные области структурно подобны
и необходимы для взаимодействия белка
с элементами последовательности, которые
обладают двойной осью симметрии. Этот
класс факторов транскрипции наиболее
часто содержит область основных
аминокислот, расположенных на N –
концевом участкеHLHдомена
(такие белки обозначают какHLHбелки). Э
пираль-петля-спираль
(HLH):HLHдомен формирует димеры.HLHдомен составлен из двух-
спиральных областей , разделенных
областью переменной длины, которая
формирует петлю между 2– спиралями. Этот домен подобен структуре
спираль-поворот-спираль,спиральные области структурно подобны
и необходимы для взаимодействия белка
с элементами последовательности, которые
обладают двойной осью симметрии. Этот
класс факторов транскрипции наиболее
часто содержит область основных
аминокислот, расположенных на N –
концевом участкеHLHдомена
(такие белки обозначают какHLHбелки). Э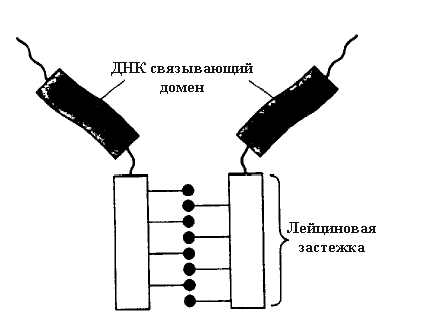 ти
аминокислоты необходимы для связывания
с ДНК по специфическим последовательностям.
HLH область функционирует в форме гомо
и гетеродимеров. Среди белков, имеющихHLHдомен можно назватьMyoD( фактор транскрипции
идуцирующий миогенез) иc-Myc(первоначально идентифицированный как
ретровирусный онкоген). Некоторые HLH
белки не содержат основной области и,
образуя гетеродимеры с белкамиHLH,
действуют как репрессоры, подавляя
активностьHLHбелков.
ти
аминокислоты необходимы для связывания
с ДНК по специфическим последовательностям.
HLH область функционирует в форме гомо
и гетеродимеров. Среди белков, имеющихHLHдомен можно назватьMyoD( фактор транскрипции
идуцирующий миогенез) иc-Myc(первоначально идентифицированный как
ретровирусный онкоген). Некоторые HLH
белки не содержат основной области и,
образуя гетеродимеры с белкамиHLH,
действуют как репрессоры, подавляя
активностьHLHбелков.
Лейциновая застежка - молния: как указывалось выше большинство белков, взаимодействуют с ДНК в форме димеров, причем в образовании димера участвуют последовательности аминокислот, которые не задействованы в самом механизме взаимодействия с ДНК.
Белки с лейциновым доменом застежки - молнии сочетают при этом обе функции и образование димера и связывание с ДНК. В белке имеются участки богатые гидрофобными аминокислотами (часто лейцином) радикалы которого выступают из спиральной структуры этого белка. Два белка с такими участками могут формировать суперспираль в которой выступающие группы радикалов лейцина взаимодействуют с лейциновыми радикалами другого мономера подобно застежке - молнии. Димер при этом приобретает Y- форму. Ножки этой структуры содержат участки узнавания последовательности ДНК. Область лейциновой застежки - молнии присутствует в многих связывающих ДНК белках, типа c-Myc, C/EBP и т.д.
