- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2(Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит(Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Пространственная структура белковой молекулы
Самым лучшим методом, позволяющим выяснить расположение в трехмерном пространстве белковой молекулы, является рентгеноструктурный анализ кристаллов белка. Кристаллизация белков - это достаточно трудоемкая процедура. Белок для этого должен быть очень чистым (гомогенным). Из него готовится насыщенный раствор (около 10 мг белка/мл), который выдерживается до образования в нем кристаллов. В кристалле белковые молекулы формируют очень правильную решетку. Эта кристаллическая решетка напоминает 3-хмерную мозаику.
Такой кристалл помещают на пути пучка -лучей. -частицы, проходя через кристаллическую решетку, сталкиваются с атомами молекулы белка и изменяют свою траекторию. В результате возникает вторичное -излучение, которое фиксируется на фотопластинке. Кристалл белка поворачивают на определенный угол и снова пропускают через него -лучи. На фотопластинках с дифракционными картинами вторичного -излучения измеряется расстояние между пятнами, а с помощью компьютера формируют карту электронной плотности. Затем специальным математическим методом, получившим название "трансформация Фурье", карту преобразуют в структурную модель белка.
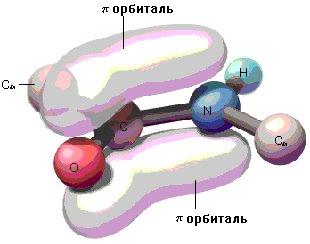
Именно таким методом пользовались американские исследователи Л. Поллинг и Р. Кори, исследуя ди- и трипептиды. Измерения ими расстояний между атомами пептидной группировки показали, что пептидная связь в белках является практически плоской. Её основные параметры приведены на рис.1.23. Пептидная связь примерно на 10% короче обычной, простой С-N и имеет характер частично двойной связи -С=N-, которая ограничивает подвижность атомов, прилежащих к ней. Это обусловлено взаимодействием неподеленной пары электронов атома азота с -электронной системой карбонильной группы, что приводит к затрудненному вращению вокруг связи С-N.
|
|
|
|
Рис.1.23. Пространственное изображение пептидной связи | |
Из обнаруженных особенностей в строении пептидной связи вытекали три постулата или принципа, сформулированные Л.Поллингом и Р.Кори:
Атомы, образующие пептидную связь, копланарны (лежат в одной плоскости). Вращение атомов или групп атомов вокруг пептидной связи невозможно или чрезвычайно затруднено;
Принцип эвивалентности вклада аминокислотных остатков в образование пептидной связи и, тем самым, в образование полипептидной цепи (за исключением Про).
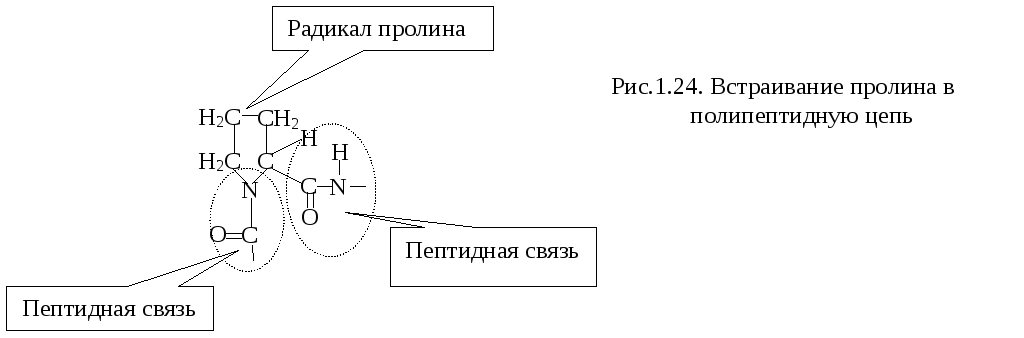
 3.
Принцип максимума водородных связей.
В белках атомы водорода и кислорода
практически всегда располагаются в
транс-конформации. Это обусловливает
возможность образования в полипептидной
цепи максимума водородных связей
(рис.1.24).
3.
Принцип максимума водородных связей.
В белках атомы водорода и кислорода
практически всегда располагаются в
транс-конформации. Это обусловливает
возможность образования в полипептидной
цепи максимума водородных связей
(рис.1.24).
Если пептидные связи "жесткие", плоскостные, то участки полипептидной цепи между С - С и N - С конформационно подвижны. В результате стремления боковых радикалов аминокислотных остатков выйти из заслонения формируется правозакрученная спиралевидная конформация полипептидной цепи или иная конформация3.
Вторичная структура белков
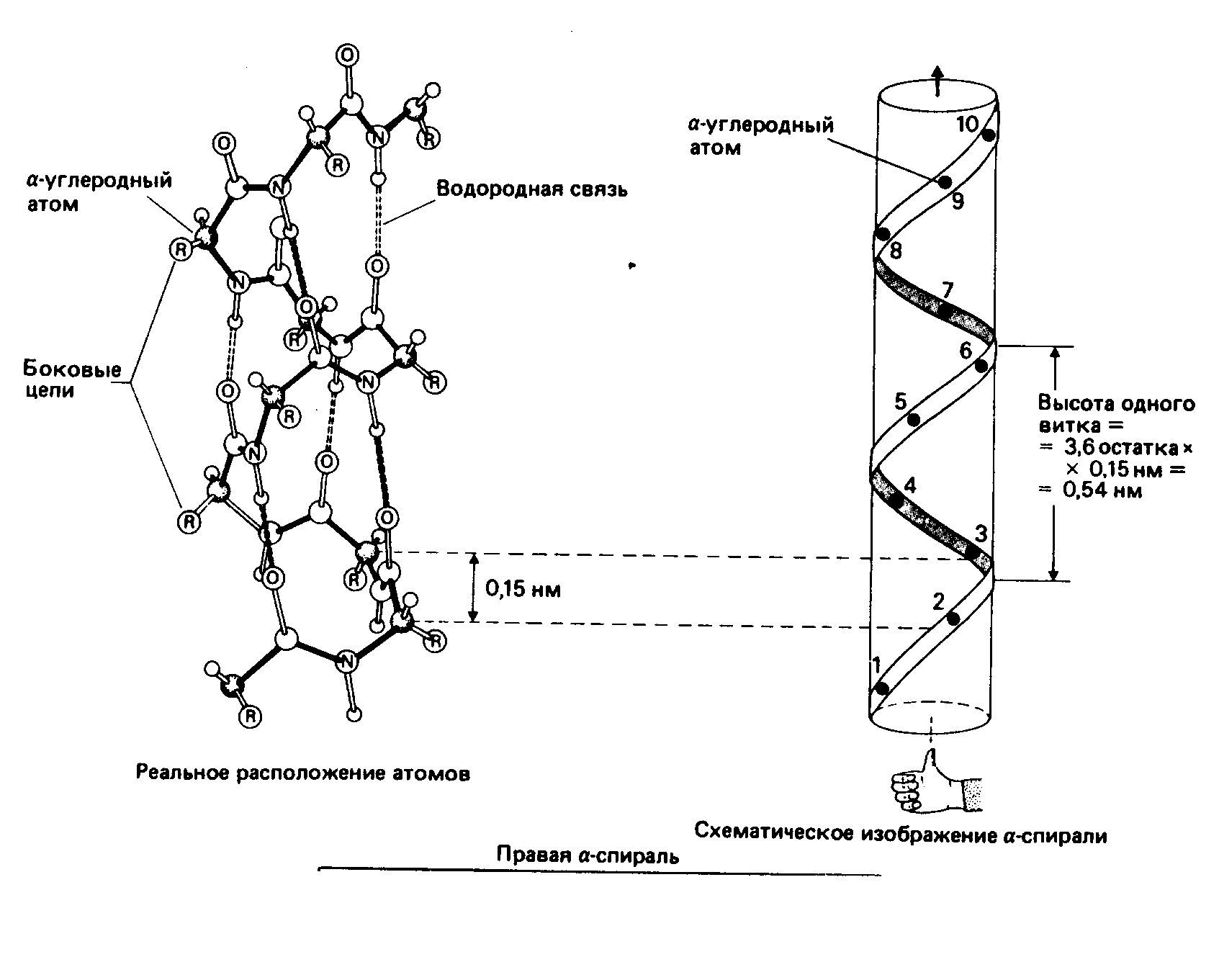
В 1950 г. Лайнус Полинг предложил два вида пространственной структуры белков - альфа-спираль и бета-структуру. Эти понятия сохранились до настоящего времени как виды вторичной структуры белков. Кроме них сейчас различают ещё один, третий тип вторичной структуры - -поворот. Вторичная структура белка - это локальная конформация полипептидной цепи, обусловленная вращением отдельных участков этой полипептидной цепи вокруг одинарных ковалентных связей.
Стабильность спирали поддерживают водородные связи между атомами пептидных группировок аминокислот, расположенных на соседних витках спирали. Все условия, ведущие к формированию спиральных структур, могут успешно реализоваться и при другой форме расположения полипептидной цепи. Эту альтернативную спирали форму назвали -структурой. Она формируется при укладке цепи в форме плоских шпилек. -структура также стабилизирована водородными связями (рис.1.25). Из двух или более -структурных участков полипептидной цепи формируется -слой. В грубом приближении она плоская и напоминает лист. Однако из-за того, что плоскости пептидных групп в каждом -структурном участке наклонены поочередно в разные стороны относительно направления этого участка, плоский -слой приобретает складчатую форму (рис.1.25).
-поворот или -изгиб - ещё один тип вторичной структуры, встречающийся во многих глобулярных белках в тех местах, где направление полипептидной цепи меняется на противоположное. Данная структура часто рассматривается как связующее звено между двумя уложенными антипараллельно -участками в составе -слоя. Она образуется в полипептидной цепи там, где встречается пролин. Дело в том, что эта аминокислота не может изгибаться, и там где она встречается в полипептидной цепи, -спираль и -структура обычно нарушаются. В этом месте образуется своеобразный излом - -поворот. В -повороте водородная связь замыкается через три аминокислотных остатка (рис.1.26). Там, где встречается -поворот, полипептидная цепь делает изгиб. -повороты обычно находятся у поверхности белковой молекулы.
|
|
|
|
Рис.1.25. Схематическое изображение -структуры. а) - параллельное, б) - антипараллельное расположение -структурных участков полипептидной цепи в -слое

Увеличение числа известных белков привело ученых к необходимости более подробно исследовать пространственную структуру полипептидных цепей. Оказалось, что несколько участков цепи, организованных в пространстве в форме -спирали или -структуры, могут объединяться, формируя так называемую надвторичную структуру. В белке может быть несколько организованных таким образом участков. Всех их можно подразделить на четыре класса: /, /, / и + , в зависимости от взаимного расположения в цепи -спиральных и -структурных участков (рис.1.27).
Полипептидная цепь на рисунке изображена в виде ленты, при этом -спиральные участки представлены спиралями, -структурные - стрелками, а нерегулярные - светлыми петлями. Боковые цепи не показаны, хотя во всех белках пространство между атомами основной цепи заполнено атомами боковых цепей. / структура состоит в основном из -спиралей, -участки в ней практически отсутствуют. -спирали упакованы таким образом, что неполярные боковые цепи оказываются спрятанными внутрь. В / типе имеется несколько -цепей и нет (или почти нет) -спиралей. В / варианте - и -участки чередуются вдоль цепи. Часто -участки образуют параллельный -слой, окруженный -спиралями. В + -типе - и -участки обычно располагаются в разных сегментах полипептидной цепи.
|
|
|
Рис.1.27. Варианты объединения -спиральных и -структурных участков (надвторичной
структуры) в полипептидной цепи
В крупных белках при сворачивании полипептидной цепи часто образуются две или более пространственно разделенные области, называемые доменами (рис.1.28). По своей

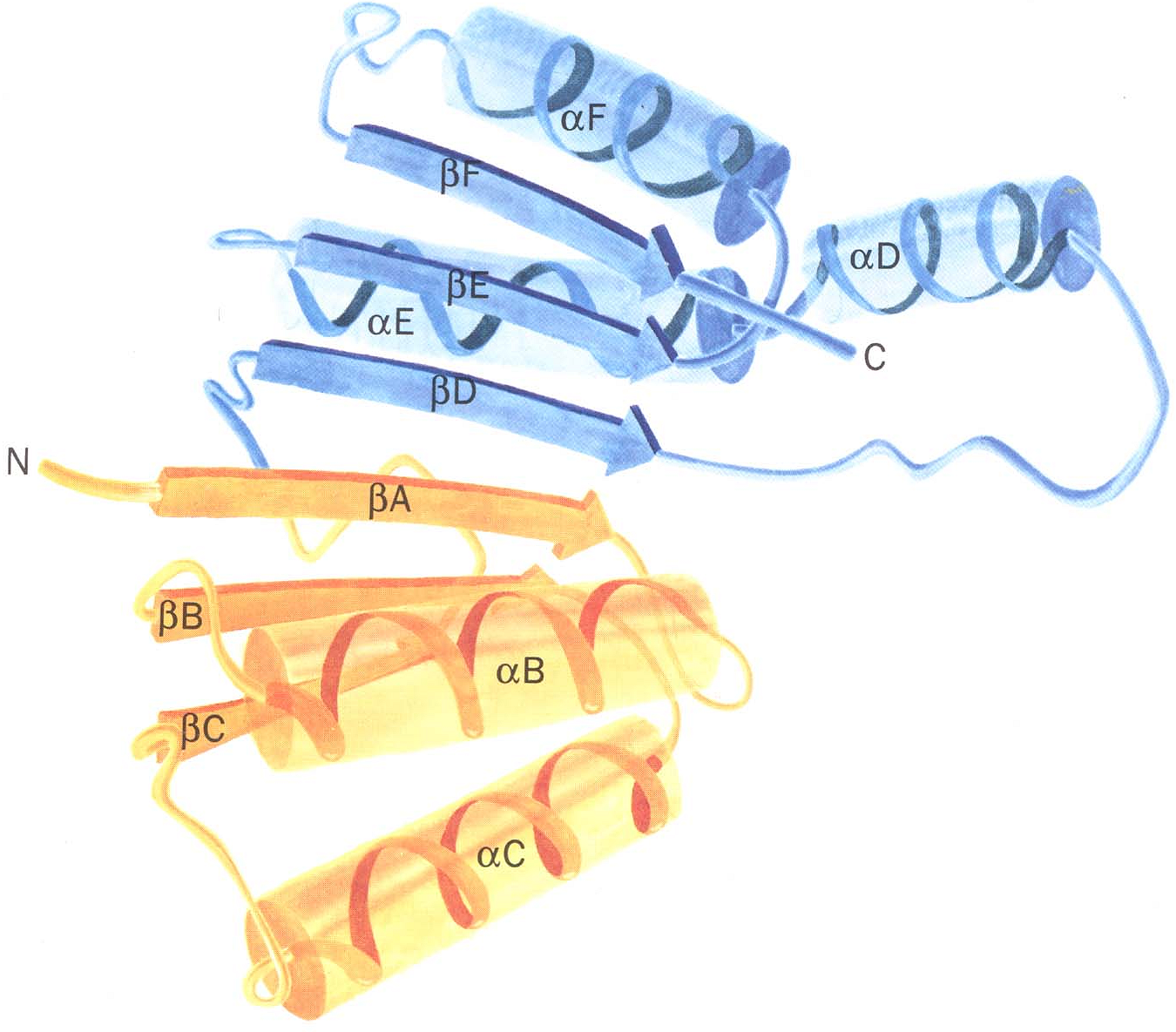
структуре каждый домен напоминает отдельный небольшой белок. Обычно в одном домене содержится от 40 до 300 остатков. Доменом называют участок белковой молекулы, образованный несколькими вторичными или надвторичными структурами, имеющий глобулярную форму. В разных белках они могут быть одинаково организованными участками и выполнять одинаковые функции. Домены часто обладают специфическими функциями, такими как связывание небольших молекул (рис.1.29).
|
|
Рис.1.29. Обобщенное изображение кофермент-связывающего домена в составе различных дегидрогеназ. Этот домен состоит из двух одинаковых по структуре единиц (один - желтого и один - синего цвета). Каждая единица связывает НАД (никотинамидадениндинуклеотид) и образует в месте связывания складку. |
Использование понятия "домен" позволило выделить целые семейства белков, имеющих общего предшественника, что проливает свет на процессы совершенствования живого мира.

В ряде случаев четко определить функции тех или иных доменов не удается. Между доменами в пределах одной и той же полипептидной цепи устанавливаеются гидрофобные контакты. В этих зонах формируется каталитический центр, а образующие его группы размещены в обоих доменах.
На этом уровне структурной организации белка еще не принимались во внимание возможности взаимодействия радикалов аминокислот между собой и с растворителем (водой), в котором белок должен выполнять свои функции.