
- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2(Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит(Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Функции состояния системы.
Термодинамика предлагает ряд параметров для оценки состояния систем. Независимые термодинамические параметры можно измерять. К ним относятся температура, давление, объем, масса, плотность и т.д. Зависимые термодинамические параметры нельзя замерить непосредственно, они зависят от независимых параметров. Зависимые параметры получили название функций состояния системы. Эти параметры могут изменяться, однако эти изменения зависят только от начального и конечного состояния системы. Они могут протекать при постоянном значении независимых термодинамических параметров, например, при постоянном объеме (изохорный процесс), постоянном давлении (изобарный процесс), постоянной температуре (изотермический процесс). Термодинамика процессов жизнедеятельности - это термодинамика открытых систем изменяющихся при постоянном давлении, температуре, объеме.
Количественной мерой движения материи является энергия. Внутренняя энергия биохимической системы (Е) включает любой вид энергии, которая может быть изменена при химической или биохимической реакции. Она представляет собой сумму кинетической энергии – энергии движения, колебания и вращения всех частиц (атомов, молекул, электронов) и потенциальной энергии – энергии, сохраняемой в химических связях между атомами и энергию не ковалентных взаимодействий между молекулами и ионами.
Табл.4-1. Некоторые употребительные физические параметры
|
|
|
|
Джоуль(Дж) - |
1 Дж =1кг м2 с-2 |
|
Калория (кал) |
1 кал тепло для нагревания 1 г воды от 14.5 до 15.5 0С. 1 кал = 4.184 Дж |
|
Большая калория (Кал) |
1Кал= 1 килокал |
|
Число Авогадро |
N= 6.0221* 1023 молекул /моль |
|
Кулон (К) |
1К=6.241*1018 электронных зарядов |
|
Фарадей (F) |
1 F =N электронных зарядов1 F= 96.494 К /моль=96.494 Дж/V* |
|
Кельвина шкала (К) |
0К= абсолютный ноль 273.15 =00С |
|
Постоянная Больцмана |
kb= 1.3807 * 10-23 Дж*К-1
|
|
Газовая постоянная |
R= N* kb = 8.3145 Дж*К-1*моль-1=1.9872 кал*град-1*моль-1 |
Абсолютное значение внутренней энергии системы измерить нельзя, измеряется лишь ее изменение между начальным и конечным состояниями системы. Известны две основные формы передачи энергии:
Теплота(Q)- форма передачи в виде неупорядоченного движения материи по градиенту температуры.
Работа (А)- форма передачи в виде упорядоченного движения, связанная с перемещением тел в пространстве и преодолением сил трения.
Первый закон термодинамики утверждает энергия вселенной не исчезает
Первый закон термодинамики показывает, что энергия вселенной не исчезает и не возникает, она постоянна. Это закон постоянства энергии во вселенной. Однако это не означает, что формы энергии не могут изменяться. Действительно, химическая энергия молекулы может быть преобразована в тепловую, электрическую или механическую энергию. Если системе подвести определенное количество теплоты (Q), то часть ее будет использована на выполнение работы (А), а часть на изменение внутренней энергии системы:
Е=Екон. – Енач. =Q-А или Q=E+А (1)
Q соответствует теплу, поглощенному системой, а А – работе, выполненной системой над окружающей средой. Если Q отрицательно, тепло покидает систему, а если Q положительно - тепло поглощается системой. Наоборот, если А отрицательна - совершается работа над системой, если А положительно, система совершает работу над окружающей средой.
Энергия, теплота и работа измеряются в одних и тех же единицах –калории (кал) или килокалории (Кал), а в системе СИ – джоуль (Дж) или килоджоуль (кДж). Прямым способом измерения Е является измерение поглощаемой энергии при сжигании вещества в калориметре при постоянном объеме. В этих условиях Q = E. (см рис -2а. ). Большинство биохимических реакций протекают чаще при постоянном давлении. Для количественной оценки реакций в таких условиях более удобной оказалась другая функция состояния - энтальпия или теплосодержание (H).(греч enthaltpein –теплота в)
H=Е+PV где V- объем системы, Р – давление.
При постоянном давлении, H=E+PV. Тот же самый результат может быть получен из формулы (1):
E = Q-А, где
Q = E + А, ноА = PVеслиVизменяется при постоянномP, значит
Q = E + PV
Таким образом, когда теплота реакции измеряется при постоянном давлении, она соответствует реальному значению H. (см рис -2.б ). Сжигая пищевые продукты при постоянном давлении, рассчитывают их калорийность. Калорийностью пищевых продуктов называют скорректированную величину энтальпии сгорания, взятую с обратным знаком.
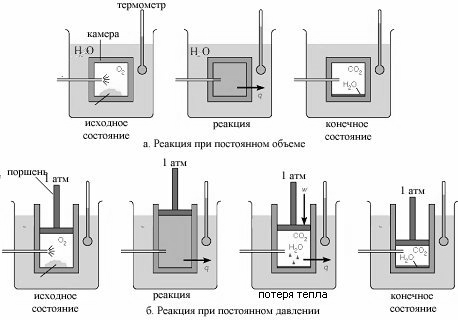
Рис.4-2. Изменения теплоты и работы в реакциях, протекающих при постоянном объеме (а) и постоянном давлении
Функции состояния, подобные H и E, не зависят от пути, по которому проходит реакция. Эти функции относятся к разности между начальными и конечными состояниями реакции. Однако, теплота (Q) и работа (А) - являются независимыми термодинамическими параметрами и их значения зависят от пути реакции.
Первый закон термодинамики дает возможность рассчитать изменения энергии при разных состояниях системы, позволяет оценить процессы перехода одного вида энергии в другой, но не дает ответа на вопрос о направлении процессов и возможности их спонтанного протекания.
