
- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2(Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит(Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Гель-электрофорез
Впоследствии были предложены технологии разделения на плотных носителях, среди которых особое место заняли гели. Последние сочетали удобства разделения в свободном растворе (в геле 95-99% воды) с возможностью фиксировать результаты электрофореза путем высушивания геля. Среди гелеобразующих веществ вначале получил признание крахмал, затем полисахариды из водорослей агар-агар (агароза) и наконец гели, искусственно получаемые путем полимеризации акриламида.
Полиакриламидный гель стал одним из наиболее популярных носителей для электрофореза. Полимеризацию проводят в буферном растворе. Затем гель помещают в электрофоретическую камеру, заполненную буферным раствором и содержащую электроды для образования электрического поля (рис.1.8). рН и другие параметры буферного раствора выбираются из расчета, чтобы разделяемые молекулы несли отрицательный заряд и двигались в электрическом поле слева направо. Поскольку разделяемые молекулы движутся в геле, те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к месту нанесения, чем меньшие.

Рис.1.8. Виды проведения электрофореза в полиакриламидном геле (слева - в трубках с гелем, справа - в прямоугольных блоках)
Следует иметь ввиду, что этот метод позволяет разделять молекулы большей частью по их размеру, и совсем необязательно, - по их молекулярной массе. Для примера рассмотрим две молекулы белка по 1000 аминокислот каждая. Одна из них представляет вытянутую цепь (А), а вторая (за счет образования связей между соседними участками) имеет форму шпильки (Б):

Поскольку они движутся внутри геля, обе молекулы будут вести себя как сферы, диаметр которых равняется длине вытянутой части молекулы. Обе молекулы имеют одинаковую молекулярную массу, однако благодаря тому, что вторичная структура Б де-лает её молекулу короче, чем А, быстрее будет передвигаться Б. Дабы устранить влияние различий по форме и оставить только различия по молекулярной массе, разделяемые молекулы должны иметь развернутую конформацию (без вторичной структуры). Для разрушения вторичной и третичной структуры используются различные методы подготовки препаратов белка.
Подготовка белков. Все белки обладают вторичной и третичной структурной организацией. При этом их молекулы не всегда несут отрицательный заряд в растворе. Для разрушения вторичной и третичной структуры и образования на поверхности белков отрицательного заряда их нагревают и обрабатывают детергентом – додецилсульфатом натрия (ДДС-натрий).
Если
соблюсти вышеприведенные условия,
разделение молекул при электрофорезе
будет осуществляться в зависимости от
их молекулярной массы. При этом удается,
например, разделить 2 молекулы
полинуклеотида, различающиеся на 1
мононуклеотид. Высокомолекулярные
молекулы будут двигаться медленнее
низкомолекулярных. Длина пройденного
молекулой расстояния будет пропорциональна
логарифму величины, обратной её
молекулярной массе (log 1/MM). 
Обычно гели изображают в вертикальном положении, где место нанесения находится вверху, а движение разделяемых молекул направлено сверху вниз. Тогда в верхней части геля располагаются большие молекулы, а в нижней – с меньшей молекулярной массой.
Как правило, рядом с опытными пробами на гель наносится смесь белковых (или каких-то других разделяемых) молекул с известной молекулярной массой. Такие стандарты «молекулярной массы» позволяют прокалибровать пробег молекул. Тогда, зная какое расстояние прошло изучаемое вещество, можно установить его молекулярную массу. Ниже на рисунке 1.9 показан гель после обработки его красителем. Молекулы красителя связываются с каким-то определенным классом макромолекул независимо от последовательности расположения мономеров в их составе.
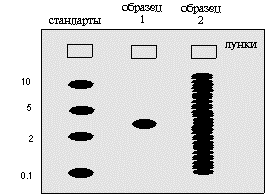
Рис.1.9. Результат проведения электрофореза в полиакриламидном геле после окраски геля неспецифическим красителем
Изображенный на рис.1.9 образец 1 содержит макромолекулы одного размера. Это может быть очищенный белок. При сравнении с подвижностью стандартов ясно, что молекулярная масса этого соединения около 3. Образец 2. Это может быть смесь белков после окраски геля неспецифическим красителем. Здесь находится так много полос, что среди них невозможно вычленить необходимую. В подобных условиях без зонда (который действует как специфический краситель) нам едва ли удастся получить полезную информацию об интересующем соединении. Учитывая это обстоятельство, для определения индивидуальных белков пользуются сочетанием электрофореза с иммунологическими реакциями (иммуноэлектрофорез) (рис.1.10).
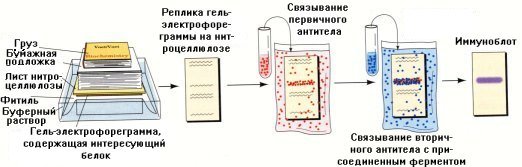
Рис.1.10. Схема проведения иммуноблот анализа для обнаружения белка после проведения электрофореза в полиакриламидном геле (описание этапов приведено в гл.13)
