
- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2(Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит(Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Инозит(Витамин в8)
Химическое строение и свойства. По химическому строению инозит – шестиатом-

томный циклический спирт, хорошо растворимый в воде. Витаминными свойствами обладает фитин – соль инозитфосфорной кислоты.
Метаболизм и функции:
Инозит входит в состав инозитфосфатидов, содержащихся во всех тканях, особенно богата ими нервная ткань.
Ф
 офорилированные
формы инозита, прежде всегоИТФ
(инозитол-1,4,5-трифосфат), являются
посредниками
в реализации
действия некоторых гормонов.
ИТФ способствует высвобождению ионов
кальция из кальцисом (замкнутых
пузырьков, формируемых мембранами
эндоплазматического ретикулума).
Образуется ИТФ при действии фосфолипазы
С на липид
плазматической мембраны
фосфатидил-инозитол-4,5-дифосфат:
офорилированные
формы инозита, прежде всегоИТФ
(инозитол-1,4,5-трифосфат), являются
посредниками
в реализации
действия некоторых гормонов.
ИТФ способствует высвобождению ионов
кальция из кальцисом (замкнутых
пузырьков, формируемых мембранами
эндоплазматического ретикулума).
Образуется ИТФ при действии фосфолипазы
С на липид
плазматической мембраны
фосфатидил-инозитол-4,5-дифосфат:
Недостаточность инозита у животных проявляется жировой дистрофией печени и падением содержания в ней фосфолипидов, а также облысением и анемией. У молодых животных наблюдается задержка роста. Недостаточность инозита у человека не описана.
Суточная потребность. Пищевые источники. Инозит находится во всех продуктах животного и растительного происхождения, особенно много его в печени, мозге, мясе, яичном желтке, а также в хлебе, картофеле, зелёном горохе, грибах.
Суточная потребность составляет приблизительно1,0-1,5 г.
Карнитин
Химическое строение и свойства. По химическому строению карнитин является γ-триметиламино-β-оксибутиратом:
Карнитин поступает в организм с продуктами питания, кроме того, он синтезируется в печени из аминокислоты лизина с участием гидроксилаз.
карнитин
Метаболизм и функции.
Основная роль карнитина заключается в том, что он участвует в транспорте жирных кислот внутрь митохондрий, где они окисляются с высвобождением заключённой в них энергии. Происходит это следующим образом:
Ацил~SКоА с помощью карнитин-ацилКоА-трансферазы I (карнитин-пальмитоил-трансферазы), локализующейся внаружней мембране митохондрий, связывается с карнитином с образованием ацил-карнитина. Транслоказа переносит ацил-карнитин внутрь митохондрий – в митохондриальный матрикс, где карнитин заменяется на ацильную группу с участием КоА-SH. После этого образующийся ацил~SКоА становится доступным для окисления или дальнейшего удлинения цепи жирной кислоты.
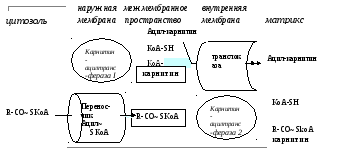
Рис. Транспорт жирных кислот в митохондрию с участием карнитина
Аналогичную роль выполняет карнитин при транспорте ацетил~SКоА, однако направленность переноса ацетила противоположная. Тем самым обеспечивается поддержание физиологического уровня ацетил-КоА в митохондриях – важной условие гомеостаза метаболических процессов.
Введение карнитина животным повышает образование энергии в митохондриях, стимулирует регенераторные процессы в миокарде.
Функция карнитина не ограничивается транспортом ацильных остатков в митохондрии. Имеются данные, что это соединение стимулирует внешнесекреторную функцию поджелудочной железы, активирует сперматогенез.
Недостаточность карнитина. Карнитиновая недостаточность (её развитию способствует дефицит лизина и аскорбиновой кислоты) проявляется мышечной слабостью, дистрофией и истончением мышечных волокон.
Суточная потребность. Пищевые источники. Основным источником карнитина являются мясные продукты.
Суточная потребность составляет приблизительно 500мг.
