- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2(Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит(Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Аминокислота, полипептид, белок
Аминокислоты могут объединяться в длинные цепи, образуя между собой пептидные связи. 2 аминокислоты при этом образуют дипептид, если к нему добавить еще одну, то возникнет трипептид и т.д. Пептиды, содержащие до 10 аминокислот, образуют олигопептиды, а до 50 - полипептиды. Полипептиды, содержащие более 50 аминокислот, уже называют белками, хотя это название чаще используют для соединений, содержащих более 100 аминокислот. Цепи аминокислот имеют на одном конце аминокислоту со свободной -аминогруппой (N-конец пептида, белка), а на другом конце - аминокислоту со свободной -карбоксильной групой (C-конец пептида, белка). Небольшие пептиды в организме присутствуют в незначительных количествах. Они выполняют важные функции как регуляторы физиологических процессов, нейромедиаторы, регуляторы тонуса сосудов и т.д.
Свойства белков определяются свойствами аминокислот
Большинство свойств белка определяется свойствами аминокислот, из которых состоит белок. Как упоминалось выше, аминокислоты - это амфотерные соединения, и это их свойство обусловлено амино- и карбоксильными группами. В белке большая часть этих групп входит в состав пептидных связей, однако те, которые принадлежат концевым аминокислотам и радикалам некоторых аминокислот, расположенным внутри белковой молекулы, по-прежнему придают ему те же свойства. Число таких групп зависит от количества основных и кислых аминокислот в белковой молекуле. Все эти группы в белке находятся в ионизированном состоянии в зависимости от pH.
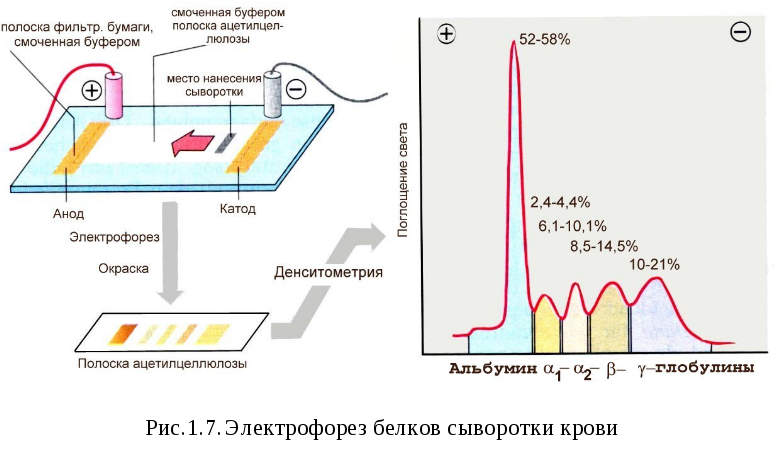
Знание иэт важно для разделения белков методом электрофореза
Как и аминокислоты белки при определенном значении pH имеют нейтральный заряд и такое значение pH называют изоэлектрической точкой белка. При pH ниже ИЭТ увеличивается положительный заряд, и молекула белка становится катионом. При pH выше ИЭТ увеличивается отрицательный заряд, и белок становится анионом. Для большинства белков ИЭТ находится в пределах 2,7-7,9.
Все несущие заряд частицы передвигаются в электрическом поле в зависимости от величины заряда. Постоянное электрическое поле можно получить, используя источники постоянного напряжения и пропуская постоянный ток через буферный раствор. Выбирая pH буферного раствора, можно управлять и характером распределения белков в электрическом поле. Скорость перемещения молекул, кроме того, зависит от целого ряда факторов. Важно присутствие других ионов, температуры, молекул носителя, на котором проводится разделение, величины заряда самой белковой молекулы.
Метод разделения, учитывающий все указанные факторы, получил название электрофорез. Его применяют не только для разделения белков, но и для разделения любых частиц, имеющих заряд. Первые способы разделения белков использовали разделение в буферном растворе (электрофорез со свободной границей), а затем большее распространение получил электрофорез на носителях. Носителем служат полоски бумаги, ацетатцеллюлозы, агаровый, крахмальный, полиакриламидный гель, смоченные или содержащие буферный раствор.
В клинической практике наибольшую популярность приобрел электрофорез на ацетилцеллюлозных полосках для разделения белков плазмы крови (рис.1.7). Обычно белки плазмы в стадартных условиях электрофореза (буферный раствор pH 8.8) разделяются на 5 фракций. Полоски прокрашивают красителем, который количественно связывается с белками, что позволяет после извлечения краски количественно оценить электрофореграмму. Соотношение между отдельными фракциями меняется при разных заболеваниях.