
- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2(Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит(Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Обратимые ингибиторы могут быть конкурентными и неконкурентными
Различия между этими типами обратимых ингибиторов касаются их взаимоотношений с субстратом. Если ингибитор конкурирует с субстратом за место связывания на ферменте и действие одного может быть отменено избытком другого, говорят о конкурентном торможении, в противном случае речь идет о неконкурентных ингибиторах.
Конкурентные ингибиторы не всегда структурно подобны субстрату.
Различают два механизма конкурентного торможения.
А.Конкурентное торможение путем связывания активного центра. Классический конкурентный ингибитор - вещество, которое имеет структурное сходство с субстратом фермента. Благодаря этому подобию ингибитор может связываться с активным центром вместо субстрата. Это своеобразная молекулярная ошибка. Однако, поскольку субстрат и ингибитор не идентичны полностью, фермент не способен катализировать превращение ингибитора в продукт. Ингибитор просто блокирует активный центр фермента. Если субстрат свяжется с активным центром раньше, чем ингибитор, ингибитор не может связаться с ферментом. Нельзя одновременно обоим связаться с активным центром. Такой способ конкурентного торможения получил название изостерического из-за схожести (изос) структур субстрата и ингибитора. Наиболее часто в клетке в роли классического конкурентного ингибитора выступает продукт данной реакции, что имеет глубокий практический смысл.
 Б.
Конкурентное торможение путем изменения
конформации фермента. В
отличие от классического варианта,
ингибитор связывается не с активным
центром, а со специальным центром,
связывающим ингибитор, который расположен
вдали от активного центра. Связывание
ингибитора вызывает изменение
пространственной структуры (изменение
конформации) в области активного центра,
которое не позволяет присоединиться
субстрату. Предшествующее связывание
субстрата к активному центру в свою
очередь, вызывает изменения конформации
центра связывания ингибитора, которое
предотвращает связывание ингибитора.
И субстрат и ингибитор не могут
одновременно связаться с ферментом. В
этом виде конкурентного торможения
ингибитор может иметь любую химическую
структуру, поскольку они связываются
с различными участками фермента.
Б.
Конкурентное торможение путем изменения
конформации фермента. В
отличие от классического варианта,
ингибитор связывается не с активным
центром, а со специальным центром,
связывающим ингибитор, который расположен
вдали от активного центра. Связывание
ингибитора вызывает изменение
пространственной структуры (изменение
конформации) в области активного центра,
которое не позволяет присоединиться
субстрату. Предшествующее связывание
субстрата к активному центру в свою
очередь, вызывает изменения конформации
центра связывания ингибитора, которое
предотвращает связывание ингибитора.
И субстрат и ингибитор не могут
одновременно связаться с ферментом. В
этом виде конкурентного торможения
ингибитор может иметь любую химическую
структуру, поскольку они связываются
с различными участками фермента.
Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
Реакции связывания и субстрата и
конкурентного ингибитора протекают
быстро и обратимы, так что они существуют
в равновесии. Позиции этого равновесия
будут зависеть от концентраций реагентов.
Учитывая, что фермент участник обеих
реакций их равновесн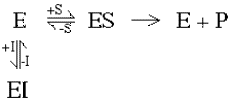 ые
состояния взаимосвязаны. Это означает,
что при высоких уровнях ингибитора
фактически все молекулы фермента будут
участвовать в образованииEIкомплекса, и фермент будет почти полностью
ингибирован. С другой стороны, при
высоких концентрациях субстрата почти
все молекулы фермента будут связаны
вESкомплексе и ингибитор
не сможет связаться с ферментом. Высокие
концентрации субстрата снимают действие
ингибитора. Субстрат и ингибитор
конкурируют друг с другом. Какое влияние
это будет иметь на кинетике (рис 2-10)?
ые
состояния взаимосвязаны. Это означает,
что при высоких уровнях ингибитора
фактически все молекулы фермента будут
участвовать в образованииEIкомплекса, и фермент будет почти полностью
ингибирован. С другой стороны, при
высоких концентрациях субстрата почти
все молекулы фермента будут связаны
вESкомплексе и ингибитор
не сможет связаться с ферментом. Высокие
концентрации субстрата снимают действие
ингибитора. Субстрат и ингибитор
конкурируют друг с другом. Какое влияние
это будет иметь на кинетике (рис 2-10)?

Рис 2-10. График Лаинуивера-Берка в случае классического конкурентного ингибирования
Эффект на KmКм - индикатор сродства субстрата и фермента. В присутствии конкурентного ингибитора некоторые молекулы фермента будут существовать как свободные ферменты, другие как комплексы ингибитора фермента. Первые будут иметь нормальное сродство, а вторые полностью неспособны к связыванию субстрата. Км измеряет полное сродство фермента в реагирующей смеси, которое будет представлять среднее значение между нормой и нулевым значением этого сродства, и поэтому будет явно меньше нормального значения. Так что конкурентный ингибитор уменьшает сродство субстрата и фермента, или увеличивает Км.
Эффект на Vmax Vmax - скорость при высоких концентрациях субстрата. Поскольку в этих условиях, ингибитор вытесняется субстратом, он не тормозит фермент вообще и, следовательно, конкурентные ингибиторы не замедляют реакцию при высоких концентрациях субстрата, и не изменяют Vmax. Это можно хорошо видеть на графике Лайнуивера-Берка. Наклон графика равен Km/Vmax. Увеличение наклона в присутствии ингибитора указывает на снижение скорости реакции при низких уровнях субстрата.
Наиболее часто приводимый пример конкурентного ингибирования - это использование малоновой кислоты для торможение дегидрогеназы янтарной кислоты. Как видно из рисунка 2-9 наиболее близким структурным аналогом сукцината является малоновая кислота.
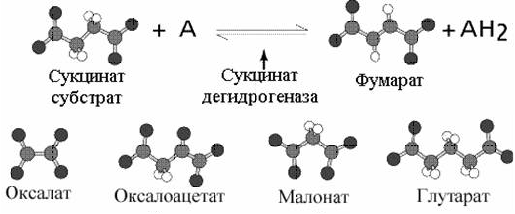
Рис 2-9. Примеры конкурентных ингибиторов.
Малоновая кислота тормозит активность дегидрогеназы янтарной кислоты, занимая активный центр на ферменте. Учитывая обратимость реакции, избыток янтарной кислоты снимет действие малоновой кислоты.
