- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2(Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит(Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Свойства аминокислот - основа свойств белков
Химические и физико-химические свойства аминокислот обусловлены тем, что они имеют радикал и 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Равновесие зависит от pH среды.

Нейтральные аминокислоты в воде не имеют заряда. Иначе ведут себя дикарбоновые аминокислоты. Обе их карбоксильные группы диссоциируют, отдавая 2 протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты, и раствор их имеет кислую реакцию. Возникающий при этой диссоциации ион имеет избыток отрицательного заряда.
Основные аминокислоты реагируют в водном растворе как слабые основания. Это связано с тем, что один протон, который освобождается при диссоциации карбоксильной группы таких аминокислот, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, увеличивая тем самым количество OH групп и повышая pH. Заряд иона таких аминокислот будет положительным.
Тиольная группа (-SH) цистеина может диссоциировать в растворе следующим образом:R-SHR-S-+H+. Тиолы подвергаются ионизации при рН около 8. Таким образом, в зоне физиологического рН, в живых организмах, они будут находиться в протонированном состоянии. Гидроксильные группы, подобные таковой у серина, имеют рК около 15. Таким образом, в нормальных условиях они не будут диссоциировать.
При добавлении в раствор аминокислот дополнительного количества протонов (кислоты) подавляется диссоциация карбоксильных групп и увеличивается количество NH3+ групп. Аминокислоты при этом переходят в катионную форму (приобретают положительный заряд). При добавлении щелочи, наоборот, улучшаются условия для диссоциации карбоксильных групп. Аминокислоты переходят в анионную форму (приобретают отрицательный заряд). Изменяя, таким образом, pH раствора, можно изменять заряд молекул аминокислот (рис.1.1).

Рис.1.1. Кривые, полученные в результате титрования раствора глицина
В зависимости от свойств аминокислот количество добавляемой кислоты или щелочи для изменения величины заряда будет разным. При определенном для каждой аминокислоты значении pH наступает такое состояние, при котором заряд аминокислоты становится нейтральным. Такое значение pH получило название изоэлектрической точки (ИЭТ). При значении pH, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле. Если pH ниже изоэлектрической точки, катион аминокислоты движется к катоду, а при pH выше ИЭТ анион аминокислоты - к аноду. На этих свойствах аминокислот основана возможность разделения их в электрическом поле (электрофорез). Кислые аминокислоты имеют ИЭТ в слабокислой среде, основные - в слабоосновной, а нейтральные - в нейтральной.
Т ак
как аминокислоты одновременно обладают
свойствами слабой кислоты и слабого
основания (амфотерные свойства), то они
могут играть роль буферной системы. При
этом в буферной системе они могут
реагировать как слабая кислота:
ак
как аминокислоты одновременно обладают
свойствами слабой кислоты и слабого
основания (амфотерные свойства), то они
могут играть роль буферной системы. При
этом в буферной системе они могут
реагировать как слабая кислота:
Следовательно, аминокислотная буферная система может обладать двумя областями pH с высокой буферной емкостью (подробнее - см. гл.14).
Таблица 1.1. Характеристика протеиногенных аминокислот
|
Название |
Сокра-щение |
РКa -COOH групп |
РКa -NH3+-групп |
РКa ионизированной боковой цепи |
Молекулярная масса (Да) |
Встречаемость в белках (мол.%) |
|
Аланин |
А, Ала |
2,3 |
9,7 |
- |
71,08 |
9,0 |
|
Аргинин |
R, Арг |
2,2 |
9,0 |
12,5 |
156,20 |
4,7 |
|
Аспарагин |
N, Асн |
2,0 |
8,8 |
- |
114,11 |
4,4 |
|
Аспарагиновая кислота |
D, Асп |
2,1 |
9,8 |
3,9 |
115,09 |
5,5 |
|
Валин |
V, Вал |
2,3 |
9,6 |
- |
99,14 |
6,9 |
|
Глицин |
G, Гли |
2,3 |
9,6 |
- |
57,06 |
7,5 |
|
Глютамин |
Q, Глн |
2,2 |
9,1 |
- |
128,14 |
3,9 |
|
Глютаминовая кислота |
E, Глу |
2,2 |
9,7 |
4,2 |
129,12 |
6,2 |
|
Гистидин |
H, Гис |
1,8 |
9,2 |
6,0 |
137,15 |
2,1 |
|
Изолейцин |
I, Иле |
2,4 |
9,7 |
- |
113,17 |
4,6 |
|
Лейцин |
L, Лей |
2,4 |
9,6 |
- |
113,17 |
7,5 |
|
Лизин |
K, Лиз |
2,2 |
9,0 |
10,0 |
128,18 |
7,0 |
|
Метионин |
M, Мет |
2,3 |
9,2 |
- |
131,21 |
1,7 |
|
Пролин |
Р, Про |
2,0 |
10,6 |
- |
97,12 |
4,6 |
|
Серин |
S, Сер |
2,2 |
9,2 |
- |
87,08 |
7,1 |
|
Треонин |
Т, Тре |
2,6 |
10,4 |
- |
101,11 |
6,0 |
|
Триптофан |
W, Три |
2,4 |
9,4 |
- |
186,21 |
1,1 |
|
Тирозин |
Y, Тир |
2,2 |
9,1 |
10,1 |
163,18 |
3,5 |
|
Фенилаланин |
F, Фен |
1,8 |
9,1 |
- |
147,18 |
3,5 |
|
Цистеин |
C, Цис |
1,8 |
10,8 |
8,3 |
103,14 |
2,8 |
В составе белков живых организмов можно встретить аминокислоты, которые подвергаются изменению после встраивания в молекулу белка. К ним относятся такие как:
|
|
Является измененной формой серина. Образуется в составе белков в результате действия протеинкиназы (фермента, катализирующего включение остатка фосфорной кислоты в белки) |
|
|
Образуется в составе белка - коллагена путем гидроксилирования аминокислоты - пролина |
|
|
5-гидроксилизин, который также называют -гидроксилизин. Обнаружен также в составе коллагена и является производным лизина |
|
|
Трийодтиронин, гормон щитовидной железы, образуется из аминокислоты - тирозина |
|
|
Образуется из глутаминовой кислоты под влиянием витамина К. Наличие такой аминокислоты в своем составе позволяет белку связывать кальций |
|
|
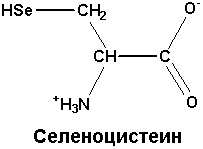
Редко встречающаяся аминокислота, которая входит в состав некоторых белков. Её кодирует триплет УГА. Обычно последний выполняет функцию стоп-кодона. Но в случае селеноцистеина структура соответствующей мРНК такова, что рибосома не воспринимает УГА в качестве терминирующего кодона |
Непротеиногенные аминокислоты. В организме имеются аминокислоты, которые не входят в состав белков. Они нередко являются продуктами метаболизма в клетках и несут определенную функциональную нагрузку.
|
|
Образуется из метаболически активной формы метионина - S -аденозилметионина в ходе переноса метильной группы на молекулу-акцептор |
|
|
Метаболически активная форма метионина. Выполняет функцию переносчика метильных групп |
|
|
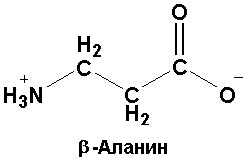
Входит в состав витамина - патотеновой кислоты, коэнзима А и некоторых важных природных пептидов. Это единственная встречающаяся в природе -аминокислота. Является конечным продуктом распада пиримидиновых нуклеотидов |
|
D-аланин |
Является стереоизомером L-аланина. D-аланин обнаружен в составе полипептидов оболочки некоторых бактерий. |
|
|
Промежуточный метаболит цикла реакций синтеза мочевины |
|
|
Необычная аминокислота, которая образуется из цистеина в семенах душистого горошка (Lathyris odoratus). У животных, которые поедают эти семена, нарушается синтез коллагена. У человека в результате потребления таких семян развивается синдром Эйлерса-Данлоса. Он проявляется в искривлении позвоночника, нарушении сердечной деятельности |
|
|
Обнаруживается в составе пептидов мембран некоторых бактерий. Функцию связывают с защитой бактерий от действия пептидаз |
|
|
Обнаружена в мозге и других тканях. Является нейромедиатором |
|
|
Промежуточный продукт биосинтеза цистеина и метионина, распада метионина. Согласно недавно проведенным исследованиям увеличенному уровню гомоцистеина сопутствуют сосудистые заболевания. Снижению его уровня способствует включение в состав принимаемой пищи фолиевой кислоты, пиридоксина, кобаламина |
|
|
L-гомосерин обнаружен во многих тканях, является промежуточным продуктом метаболизма аминокислот: треонина, изолейцина, метионина |
|
|
Промежуточный продукт цикла синтеза мочевины |
|
|
Обнаружен во многих тканях, является промежуточным продуктом обмена аминокислот |