
- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2(Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит(Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Кинетика мультисубстратных реакций
Большинство биохимических реакций в клетке протекает с участием двух или более молекул субстрата и с образованием нескольких продуктов. Например, в реакции гидролиза белка участвуют два субстрата (полипептид и вода) и образуются два продукта (два фрагмента расщепленной полипептидной цепочки). Кинетика мультисубстратных реакции несколько сложнее чем кинетика фермента с одним субстратом. Однако, для многих целей, в частности для лабораторного анализа фермента, достаточно определить Км для каждого субстрата при насыщенных концентрациях этих субстратов. Кроме того, принципы кинетики простых реакций могут быть распространены и на полисубстратные реакции, например такие как реакции переноса групп. Это делается путем измерения эффектов различных концентрации одного субстрата на кинетические результаты, полученные для другого.
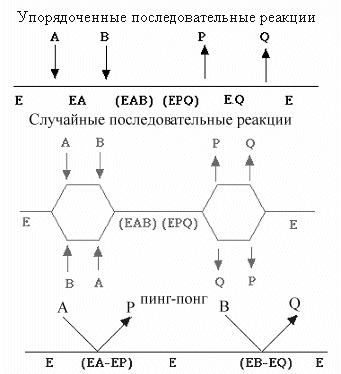 Полисубстратные
реакции можно описывать используя
несколько различных кинетических схем,
называемых кинетическими механизмами.
Кинетические механизмы обычно
представляются, используя систему
обозначений, введенную Клелэндом
(Cleland
W.W.).
Последовательность шагов изображают
слева направо. Добавление молекул
субстрата (A,
B,
C)
к ферменту и отделение продуктов (P,
Q,
R)
от фермента обозначено стрелками.
Различные формы фермента (свободный E,
ES
комплексы, или EP
комплексы) написаны под горизонтальной
строкой. ES
комплексы, которые подвергаются
химическому преобразованию, занимая
активный центр, записываются в круглых
скобках. Последовательные реакции - это
реакции которые требуют, чтобы все
субстраты присутствовали перед тем как
будет образован любой продукт.
Последовательные реакции могут быть
или упорядоченными, при которых
соблюдается обязательный порядок
добавления субстратов и высвобождения
продуктов, или случайными, при которых
не соблюдается обязательный порядок
связывания или высвобождения. В реакциях
пинг-понга продукт высвобождается
раньше, чем свяжутся все субстраты. Для
бисубстратных реакций этого типа,
после связывания первого субстрата
фермент модифицирует свою структуру,
и катализирует образование первого
продукта, после чего связывается второй
субстрат и измененный фермент
восстанавливается в свою первоначальную
форму и высвобождает второй продукт.
Связывание и освобождение лигандов в
пинг-понговом механизме обычно указывается
наклонными линиями.
Полисубстратные
реакции можно описывать используя
несколько различных кинетических схем,
называемых кинетическими механизмами.
Кинетические механизмы обычно
представляются, используя систему
обозначений, введенную Клелэндом
(Cleland
W.W.).
Последовательность шагов изображают
слева направо. Добавление молекул
субстрата (A,
B,
C)
к ферменту и отделение продуктов (P,
Q,
R)
от фермента обозначено стрелками.
Различные формы фермента (свободный E,
ES
комплексы, или EP
комплексы) написаны под горизонтальной
строкой. ES
комплексы, которые подвергаются
химическому преобразованию, занимая
активный центр, записываются в круглых
скобках. Последовательные реакции - это
реакции которые требуют, чтобы все
субстраты присутствовали перед тем как
будет образован любой продукт.
Последовательные реакции могут быть
или упорядоченными, при которых
соблюдается обязательный порядок
добавления субстратов и высвобождения
продуктов, или случайными, при которых
не соблюдается обязательный порядок
связывания или высвобождения. В реакциях
пинг-понга продукт высвобождается
раньше, чем свяжутся все субстраты. Для
бисубстратных реакций этого типа,
после связывания первого субстрата
фермент модифицирует свою структуру,
и катализирует образование первого
продукта, после чего связывается второй
субстрат и измененный фермент
восстанавливается в свою первоначальную
форму и высвобождает второй продукт.
Связывание и освобождение лигандов в
пинг-понговом механизме обычно указывается
наклонными линиями.
Скорость реакции зависит от концентрации фермента
Концентрация фермента также влияет на скорость химической реакции. На рис.2-9 показано влияние снижения концентрации фермента наполовину от исходной на значения двух кинетических параметров Vmax и Км при насыщающей концентрации субстрата. В этих условиях, каждая молекула фермента связана с молекулой субстрата и будет взаимодействовать с ним, превращая его в продукт, со скоростью какой только может. Если удвоить число молекул фермента, мы получим в два раза больше ферментов, связанных с субстратом, так что скорость суммарной реакции должна удвоиться

Рис 2-9.Зависимость скорости реакции от концентрации фермента. Используемые концентрации фермента различались в два раза (см текст).
Из графика видно, что Vmax реакции снизилась с 10 до 5 единиц. Значение Км при этом не изменилось. Изменение числа молекул фермента, таким образом, не изменило их индивидуальных химических характеристик, и сродство фермента к субстрату осталось прежним, хотя максимальная скорость при этом пропорциональна количеству фермента. Это обстоятельство находит широкое применение для исследования количества ферментов в клинико-биохимической диагностике патологических состояний, при которых ферменты из повреждённых тканей попадают в кровь.
Исследование обычно проводится в условиях максимального насыщения ферментов субстратами, поскольку в таких условиях значительные колебания концентрации субстрата не оказывают влияние на измеряемую активность. Это зона реакции нулевого порядка на графике зависимости скорости реакции от количества субстрата. Однако пропорциональность между активностью ферментов и их количеством может быть нарушена. В присутствии тормозящих или стимулирующих активность фермента веществ, на основе измерения активности могут быть сделаны ложные выводы о количестве фермента. Поэтому, измеряя активность фермента, нельзя судить о его количестве. Данные о количестве фермента можно получить лишь с учетом кинетики данной реакции.
