
- •Міністерство освіти і науки україни
- •Термохімія.
- •Напрям перебігу хімічних процесів.
- •Експериментальна частина.
- •Лабораторна робота "Визначення теплового ефекту реакції нейтралізації" Хід роботи
- •Розрахунки
- •Лабораторна робота «Визначення молярної теплоти розчинення солі» Хід роботи
- •Обробка експериментальних даних
- •Питання для самоконтролю
- •Задачі і вправи для самостійної роботи
- •Рекомендована література
Термохімія.
Теплові
ефекти хімічних процесів вивчає
термохімія. При розрахунках використовуються
стандартні теплові ефекти
![]() ,тобто визначені за стандартних умов
(за температури 298,15 К і тиску 101,3 кПа).
Рівняння реакцій, в яких зазначено
тепловий ефект, а також агрегатний стан
речовин, називаютьтермохімічними.
З такими рівняннями можна виконувати
ті ж дії, що і з алгебраїчними (складати,
віднімати, помножувати на коефіцієнт
тощо).
,тобто визначені за стандартних умов
(за температури 298,15 К і тиску 101,3 кПа).
Рівняння реакцій, в яких зазначено
тепловий ефект, а також агрегатний стан
речовин, називаютьтермохімічними.
З такими рівняннями можна виконувати
ті ж дії, що і з алгебраїчними (складати,
віднімати, помножувати на коефіцієнт
тощо).
Усі термохімічні розрахунки базуються на двох законах термохімії.
Перший закон термохімії – закон Лавуазьє і Лапласа(1760) формулюється так:Тепловий ефект утворення хімічної сполуки дорівнює тепловому ефекту розкладання цієї сполуки тільки із зворотним знаком.
Наприклад, при утворенні 1 моль води із водню і кисню виділяться 241,8 кДж/моль.
![]() кДж/моль
кДж/моль
Таку саму енергію треба затратити, щоб розкласти 1 моль пароподібної води на водень і кисень, тобто
![]() кДж/моль
кДж/моль
Теплота утворення– це тепловий ефект реакції утворення 1 моль даної сполуки з простих речовин, найстійкіших за даних умов.
![]() ,
,
![]() ,0
кДж/моль
,0
кДж/моль
Теплота
утворення, віднесена до 1 моль речовини
за температури 298 К і тиску 101 кПа (760 мм
рт. ст.), називається стандартною теплотою
утворення і позначається
![]() .
.
Значення стандартних теплот утворення багатьох хімічних сполук визначені й зведені в таблиці термодинамічних величин і наводяться в довідниках.
Теплота
утворення (ентальпія утворення) простих
речовин у стійкому стані за стандартних
умов має нульове значення. Наприклад,
![]() ,
,![]()
![]()
![]() .
.
Другий закон термохімії – закон Гесса (основний закон термохімії)(1840) формулюється так:Тепловий ефект хімічної реакції не залежить від характеру й послідовності її стадій, а визначається лише початковими і кінцевими продуктами реакції та їх фізичним станом(приV=constабоP=const).
Наприклад, при згорянні 1 моль графіту з утворенням вуглекислого газу (СО2) виділяється 393,0 кДж теплоти. Якщо процес провести через проміжну стадію з утвореннямСОі подальшим його згорянням доСО2, то в першому випадку (утворенняСО) виділяється 110,5 кДж теплоти, а в другому (утворенняСО2зСО) виділяється 282,5 кДж.
Із цього прикладу видно, що сума теплових ефектів проміжних реакцій (110,5+282,5=393,0 кДж/моль) дорівнює тепловому ефекту прямої реакції.
Примітка: Закон Гесса застосовують до процесів, що відбуваються при постійному об’ємі або при постійному тиску.
Наслідки із закону Гесса:
1.Тепловий ефект хімічної реакції ΔНох.р. дорівнює сумі теплот утворення продуктів реакції мінус сума теплот утворення вихідних речовин.Тобто для реакції
аА+вВ=сС+dD(3)
![]() (4)
(4)
Приклад.Визначити тепловий ефект![]() реакціїAl2O3+3SO3=Al2(SO4)3,якщо відомо, що
реакціїAl2O3+3SO3=Al2(SO4)3,якщо відомо, що![]() =
-1675 кДж/моль;
=
-1675 кДж/моль;![]() =
-395 кДж/моль;
=
-395 кДж/моль;![]() =
-3434 кДж/моль.
=
-3434 кДж/моль.
Розв’язання.Згідно з рівнянням (4) маємо
![]() =-3434+1675+3·395,2=-553,4кДж
=-3434+1675+3·395,2=-553,4кДж
2.Тепловий ефект хімічної реакції ΔНх.р. дорівнює сумі теплот згорання вихідних речовин мінус сума теплот згорання продуктів реакції.Тобто для реакції(3)
![]() (5)
(5)
Стандартною теплотою (ентальпією) згоряння називається тепловий ефект реакції окислення 1 моль даної сполуки в атмосфері кисню до утворення вищих оксидів елементів, які входять до її складу, за стандартних умов. Значення стандартної ентальпії згоряння також можна найти в термодинамічних таблицях.
Із закону Гесса витікає ще кілька наслідків:
якщо здійснюються дві реакції, які приводять із різних початкових станів до однакових кінцевих станів, то різниця теплових ефектів дорівнює тепловому ефекту переходу з одного початкового стану в другий;
якщо здійснюються дві реакції, які приводять із однакових початкових станів до різних кінцевих станів, то різниця між їхніми тепловими ефектами дорівнює тепловому ефекту переходу з одного кінцевого стану в другий.
Таким чином, застосовуючи закон Гесса, можна обчислити теплові ефекти окремих реакцій, особливо проміжних стадій, які експериментальним шляхом визначити неможливо.
У термохімії визначають й інші теплові ефекти: теплоту розчинення, теплоту нейтралізації, теплоту плавлення та ін.
Теплота розчинення.
Багато хімічних реакцій перебігає у розчинах, і їх тепловий ефект залежить не тільки від енергії хімічної взаємодії самих речовин, але і від теплоти їх розчинення в розчиннику.
Теплота
розчинення твердої речовини в основному
є сумою двох величин: теплоти руйнування
кристалічної решітки (![]() >0)
та теплоти сольватації іонів молекулами
розчинника (
>0)
та теплоти сольватації іонів молекулами
розчинника (![]() <0):
<0):
![]() =
=![]() +
+![]()
Знак сумарного теплового ефекту залежатиме від того, який із цих доданків більший за абсолютною величиною.
У залежності від того, розчиняється речовина в чистому розчиннику чи в розчині певної концентрації, розрізнюють інтегральні і диференціальні теплоти розчинення.
Інтегральною
теплотою розчинення називається
тепловий ефект розчинення
1 моля речовини в такій кількості
розчинника, щоб отримати
розчин заданої концентрації. Якщо при
розчиненні утворюється
нескінченно розбавлений розчин, то
тепловий ефект розчинення
називають першою
інтегральною теплотою розчинення
![]() .
Практично її визначають екстраполяцією
концентраційної залежності
інтегральної теплоти розчинення на
нульову концентрацію. У разі утворення
насиченого розчину йдеться про повну
(останню)
інтегральну теплоту розчинення.
.
Практично її визначають екстраполяцією
концентраційної залежності
інтегральної теплоти розчинення на
нульову концентрацію. У разі утворення
насиченого розчину йдеться про повну
(останню)
інтегральну теплоту розчинення.
Диференціальною
(парціальною
мольною) теплотою
розчинення
![]() називається тепловий ефект розчинення
1 моля речовини у нескінченно
великій кількості розчину цієї речовини
заданої концентрації.
називається тепловий ефект розчинення
1 моля речовини у нескінченно
великій кількості розчину цієї речовини
заданої концентрації.
Теплота нейтралізації.
Теплота нейтралізації - тепловий ефект, який спостерігається при нейтралізації одного моль еквівалента кислоти одним моль еквівалента гідроксиду в розведених водних розчинах.
При взаємодії 1моль еквівалента сильної кислоти з 1моль еквівалента сильного гідроксиду в розведених водних розчинах виділяється майже однакова кількість теплоти
![]() =
-55,9 кДж/моль
(при 298 К).
=
-55,9 кДж/моль
(при 298 К).
Розглянемо для прикладу реакцію нейтралізації сильної кислоти сильною основою (лугом):
НС1 + NaOH = NaC I + Н2О,
або в іонній формі:
Н+ + Сl- + Na+ + ОН- = Na+ + Сl- + Н2О.
Після скорочення одержимо:
Н+
+ ОН-
= Н2О;
![]() =
-55,9кДж/моль.
=
-55,9кДж/моль.
Сталість теплот нейтралізації пов'язана з тим, що при взаємодії будь-якої сильної кислоти з будь-якою сильною основою, повністю дисоційованими у водних розчинах, у всіх випадках протікає однакова реакція: з іонів Н+ кислоти і іонів ОН- гідроксиду утворюються молекули води. Зрозуміло, що однаковим реакціям відповідає й однаковий тепловий ефект.
Нейтралізація
слабких кислот сильними основами або
сильних кислот слабкими основами
супроводжується одночасно дисоціацією
слабкого електроліту. При цьому
виділяється або поглинається теплота
дисоціації
![]() ,
яка залежить від кількості теплоти, що
поглинається при розпаді молекул
слабкого електроліту на іони й теплоти
сольватації іонів слабкого електроліту
молекулами розчинника. Залежно від
того, яка теплота з двох названих буде
більшою, теплота дисоціації може бути
додатною або від'ємною. Таким чином,
теплота нейтралізації слабких кислот
і гідроксидів складається із теплоти
утворення води з іонів Н+
і ОН-
(-55,9 кДж/моль) і теплоти дисоціації
слабкого електроліту
,
яка залежить від кількості теплоти, що
поглинається при розпаді молекул
слабкого електроліту на іони й теплоти
сольватації іонів слабкого електроліту
молекулами розчинника. Залежно від
того, яка теплота з двох названих буде
більшою, теплота дисоціації може бути
додатною або від'ємною. Таким чином,
теплота нейтралізації слабких кислот
і гідроксидів складається із теплоти
утворення води з іонів Н+
і ОН-
(-55,9 кДж/моль) і теплоти дисоціації
слабкого електроліту
![]() :
:
![]() =
-55,9 +
=
-55,9 +
![]() .
.
Теплоємність.
Загальна
теплоємність системи — це кількість
теплоти, яка потрібна
для підвищення температури системи на
один градус. Оскільки вона
є величиною екстенсивною, то більш
зручно користуватися теплоємністю,
віднесеною до одиниці кількості речовини.
В залежності від цього розрізняють
питому
(на
1 г чи 1 кг маси речовини)
та мольну
(на
1 моль) теплоємності. Їх
величини
залежать також
від умов нагрівання — СV
(при
V
=
const)
та
Ср
(р = const).
Теплоємність
залежить від природи речовини, а також
від температури, тому розрізняють
середню теплоємність
![]() (чи
(чи
![]() )
у заданому
інтервалі температур (від Т1
до
Т2)
та
істинну теплоємність Ср
(або
СV)
при
заданій температурі Т.
Середня
теплоємність
)
у заданому
інтервалі температур (від Т1
до
Т2)
та
істинну теплоємність Ср
(або
СV)
при
заданій температурі Т.
Середня
теплоємність
![]() ;
;
![]() .
.
а істинна теплоємність
![]() ;
;
![]()
Середня
теплоємність наближається до істинної
(![]() →Cр)
при
зменшенні температурного інтервалу,
коли (Т2—
Т1)
—> 0. Для 1 моль ідеального газу Cр
=
CV
+R
(рівняння Майєра).
Робота розширення 1 моль ідеального
газу в різних процесах розраховується
за формулами:
→Cр)
при
зменшенні температурного інтервалу,
коли (Т2—
Т1)
—> 0. Для 1 моль ідеального газу Cр
=
CV
+R
(рівняння Майєра).
Робота розширення 1 моль ідеального
газу в різних процесах розраховується
за формулами:
|
Ізобарний процес (p=const) |
Ізохорний процес (V=const) |
Ізотермічний процес (T=const) |
Адіабатичний процес (δQ=0) |
|
Ap=p(V2 - V1) pV=RT Wp=R(T2 - T1) |
dV=0 AV=0 |
AT=
RT |
δA=-dU; CV=dU/dT; dU= CV∙dT; δAQ=- CV∙dT; AQ= CV∙(T1 - T2); |
Температурну залежність Cр звичайно представляють у вигляді емпіричних рівнянь типу
Cр = а +bТ + cT 2 ; Cр = а +bТ + c′ T -2
та інших. У довідкових таблицях наводяться значення коефіцієнтів a, b, c, c′… та інтервал температур, для якого виправдовуються ці залежності.
Залежність теплового ефекту хімічних реакцій від температури описується рівнянням К.Кірхгофа в диференціальній
(d∆Hp/dT)p
= ∆Cp
та інтегральній
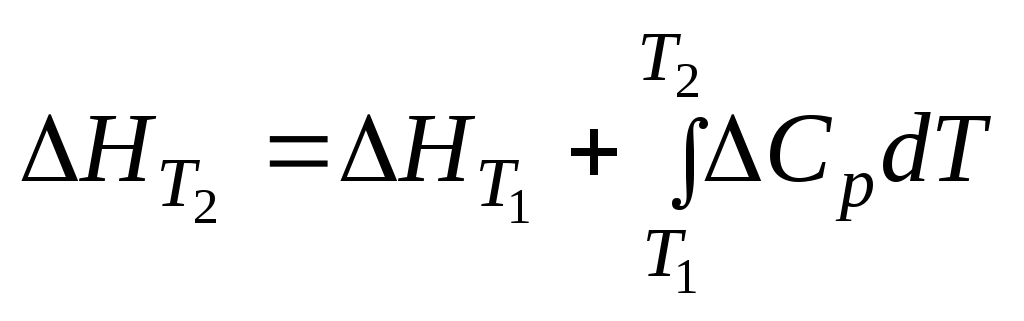 формах.
формах.
