
- •Глава 6. Электрометаллургия марганцевых ферросплавов
- •6.1. Свойства марганца и его соединений
- •6.2. Минералы, руды и концентраты марганца
- •6.3. Технология сушки и окускования марганцевых концентратов
- •6.4. Технология выплавки высокоуглеродистого ферромарганца
- •6.5. Технология выплавки ферросиликомарганца
- •6.7. Технология получения азотированного марганца и силикомарганца
Глава 6. Электрометаллургия марганцевых ферросплавов
6.1. Свойства марганца и его соединений
Марганец – элемент VIIb группы Периодической системы элементов Д.И.Менделеева*. Порядковый номер марганца 25, атомная масса 54,93, конфигурация внешней электронной оболочки атома 3d54s2, степень окисления от 2 до 7, наиболее устойчивы Mn(II) и Mn(IV). Известны четыре кубические кристаллические модификации марганца: ниже 727оС устойчива а = 0,89124 нм, z = 58, плотность 7,44 г/см3, при 727–1090оС – Mn (а = 6300 нм, z = 20, плотность 7,29 г/см3), при 1090–1138oC – -Mn (а = 0,38550 нм при 1100оС, z = 4, плотность 6,37 г/см3), выше 1138оС – -Mn (а = 0,30750 нм при 1143оС, z = 2, плотность 6,28 г/см3). Температура плавления 1244оС. Марганец имеет аномально высокую упругость пара. Зависимость давления пара марганца от температуры в интервале 1245–1545оС описывается уравнением:
lgPMn(Па) = 10,8828 – 13625/Т (1043 Т 1158 K)
lgPMn(Па) = 20,005 – 14850/Т + 2,52lgT (1517 Т 2353 K).
Система Mn–Fe (рис. 6.1). В системе Mn–Fe существует большая область твердого раствора на основе –Fe и –Mn. Растворы на основе -Mn и -Mn образуются при концентрации >68–70%Mn.
Низкая температура плавления сплавов в системе Mn–Fe составляет 1232оС при атомном содержании марганца 87%.
Интегральная энтальпия смешения достигает максимума –8360 Дж/моль при хMn = 0,7.
Система Mn–C (рис. 6.2). В системе идентифицированы следующие карбиды: Mn23C6 (5,38% C), Mn3C (6,77% C), Mn5C2 (8,03% C), Mn7C3 (8,57% C).
Кривая
ликвидус на диаграмме состояния Мn–С
в координатах концентрация углерода
(ат. доли) – температура может быть
выражена уравнением: lg[С]
= –375,8/Т
– 0347. Зависимость ∆G![]() (T)
для реакции растворении графита в жидком
марганце Ст
+ Мnж
= [C]Mn
имеет вид:
(T)
для реакции растворении графита в жидком
марганце Ст
+ Мnж
= [C]Mn
имеет вид:
_____________________
* Гасик М.И. Марганец, М.: Металлургия. 1992. – 608 с.
∆G![]() =
17600 – 25,64Т,
Дж/моль.
=
17600 – 25,64Т,
Дж/моль.

Рис. 6.1. Диаграмма равновесного состояния системы Fe–Mn

Рис. 6.2. Диаграмма равновесного состояния системы Mn–C
Зависимость изменения энергии Гиббса реакции образования высшего карбида марганца Мn7С3 из элементов 7Мn + 3С = Мn7С3 от температуры в интервале 1000-1150 K описывается уравнением:
∆G![]() =
66155
– 58,24Т,
Дж/моль.
=
66155
– 58,24Т,
Дж/моль.
Система Mn–Si (рис. 6.3). Диаграмма состояния системы построена с учетом существования 7 силицидов марганца и твердых растворов кремния в марганце.

Рис. 6.3. Диаграмма равновесного состояния системы Mn-Si
Теплоты образования силицидов марганца Мn3Si, Мn5Si3, МnSi, МnSi1,7 соответственно равны 17; 24,85; 30,5 и 28,15 кДж/моль. Плотность жидких сплавов системы Мn–Si с повышением концентрации кремния уменьшается. При 1500 K и содержании кремния 30% и 60% (ат.) плотность сплавов составляет 5,31 и 4,35 г/см3 (6,37 и 2,32 г/см3 для чистых марганца и кремния).
Активность марганца и кремния в расплавах Мn–Si зависит от состава сплава и температуры. Кривые аMn и аSi (рис. 6.4) пересекаются.

Рис. 6.4. Активность марганца и кремния в сплавах системы Mn–Si
при
1873 K
(аMn
и aSi
– для гипотетического идеального, а![]() иа
иа![]() – для модельного растворов)
– для модельного растворов)
Структурными единицами расплавов системы Mn–Si в аспекте модели ассоциированных растворов* приняты Mn, S и три ассоциата Mn3Si, Mn2Si и MnSi. С помощью оптимизационной процедуры Б.М. Могутновым и др. (Россия) рассчитаны значения энтальпии и изменение энтропии, сопровождающие процессы ассоциации в системе Mn–Si (рис. 6.5):
|
ассоциаты |
–∆Но, Дж/моль |
∆So, Дж/(мольK) |
|
Mn3Si |
3553 |
–18,48 |
|
Mn2Si |
101066 |
–15,15 |
|
MnSi |
93567 |
–22,53 |
Как следует из данных рис. 6.5, наибольшую долю в расплавах Mn–Si при 1873 K представляют ассоциаты MnSi.
Система Mn–Si–C (рис. 6.6). Растворимость и активность углерода в расплавах системы Mn–Si–C снижается по мере повышения содержания кремния, что объясняется более высокой термодинамической прочностью химических связей атомов марганца с кремнием, чем с углеродом**.
____________________
* Щелкова Н.Е., Зайцев А.И., Могутнов Б.М. //Расплавы. – 1999, – №3. – С.35-43
** Tang K., Olsen S/E/ Manganese and silicon activities in liquid carbon-saturated Mn–Si–C allos //Steel Res. 2002/ 73. №3. – C.77-82 (РЖ Металлургия. 03.01-15Г148)
Это положение является общим для расплавов систем Fe–Si–C, Mn–Si–C и Cr–Si–C, а также для расплавов систем (Mn, Fe)–Si–C, (Cr, Fe)–Si–C и (Cr, Mn)–Si–C. На рис. 6.7 представлены криволинейные зависимости равновесных содержаний углерода в расплавах системы Mn–Si–C (кривая 1), системы (Mn, Fe)–Si–С (кривые 2, 3 и 4) и системы Fe–Si–C (кривая 5) при 1600оС.

Рис.6.5. Силикокарбидные фазы в системе Mn–Si–C

Рис. 6.6. Диаграмма равновесного состояния системы Mn–Si–C

Рис. 6.7. Равновесные содержания углерода в зависимости от концентрации кремния в системах: 1 – Mn-Si-Cнас; 2 – Mn–Fe–Si–Cнас при %Mn/%Fe = 4; 3 – Mn–Fe–Si–Cнас при %Mn/%Fe = 2;
4 – Mn–Fe–Si–Cнас при %Mn/%Fe = 1; 5 – Fe–Si–Cнас
Наиболее высокая растворимость углерода имеет место в системе Mn–Si–C, наиболее низкая в системе Fe–Si–C. По мере уменьшения отношения %Mn/%Fe равновесная растворимость углерода уменьшается. Существенное различие в растворимости углерода в рассматриваемых системах при содержании кремния до ~10–15%, постепенно уменьшается, и свыше 23-25% кривые сливаются. Важно отметить, что при увеличении содержания кремния до 23–25% равновесной фазой является графит. В концентрационной области содержания кремния более 23–25% расплавы находятся в равновесии с карбидом кремния. Для системы Mn–Si–C предельным значением содержания кремния, при котором углерод может сосуществовать с карбидом кремния, является 23,48% Si, что соответствует составу фазы Новотного (Mn5Si3Cx).
В торговых марках ферросиликомарганца в зависимости от марки сплава может содержаться до 15-20% Fe при 65% Mn. На рис. 6.8 представлен марганцевый угол тройной диаграммы [Mn, Fe]–Si–C при отношении %Mn/%Fe = = 4. Обращает внимание наличие областей существования железомарганцевых силикокарбидов [Mn, Fe]17Si4C3, [Mn,Fe]3SiC в равновесии с графитом и силикокарбида марганца Mn5Si3Cx в равновесии с SiC. Положение изотерм растворимости углерода в расплавах системы [Mn, Fe]–Si–C при %Mn/%Fe = 4 свидетельствует, что с понижением температуры равновесное содержание углерода снижается и процесс сопровождается выделением графита или карбида кремния.
Граница равновесии карбосилицидных фаз и расплавов Mn–Fe–Si–C с графитом и SiC на рис. 6.8 представлена ломанной линией.

Рис.6.8. Фазовые равновесия в марганцевом углу диаграммы Ме(Mn:Fe=4:1) –Si–C с указанием областей состава сплавов в равновесии с SiC и графитом (INFACON-96); изотермы в оС
Система Mn–P (рис. 6.9). Фосфор не образует твердых растворов в марганце, но известен ряд фосфидов марганца Mn3P, Mn2P, Mn3P2 MnP (табл. 6.1).
Таблица 6.1. Энтальпия и энтропия фосфидов марганца
|
Фосфид |
–∆Н |
S |
|
Mn3P |
161 |
89,0 |
|
Mn2P |
150 |
76,0 |
|
MnP |
96 |
49,2 |
В расплавах системы Мn–Р имеет место сильное межчастичное взаимодействие марганца с фосфором, характеризующееся значительным отрицательным отклонением от закона Рауля.

Рис. 6.9. Диаграмма равновесного состояния системы Mn–P:
а – по экспериментальным данным; б – по результатам термодинамического расчета
Система
Мn–S
(рис.
6.10). Марганец
с
серой образует термодинамически прочные
сульфиды марганца MnS
и MnS2.
Сульфид МnS
плавится при 1610оС.
Изменение термодинамического потенциала
реакции образования сульфида Мnт
+
![]() Sт
=
МnSт
в интервале 973–1573 K
описывается выражением ∆G
Sт
=
МnSт
в интервале 973–1573 K
описывается выражением ∆G![]() =
–296520 + 76,73Т,
Дж/моль.
=
–296520 + 76,73Т,
Дж/моль.
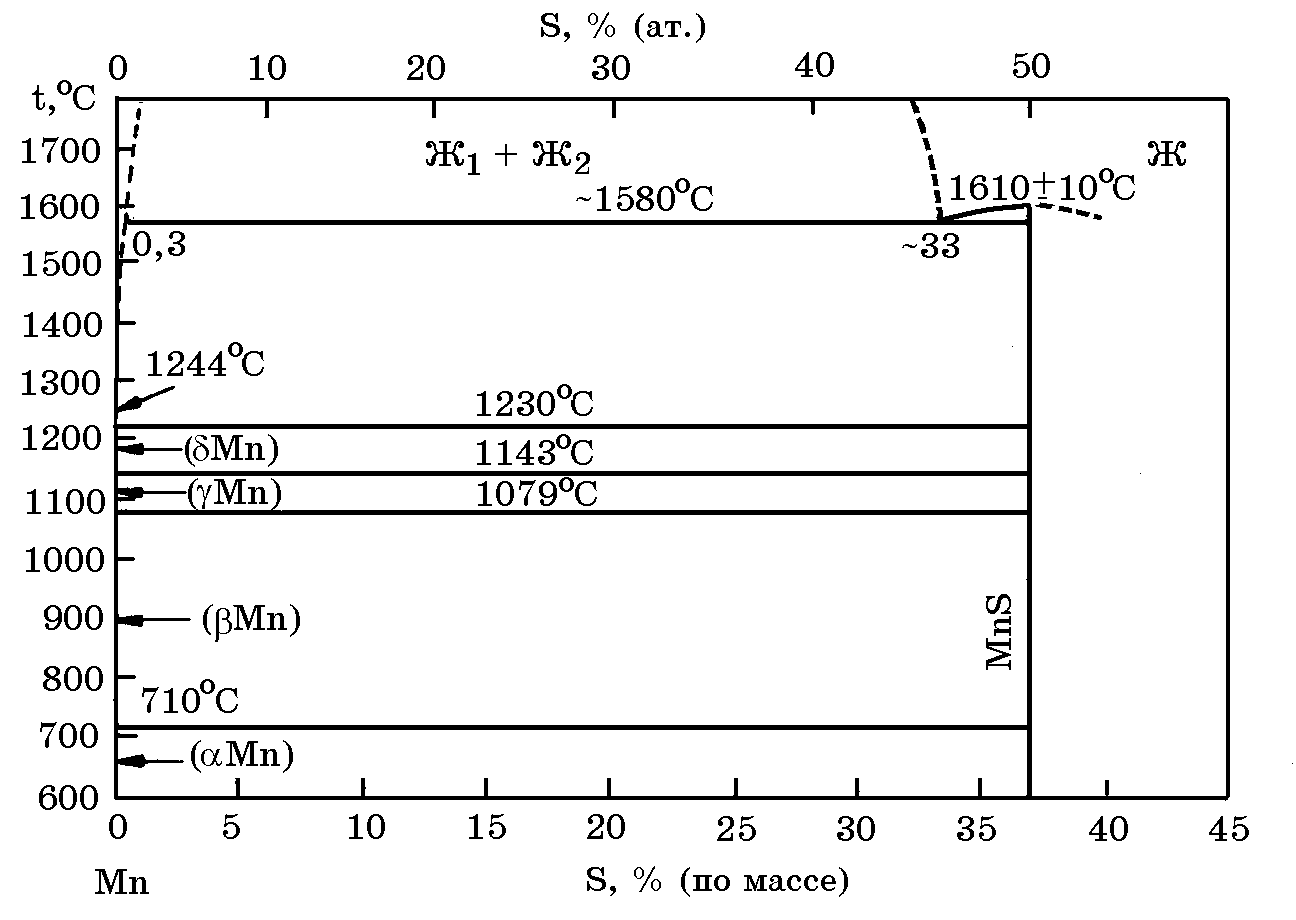
Рис. 6.10. Диаграмма равновесного состояния системы Mn–S
Система Mn–O (рис. 6.11). Уравнение для расчета растворимости кислорода в жидком марганце при аMnO = 1 имеет вид: lg[O]Mn = –4823/Т + 1,159. Эвтектике при 1245оС соответствует содержание кислорода 0,0095%.

Рис. 6.11. Диаграмма равновесного состояния системы Mn–O
Для электрометаллургии марганца большой интерес представляет знание свойств оксидов марганца MnO2, Mn2О3, Mn3O4 и MnO (табл. 6.2).
Таблица 6.2. Физико-химические свойства оксидов марганца
|
Показатели |
MnO |
Mn3O4 |
Mn2O3 |
MnO2 |
|
Относительная молекулярная масса |
70,93 |
228,81 |
157,87 |
86,93 |
|
Содержание кислорода, %: атомное массовое |
|
|
|
|
|
50 |
57,12 |
60 |
66,67 | |
|
22,55 |
27,97 |
30,40 |
36,80 | |
|
Плотность, г/см3 |
5,18 |
4,70 |
4,94 |
5,026 |
|
Теплота
образования –∆Н |
385,186 |
1387,5 |
971,75 |
521,257 |
|
Стандартная
энтропия S |
61,5 |
148,63 |
110,53 |
53,172 |
|
Изменение
энергии Гиббса –∆G |
363,41 |
1281,16 |
882,0 |
466,409 |
|
Температура плавления, оС |
1845 |
1590 |
1350 |
850 |
Термическая диссоциация оксидов марганца. Масс-спектроскопическим методом определены давления кислорода и состав паровой фазы над МnO2, Mn2O3, Mn3O4 и MnO (табл. 6.3).
Таблица 6.3. Термодинамические данные реакций термической диссоциации кислородных соединений марганца по результатам масс-спектроскопических исследований
|
Реакция |
lgp |
Т, K |
|
4MnO2(т) = 2Mn2O3(т)+O2(газ) |
lgp |
560–640 |
|
6Mn2O3(т) = 4Mn3O4(т)+O2(газ) |
lgp |
810–910 |
|
2Mn3O4(т) = 6MnO + O2(газ) |
lgp |
1270–1350 |
|
2MnOт = 2Mnгаз + O2(газ) |
lgp |
1602–1747 |
Термическая диссоциация низших оксидов марганца Мn3O4 и МnO происходит по реакциям 3 и 4 (см. табл. 6.3), причем давление диссоциации зависит только от температуры, так как Мn3O4 практически не имеет области гомогенности (рис.6.11).
При испарении МnО паро-газовая фаза состоит из ионов Мn+, МnО+, O+; интенсивность ионов МnO+ и О+ незначи-тельна.
Система MnO–CO2. В этой системе образуется карбонат марганца MnCO3 (родохрозит). При нагревании МnСО3 в интервале 620–690оС карбонат диссоциирует по реакции: МnCО3 = МnО + CO2. Механизм диссоциации MnСО3 сложен.
Система MnO–SiO2 (рис. 6.12). Закись марганца MnO с кремнеземом образует два соединения: тефроит (Мn2SiО4, 70,92% МnО) и родонит (МnSiO3, 54,19% МnО). Тефроит устойчив до температуры плавления 1345оС, родонит перитектически разлагается при 1291оС. В системе имеются две эвтектики, которым соответствуют температуры 1315оС и 1251оС.

Рис. 6.12. Диаграмма равновесного состояния MnO–SiO2
Тефроит
(ортосиликат) и родонит (метасиликат)
образуются из
оксидов
по реакциям:
2MnО
+ SiО2
= МnSiО3,
∆Н![]() = –59440
Дж/моль
и МnО
+ SiО2
= МnSiО3
∆Н
= –59440
Дж/моль
и МnО
+ SiО2
= МnSiО3
∆Н![]() =
–29220 Дж/моль.
=
–29220 Дж/моль.
Активности MnO и SiO2 в двухфазных температурно-концентрационных областях MnО + Ж и SiO2 + Ж диаграммы состояния MnO–SiO2 (рис. 6.12) равны единице. В однофазной области существование расплава (Ж) активности MnO и SiO2 изменяются; с увеличением доли MnO ее активность увеличивается, а активность SiO2 уменьшается (рис. 6.13). при выборе в качестве стандартного состояния чистых твердых оксидов MnO и SiO2 зависимость логарифма коэффициента активности MnO и SiO2 от их мольных долей имеет вид:
lgfMnO = –3,123(1 – xMnO)2 + 0,348;
lgf![]() = –3,123(1 – x
= –3,123(1 – x![]() )2
+ 1,188.
)2
+ 1,188.

Рис.
6.13.
Активность оксида марганца а![]() и кремнезема а
и кремнезема а![]() в системе MnO–SiO2
при 1600оС
в системе MnO–SiO2
при 1600оС
Результаты расчетов коэффициентов активности и активности MnO и SiO2 по данным Б.П. Бурылева и Л.П. Мойсова* приведены ниже:
|
x |
0,526 |
0,550 |
0,600 |
0,650 |
0,700 |
0,737 |
|
x |
0,474 |
0,450 |
0,400 |
0,350 |
0,300 |
0,263 |
|
f |
0,443 |
0,520 |
0,705 |
0,923 |
1,256 |
1,355 |
|
f |
2,108 |
1,751 |
1,158 |
0,739 |
0,455 |
0,310 |
|
a |
0,233 |
0,286 |
0,423 |
0,600 |
0,879 |
1,000 |
|
a |
1,000 |
0,788 |
0,463 |
0,258 |
0,136 |
0,082 |
________________________
* Бурылев Б.П., Мойсов Л.П. //Известия вузов. Черная металлургия. 2001, №8, С.3-5
