
Konspekt_lekcii
.pdf
Видима |
400 – 750 |
||
|
фіолетовий |
390 – 420 |
|
|
синій |
420 – 455 |
|
|
голубий |
455 – 494 |
|
|
зелений |
494 – 565 |
|
|
жовтий |
565 – 595 |
|
|
оранжевий |
595 – 640 |
|
640 – 750 |
|||
|
червоний |
||
|
|||
Інфрачервона |
750 – 106 |
||
|
ближня |
750 – 25·103 |
|
|
дальня |
25·103 – 106 |
|
Практично всі області електромагнітного випромінювання використовуються для визначення хімічного складу речовин. Предметом нашого розгляду є оптичні методи аналізу, які використовують електромагнітне випромінювання оптичного діапазону, яке охоплює довжини хвиль (1 - 1 105 нм) і складається з ультрафіолетової, видимої і інфрачервоної областей. Це випромінювання пов'язане з процесами, які відбуваються з участю зовнішніх (оптичних, валентних) електронів атомів, і з просторовою будовою молекул.
Випромінювання, яке складається з електромагніних коливань певної довжини хвилі називається монохроматичним. У природі монохроматичне випромінювання зустрічається рідко. Зазвичай випромірювання складається з електромагнітних коливань різних довжин хвиль.
Сукупність довжин хвиль, частот або енергій фотонів, з яких складається випромінювання називається спектром.
Спектри бувають суцільні (безперервні), смугасті та лінійчасті. Випромінювання суцільного спектра складається з сукупності електомагнітних хвиль, довжини яких змінюються безперервно. Смугастий спектр складається з декількох смуг, в межах яких довжини хвиль змінюються безперервно, розділених інтервалами відсутності випромінювання. Лінійчасті спектри характеризуються сукупністю випромінювання певних довжин хвиль (рис. 2.1).
|
а |
|
|
|
|
б |
|
в |
|
|
|
Рис. 2.1. Види спектрів випромінювання:
а - суцільний (безперервний), б - смугастий, в - лінійчастий.
Для хімічного аналізу використовуються закономірності як випромінювання електромагнітних хвиль об'єктом аналізу, так і взаємодії випромінювання від стороннього джерела з матеріалом об'єкту аналізу.
2.2. Емісійний спектральний аналіз
2.2.1. Механізм і закономірності випромінювання електромагнітних коливань атомами.
13

Емісійний спектральний аналіз належить до чисто фізичних методів аналізу і грунтується на вивченні спектра випромінювання атомів досліджуваного зразка.
Випромінювання зумовлене процесами, які проходять в атомах, збуджених тепловою або електричною дією, або внаслідок поглинання електромагнітних коливань. Процеси збудження атомів відбуваються за участю електронів зовнішніх електронних оболонок.
Положення електронів в атомі визначається чотирма квантовими числами, при яких атом існує стаціонарно не випромінюючи своєї енергії:
1.n - головне квантове число. Характеризує відстань орбіти електрона від ядра атома. Позначається цифрами 1, 2, 3,... або літерами K, L, M,...
2.l - побічне (орбітальне) квантове число. Характеризує форму орбіти. Набуває послідовні значеня від l=0 до l=n-1. Позначаються цифрами 0, 1, 2, 3,... або літерами s, p, d, f,...
3.ml - магнітне квантове число. Характеризує просторове розташування орбіти. Набуває ряду послідовних цілих значень від +l до -l.
4.ms – спінове квантове число. Характеризує момент обертання самого електрона.
Набуває значень 12 і 12 .
Чим більше значення n i l, тим більше енергія електронів. За принципом Паулі в атомі не може бути двох електронів з однаковим набором всіх квантових чисел. Тому в атомі, який знаходиться в нормальному стані (без надлишку енергії), всі електрони займають такі орбіти, що сумарна енергія електронів має мінімальне значення.
При зіткненні атома з іншими атомами, йонами, електронами проходить обмін енергією, внаслідок якого атом може дістати надлишкову енергію. Якщо атом не віддасть надлишкову енергію шляхом зіткнень з іншими частинками, він може перейти в збуджений стан. Збуджений стан атома характеризується тим, що один або декілька його електронів знаходяться на орбітах з більшим значенням енергії.
В одному акті збудження бере участь переважно один електрон зовнішньої або недобудованої внутрішньої орбіти. Такі електрони називають оптичними.
Згідно квантової теорії перехід електрона на вищий енергетичний рівень відбувається тоді, коли надлишкова енергія, надана атомові, рівна або більше різниці енергій рівнів, між якими відбувається перехід.
Мінімальна енергія, необхідна для переходу електрону з нормального рівня на вищий енергетичний рівень називається енергією збудження.
Якщо енергія, яка надається атому дуже велика, електрон може відірватися від атома з утворенням позитивно зарядженого йона.
Мінімальна енергія, яка потрібна для відриву електрона від атома називається енергією іонізації.
У спектроскопії поширеною одиницею вимірювання енергії є електронвольт - енергія, яку набуває електрон, проходячи різницю потенціалів 1В (1еВ = 1,6·10-19 Дж). Тому енергії збудження і іонізації часто називають потенціалами збудження і іонізації.
Атом у збудженому стані може перебувати обмежений час - 10-7…10-8 с. Якщо за цей час атом не віддає надлишкову енергію шляхом зіткнень, він випромінює фотон. При цьому електрон з вищого енергетичного рівня переходить на один з нижчих рівнів або на нормальний рівень. Енергія випромінюваного фотона точно дорівнює різниці енергій рівнів, між якими відбувається перехід. За формулою Планка можна розрахувати частоту випромінювання:
h E |
2 |
E |
|
E2 |
|
E1 |
(2.3.) |
|
|
||||||
|
1 |
|
h |
|
h |
|
|
|
|
|
|
|
|
14
Енергія рівнів виражена в одиницях частоти - E/h, називається термом. Таким чином, частота випромінювання атома дорівнює різниці термів, між якими відбувається перехід електрона.
Розглянемо випромінювання збуджених атомів на прикладі атома Al (1s2 2s2 2p6 3s2 3p1). У нормальному стані оптичний електрон знаходиться на рівні 3p, енергію якого можно прийняти за нульову позначку. Збудженими рівнями у порядку зростання енергії будуть 4s, 3d, 4p, 5s, 4d, 5p і т.д. (рис. 2.2.). Чим більша енергія, яку може дістати атом, тим більша кількість збуджених рівнів, в яких може знаходитися збуджений атом. Віддаючи енергію у вигляді кванта випромінювання електрон переходить на один з нижчих рівнів. Оскільки у атомів кожного елементу, енергії рівнів мають певні значення, які визначаються набором квантових чисел, випромінювання збуджених атомів складається з набору ліній певної довжини хвилі, тобто має лінійчастий характер.
До такого стану ізольованих атомів найближчим є стан атомної пари при атмосферному або пониженому тиску, в якому атоми знаходяться на відстані набагото більшій ніж розміри атома і час між зіткненнями більше ніж 10-6 с. Якщо атоми знаходяться у складі молекул або радикалів, рівні електронів під впливом сусідніх атомів дещо розмиваються і спектр випромінювання стає смугастим. Якщо речовина знаходиться в конденсованому стані (рідкому або твердому), рівні атомів розмиваються настільки, що спектр стає безперервним. Характеристики лінійчастих і смугастих спектрів залежать від елементного складу зразка і використовуються в хімічному аналізі. Характер безперервних спектрів практично не залежить від складу зразка і для хімічного аналізу не використовуються.
E |
5 |
|
|
4
5
4




 X
X
X 3  4
4 
Рис. 2.2. Схема збуджених рівнів атома Al і можливі переходи,
які супроводжуються випромінюванням. (Стрілками позначено дозволені переходи, перекресленими стрілками – недозволені).
3
s  p
p  d
d
Не всі можливі переходи відбуваються з однаковою ймовірністю. Найбільш ймовірні переходи, які відповідають правилам відбору. Такі переходи називаються дозволеними.
Перше правило відбору.
Перехід дозволений, якщо квантове число l змінюється на ±1 (рис. 2.2).
У багатоелектронних атомах електрони знаходяться під дією не тільки ядра, але і інших електронів. Ця взаємодія призводить до розщеплення енергетичних рівнів на підрівні з близькими, але не рівними енергіями.
Максимальне число підрівнів, на яке може розщеплюватися рівень називається мультиплетністю.
15
Мультиплетність розраховується за формулою M = 2S + 1, де S = ms. Якщо М=1 стан називають синглетним, 2 - дублетним, 3 - триплетним, 4 - квартетним і т.д.
Для алюмінію S = 1/2, M = 2, тобто 3p рівень є двічі вироджений. Перехід електрона зі збудженого рівня на нормальний супроводжується випромінюванням двох близьких за
довжиною хвиль (дублетів): |
|
|
4s → 3p 3944 Å, |
3d → 3p 3092 Å, |
5s → 3p 2652 Å |
3961 Å |
3082 Å |
2660 Å |
Друге правило відбору. |
|
|
Дозволені переходи між рівнями, які мають однакову мультиплетність.
Основні закономірності випромінювання атомів.
1.Чим вища енергія, яка може бути надана атому, тим більше варіантів збудження атомів, тим більше варіантів переходу електронів, які супроводжуються випромінюванням і тим більше ліній буде спостерігатися в спектрі атомів.
Перехід електрона з найменшого збудженого рівня на нормальний називається резонансним. Лінію, яка при цьому випромінюється також називають резонансною.
Резонансні переходи найбільш ймовірні при низькій енергії збудження, тому резонансні лінії в цих умовах мають найбільшу інтенсивність.При великих енергіях збудження кількість збуджених атомів може зменшуватися за рахунок їх іонізації і інтенсивність резонансних ліній може зменшуватися.
2.Чим більше електронів на зовнішній оболонці атома, тим більше ліній в його спектрі. Для Li число ліній - 44, для Fe - більше 3000.
3.У кожному ряду періодичної системи елементів потенціали збудження і іонізації збільшуються зліва направо. Для збудження випромінювання інертних газів необхідна максимальна енергія.
4.В межах однієї групи енергія збудження зменшується із збільшенням молекулярної маси елементів (зверху вниз).
5.Кожна лінія має свій потенціал збудження. Оскільки потенціал збудження лінії дорівнює енергії терма, з якого відбувається перехід електрона, лінії різних частот, які випромінюються з одного терма, мають один потенціал збудження. Потенціал збудження ліній, які випромінюються іонами, складається з енергії іонізації відповідного іона і енергії збудженого рівня іона.
Аналітичним сигналом емісійної спектроскопії є спекр випромінювання атомів, які одержуються внаслідок атомізації об'єкту аналізу.
Оскільки довжини хвиль, які випромінюються атомом, залежать від його будови і не залежать від кількості атомів, якісним параметром спектра є довжини хвиль у спектрі зразку.
Інтенсивність лінії певної довжини хвилі залежить від кількості атомів певного елемента в зразку і використовується як кількісний параметр аналітичного сигналу.
Емісійний аналіз зразка починається з одержання і фіксування спектра випромінювання атомів елементів, з яких складається об'єкт аналізу. Для цього використовуються спектральні прилади.
2.2.2. Структура і характеристика елементів спектральнх приладів.
Кожен прилад для емісійного спектрального аналізу складається з трьох необхідних складових частин: джерела збудження, диспергуючого елемента і приймача випромінювання (рецептора).
1. Джерело збудження. Призначення джерела збудження - перевести частину зразка в стан атомної пари (атомізація) і надати атомам додаткову енергію для їх збудження, внаслідок
16
якого вони випромінюють лінійчастий спектр. Ці процеси здійснюються за рахунок дії високих температур. Залежно від способу досягнення високих температур використовуються різні джерела збудження:
|
Джерело збудження |
Температура,К |
Об'єкт збудження |
|
|
|
|
|
|
а) |
газове полум'я: |
|
|
|
|
|
природний газ -повітря |
2000 |
лужні і деякі лужно-земельні метали, |
|
|
водень-повітря |
2300 |
потенціал збудження до 3-4 еВ |
|
|
ацетилен-повітря |
2500 |
|
|
|
водень-кисень |
2800 |
метали з потенціалом |
|
|
ацетилен-кисень |
3400 |
збудження до 5-6 еВ |
|
|
|||
|
|
ацетилен-закис азоту |
3500 |
|
б) |
Електричний дуговий розряд |
5000-7000 |
всі метали і деякі неметали |
|
в) |
Електричний іскровий розряд |
7000-12000 |
всі елементи |
|
г) Газовий розряд, ВЧ і НВЧ* розряд |
до 30000 |
всі елементи |
||
*ВЧ – високочастотний; НВЧ – надвисокочастотний.
Газове полум'я та плазма ВЧ і НВЧ розряду характеризуються стабільністю температур у просторі і часі, тому умови збудження відтворювані. Порівняно низькі температури газового полум'я обмежують кількість визначуваних елементів з цим джерелом збудження.
Дугові і іскрові джерела збудження характеризуються нестабільністю температур в просторі і часі, тому використання їх для точного кількісного аналізу вимагає спеціальних засобів при обробці аналітичного сигналу.
2.Диспергуючий елемент служить для розкладу випромінювання, яке одержують у джерелі збудження за довжинами хвиль. Для цього використовують такі пристрої:
а) Призми зі скла для видимого та кварцу для видимого і ультрафіолетового діапазону. Розділення грунтується на залежності коефіцієнту заломлення від довжини хвилі.
б) Дифракційні гратки. При відбиванні електромагнітних коливань від дзеркальної поверхні, на якій нанесено паралельні риски на відстані близькій до довжини хвилі, відбуваються процеси дифракції і інтерференції, внаслідок яких можна одержати спектр випромінювання. Використовуються для всіх диапазонів.
в) Світлофільтри. Це пристрої, які не розділяють випромінювання за довжинами хвиль, але пропускають випромінювання у вузькому спектральному діапазоні. Світлофільтри бувають абсорбційні і дифракційні. Ширина смуги пропускання кращих дифракційних світлофільтрів становить 3-5 нм.
3.Рецептор служить для фіксування одержаного спектра. Використовуються такі основні способи фіксування спектра:
а) Візуальний. Спектр спостерігається через окуляр прилада оком під час роботи джерела збудження. Око не дозволяє виміряти інтенсивність лінії, але можна порівняти інтенсивності двох ліній у вузькому спектральному діапазоні.
б) Фотографічний. Зображення спектра спрямовується на плівки або пластинки вкриті світлочутливим шаром (фотопластинки) на певний час. Після хімічної обробки експонованих пластинок спектр проявляється у вигляді почорніння у місцях, куди падало світло. Спосіб дозволяє фіксувати спектр у широкому діапазоні видимого і ультрафіолетового випромінювання. Інтенсивність ліній перетворюється в ступінь почорніння, яка може вимірюватися спеціальними приладами.
17
в) Фотоелектричний. У цьому способі використовується перетворення випромінювання в електричний сигнал пропорційний інтенсивності світла. Фотоперетворювачами можуть бути фотоелементи, фоторезистори, фотодіоди, фотопомножувачі і інші.
Окрім перелічених основних елементів спектральні прилади можуть мати оптичну систему, яка складається з щілин, лінз, дзеркал, поворотних призм і т.і.
Прилади з візуальним спостереженням спектра називаються спектроскопами, стилоскопами, стилометрами; з фотографічною реєстрацією - спектрографами; з фотоелектричною реєстрацією - спектрометрами, квантомірами.
2.2.3. Якісний емісійний спектральний аналіз.
Якісний емісійний спектральний аналіз полягає у визначенні довжини хвилі спектральної лінії і виявленні елемента, якому вона належить, користуючись довідниковою літературою. Спектри всіх елементів вивчені, занесені в таблиці, де для кожного елемента наведені довжини хвиль, їх потенціали збудження, належність ліній нейтральному атому (І), однозарядному (ІІ), двозарядному (ІІІ) і т.і., йонам, відносні інтенсивності ліній для різних джерел збудження. Існують таблиці спектральних ліній різних елементів розташованих як за довжинами хвиль, так і за елементами.
Спектри елементів складаються з багатьох (сотень, навіть тисяч) ліній різної інтенсивності. Для хімічного аналізу використовується переважно невелика кількість найбільш інтенсивних ліній, які наводяться в спеціальних таблицях чутливих ліній. Якщо метою аналізу є пошук певних елементів у зразку, в спектрі зразка шукають останні лінії елементів. Останні лінії - це найбільш чутливі лінії елементів, які зникають останніми при зменшенні концентрації елемента в зразках. Довжина хвилі останньої лінії елемента залежить від температури джерела збудження і спектральної чутливості рецептора, за допомогою якого фіксують спектр.
Для пошуку ліній певної довжини хвилі і для ідентифікації ліній необхідно вміти визначати довжину хвилі будь-якої лінії у зафіксованому спектрі.
Способи визначення довжин хвиль.
1. За шкалою прилада і дисперсійною кривою. Спектроскопи мають шкалу на барабані,
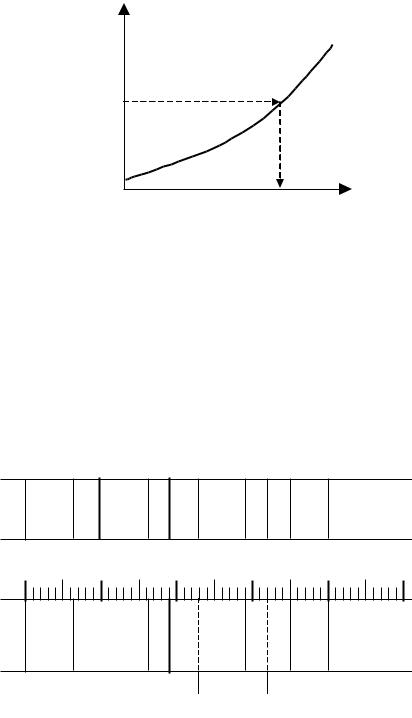
обертаючи який в окуляр спрямовують ту чи іншу ділянку спектра. У спектрографах шкала фотографується на фотопластинку поруч із спектром зразків. Шкали є лінійні і для того, щоб відлік шкали перетворити в довжину хвилі, необхідно мати дисперсійну криву, яка є графічною залежністю довжини хвилі (λ, Å) від поділок шкали (n) (рис. 2.3.). Вона будується для кожного прилада після фіксування спектру добре вивченого елемента, зазвичай заліза. Таким чином можна визначити довжину хвилі з точністю ±0,5 Å.
18
λ, Å |
|
λx |
|
nx |
n |
Рис. 2.3. Дисперсійна крива. |
|
2. За допомогою атласів спектральних ліній. Як правило використовують атлас спектральних ліній заліза. Вибір заліза зумовлений тим, що це доступний елемент і його спектр містить багато ліній (>3000) у всіх областях спектра. Атлас – це набір планшетів, на яких зафіксовані різні ділянки спектра заліза, шкала довжин хвиль і розташування характерних ліній інших елементів відносно ліній заліза.
Визначення довжини хвилі невідомого елемента полягає у співставлянні ліній з планшета спектра заліза з лініями заліза у спектрі досліджуваного зразка так, щоб лінії заліза співпадали (рис. 2.4.). Після цього роблять відлік довжини хвилі за шкалою довжин хвиль на планшеті. Точність такої процедури складає ±0,05-0,1 Å. Інколи лінія невідомого елемента може бути ідентифікована за лініями інших елементів нанесених на тому ж планшеті.
а)
б) |
3200 |
10 |
20 |
30 |
40 |
3250 , Å |
в)
г) |
Ni |
Cr |
|
Рис. 2.4. Визначення довжини хвилі за допомогою атласу спектральних ліій заліза: а) – спектр зразка, який містить залізо; б) – шкала довжин хвиль;
в) - планшет атласу спектральних ліній заліза; г) – інформаційне поле.
3. Метод лінійної інтерполяції. Для точнішого визначення довжини хвилі при фотографічному фіксуванні спектра на одну пластинку фотографують спектр об'єкту аналізу і поруч спектр заліза. У спектрі заліза вибирають дві лінії ( 1 i 2), між якими розташована лінія невідомого елементу (x). За допомогою спеціального вимірювального мікроскопа проводять відлік його шкали проти обраних ліній A1, Ax, A2 (рис. 2.5).
19

1 2
1
x
2



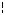






 3 A1 x 2
3 A1 x 2
Рис. 2.5. Визначення довжини хвилі методом лінійної інтерполяції:
1 – спектр заліза; 2 – спектр досліджуваного зразка; 3 – шкала вимірювального мікроскопа.
Довжину хвилі невідомого елементу розраховують за формулою:
x 1 |
( 2 |
1)( Ax |
A1) |
(2.4.) |
|
( A2 A1) |
|||
|
|
|
||
Оскільки кожен елемент зразка має багато ліній в спектрі, які можуть накладатися одна на одну, якісний аналіз не завершується пошуком однієї лінії. Для однозначних висновків про наявність елемента в пробі, шукають в спектрі ще кілька ліній цього елемента.
2.2.4. Кількісний аналіз.
Кількісним параметром в емісійному спектральному аналізі є інтенсивність будь-якої лінії визначуваного елемента. Інтенсивність лінії певної довжини хвилі безпосередньо залежить від кількості атомів цього елемента, які знаходяться у відповідному збудженому стані і ймовірності переходу, що зумовлює випромінювання цієї хвилі. Ймовірність переходу є величина постійна, кількість збуджених атомів залежить від концентрації елемента в зразку і умов збудження (температури і геометричних розмірів джерела збудження, швидкості випаровування матеріала зразка, наявності інших елементів в зразку).
Залежність інтенсивності спектральних ліній від концентрації елементів в зразках емпірично встановлено Ломакіним і Шайбе (1930 р.) і теоретично обгрунтовано Мандельштамом (1936 р.):
I a Cb |
(2.5), |
де а - константа, яка залежить від умов збудження;
b - коефіцієнт, який залежить від концентрації і характеризує процес самопоглинання ліній. Залежність інтенсивності лінії від концентрації в широкому діапазоні при постійних
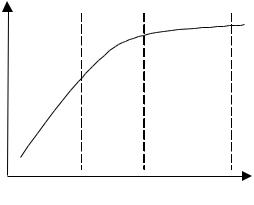
умовах збудження виражається графіком, поданим на рис. 2.6.
20
I
|
|
Рис. 2.6. Залежність інтенсивності лінії від |
|
|
концентрації при постійних умовах |
|
|
збудження. |
|
|
1 – b=1; 2 – b < 1; 3 – b = 0. |
1 |
2 |
3 |
C
При малих концентраціях ця залежність лінійна (b = 1). При збільшенні концентрації інтенсивність збільшується нелінійно (b < 1). При великих концентраціях інтенсивність перестає зростати (b ~ 0) і навіть зменшується (b < 1).
Процес самопоглинання зумовлений нерівномірністю температури по перерізу джерела збудження. Випромінювання з центральної гарячішої зони поглинається в периферійних холодніших зонах незбудженими атомами цього ж елемента. При збільшенні концентрації ступінь самопоглинання збільшується і зростання інтенсивності уповільнюється.
Для кількісного аналізу вибирають таку лінію визначуваного елемента і такі умови одержання спектра (режим джерела збудження, настройка оптичної системи і умови фіксування спектра), щоб коефіцієнт b у рівнянні Ломакіна був якомога більшим.
Метод прямого калібрування використовують тоді, коли можна забезпечити стабільність умов і параметрів, які впливають на інтенсивність спектральних ліній при фіксуванні спектрів як досліджуваних зразків, так і еталонів. Цим умовам повною мірою відповідають прилади, в яких використовуються стабільні джерела збудження - газове полум'я, ВЧ і НВЧ розряд.
Широко використовувані дугові та іскрові джерела збудження не відповідають умовам стабільності, тому для одержання точних результатів необхідно використовувати метод відносного калібрування, який в спектральному аналізі називається методом гомологічних
(аналітичних) пар.
Суть цього методу полягає в тому, що у спектрах зразків і еталонів вибирають дві лінії, одна з яких належить визначуваному елементу (аналітична лінія), друга - елементу-стандарту (лінія порівняння). Як елемент-стандарт часто використовують елемент, який складає основну масу зразків і еталонів, і концентрація якого практично не змінюється. Інколи елементстандарт додають у зразки і еталони в однаковій концентрації. Як елемент-стандарт можна використати матеріал допоміжного електрода або навколишнього середовища.
До гомологічних пар ставляться певні вимоги. Для зручності вимірювання довжини хвиль гомологічної пари повинні відрізнятися не більше ніж на 5 нм і в місці їх розташування не повинно бути яскравих ліній інших елементів. Потенціали збудження гомологічної пари повинні бути близькі ( E ≤ 1 еВ). У цьому випадку зміна умов збудження однаковою мірою буде впливати на інтенсивність лінії як визначуваного елемента, так і елемента-стандарта. Відношення інтенсивностей гомологічої пари не буде залежати від умов збудження, а буде залежати тільки від концентрації визначуваного елемента. Таким чином, в методі гомологічних пар аналітичним сигналом є їх відносна інтенсивність.
Для експрес-аналізу складу зразків можна використовувати напівкількісний аналіз приблизного визначення вмісту елементів.
Напівкількісний аналіз можна проводити кількома методами.
21
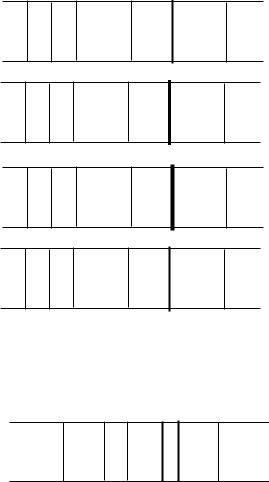
1. Метод стандартних серій, в якому при постійних умовах фіксують інтенсивності лінії визначуваного елемента від еталонів і від зразка. Порівняння інтенсивності ліній зразка і еталонів дозволяє визначити інтервал концентрацій, в якому знаходиться вміст елемента в зразку (рис. 2.7).
1
2
3
4
Рис. 2.7. Напівкількісний аналіз методом стандартних серій.
1, 2, 3 – спектри стандартів, С1<С2<С3; 4 – спектр зразка С2>Сх>С1.
2. Метод порівняння. Порівнюють інтенсивність деяких ліній визначуваного елемента з деякими близькими лініями елемента-стандарта. В залежності від співвідношення інтенсивностей за спеціальними таблицями визначають приблизний вміст елемента в зразку (рис. 2.8).
3 2 1 4 5
Рис. 2.8. Напівкількісний аналіз методом порівняння.
1 – лінія визначуваного елемента, 2-5 – лінії елемента-стандарта.
3. Метод зникаючих ліній. Цей метод грунтується на тому, що при зменшенні концентрації елемента в пробах, інтенсивність всіх ліній зменшується, але межі чутливості рецептора вони досягають при різних концентраціях елемента. Тому наявність певних ліній дозволяє оцінити приблизний вміст його в зразку.
Наприклад, при визначенні Sn на іскровому розряді в залежності від концентрації
спостерігаються такі лінії: |
|
Вміст Sn,% |
Спостереження ліній, Å |
10-1 |
2839 |
10-2 |
2839, 3034 |
10-3 |
2839, 3034, 3262, 2426 |
Ці методи використовуються переважно при візуальному спостереженні спектрів. Точність такого аналізу до 50 % і застосовуються вони для аналізу мінеральної сировини, при
22
