
- •1. Предмет і завдання курсу "біохімія"
- •2. Історія розвитку біохімії
- •3. Рівні структурної організації та хімічний склад живих організмів.
- •Відокремлюється тільки при хімічній взаємодії, зокрема при відщепленні гідроксильних (-он) груп від окремих молекул
- •Осмотичне утримування
- •Добова потреба організму у воді - 2,5...3,0 л.
- •4.Роль обміну речовин у життєдіяльності організму
- •1. Білки. Амінокислотний склад
- •2. Біологічна роль білків в організмі
- •3. Сучасні уявлення про структуру білків у білках розрізняють чотири рівні структурної організації:
- •4. Фізико-хімічні властивості білків
- •1. Нуклеїнові кислоти, їх хімічна природа
- •2. Відмінні властивості днк і рнк
- •3. Будова нуклеозидів та нуклеотидів
- •4. Атф - хімічна природа, біологічна роль
- •5.Структура нуклеїнових кислот
- •Тема 5. Ферменти
- •1. Ферменти як біологічні каталізатори
- •2. Хімічна природа та будова ферментів
- •3. Механізм дії ферментів та основи кінетики каталізу
- •4. Активність ферментів, вплив на неї різних факторів. Властивості ферментів
- •5. Номенклатура та класифікація ферментів
- •6. Використання ферментів у харчових технологіях
- •1. Класифікація вітамінів, їх біологічна роль
- •2. Будова вітамінів та їх добова потреба
- •3.Антивітаміни.Гормони
- •Тема 7. Основні поняття динамічної біохімії. Вільна енергія. Механізм дихального ланцюга
- •1. Динамічна біохімія. Вільна енерпя
- •(Окислення, відновлення, гідроліз, фосфорилювання таін.)
- •2. Біологічне окиснення. Тканинне дихання. Дихальний ланцюг
- •3. Окиснювальне фосфорилювання
- •Теми 8-9. Вуглеводи та їх обмін
- •1. Вуглеводи, їх функції
- •2. Класифікація вуглеводів
- •3. Характеристика основних представників вуглеводів
- •4. Перетравлювання та всмоктування вуглеводів в організмі людини
- •5. Взаємоперетворення моносахаридів в організмі
- •6. Анаеробне перетворення вуглеводів -хімізм гліколізу
- •7. Аеробне перетворення вуглеводів. Цикл кребса
- •8. Поняття про пентозний цикл перетворення вуглеводів
- •9. Біосинтез вуглеводів в організмі
- •9. Фотосинтез. Синтез оліго- та полісахаридів
- •25 – 30 Г/добу
- •Теми 10 -11. Ліпіди та їх обмін
- •1. Функції ліпідів в організмі
- •2. Класифікація ліпідів
- •3. Хімічна природа простих та складних ліпідів
- •4.Перетворення ліпідів у шлунково-кишковому тракті
- •5. Внутрішньоклітинний обмін ліпідів
- •6. Біосинтез ліпідів
- •Модуль 3 Тема 12. Білковий обмін
- •1. Перетворення білкових речовин у шлунково-кишковому тракті
- •2. Катаболізм білкових речовин в організмі. Хімізм перетворень
- •4. Синтез білків
- •Тема 13. Взаємозв'язок обмінних процесів
- •1. Взаємозв'язок основних видів обміну речовин
- •2. Ключові метаболіти - ланки переходу вуглеводного, білкового та ліпідного обмінів
- •2.Боєчко ф. Ф. Біологічна хімія. - к.: Вища шк., 1995. - 538 с.
- •3.Филиппович ю.Б. Основн биохимии. -м.: Висш. Шк., 1985. -503с.
- •4.Комов в.П., Шведова в.Н. Биохимия: Учеб. Для вузов. - м.: Дрофа, 2006. - 638с. Для студ Тмя та Тмо
3. Механізм дії ферментів та основи кінетики каталізу
► Кожний фермент має так званий активний центр, який забезпечує зв'язок між ферментом і субстратом, тобто речовиною,
на яку діє фермент.
► Для того, щоб відбулась ферментативна реакція, повинні бути певні умови. Це просторова відповідність між ферментом і
субстратом. Фермент, за гіпотезою Б.Фішера (1890р.), повинен підходити до субстрату, як ключ до замка, а за гіпотезою
Д.Кошланда (1959р.) про динамічну взаємодію - як рукавичка до руки. Тоді може утворитися субстрат – ферментний
комплекс, що є передумовою ферментативної реакції. Л.Міхаеліс і М.Ментен сформулювали загальну теорію кінетики
дії ферментів.
(Схему ферментативної реакції можна подати у такому вигляді:
![]()
де S — субстрат;
Е - фермент
[ЕS] - нестійкий субстрат - ферментний комплекс;
Р - продукти реакції;
К+1 - константа швидкості утворення комплексу;
К -1 - константа швидкості зворотного розпаду Е8 на Е і 8;
К+2 - константа розпаду Е8 з утворенням продукту Р.
Графік залежності швидкості реакції V від концентрації субстрату [S
Рівняння Міхаеліса - Ментен
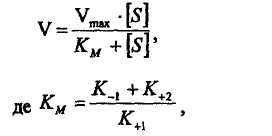
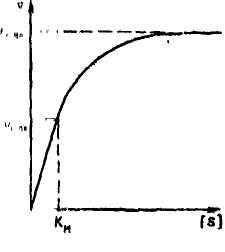
V max - максимальна швидкість реакції;
Км - константа Міхаеліса для досліджуваної пари фермент субстрат.
! За основу теорії, що пояснює дію ферменту, взято той факт, що ферменти значно знижують енергію активації (ЕА) тієї чи іншої реакції
Значення енергії активації ЕА при ферментативному та неферментативному каталізі:
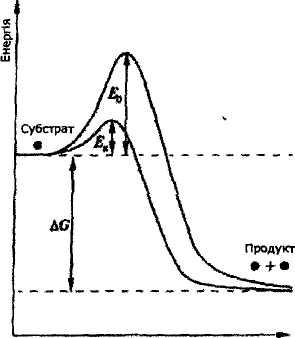
Основні та перехідні стани реагуючих речовин:
Ео - енергія активації реакції в присутності неорганічного каталізатора;
Ек - енергія активації в присутності фермента;
ΔG - різниця вільної енергії реакції.
4. Активність ферментів, вплив на неї різних факторів. Властивості ферментів
► Для ферментів характерна висока каталітична активність, її визначають за кількістю субстрату, що перетворюється за одиницю
часу. Так, одна молекула амілази за 1 хв здатна перетворити приблизно 1 100 000 молекул субстрату. Виражають
каталітичну активність у кахалах (кат), млкат, мккат, нкат.
! Катал - це каталітична активність ферменту, який здійснює хімічне перетворення 1 моль субстрату за 1 с.
Фактори, що впливають на
активність ферментів

Температура середовища
рН
Активатори та інгібітори
Вплив факторів
► Вплив температури на активність ферментів. При підвищенні температури каталітична активність ферментів збільшується,
але до певної межі. Температура, при якій каталітична активність ферменту найбільша, називається оптимальною (То). Графічно це
можна зобразити так:
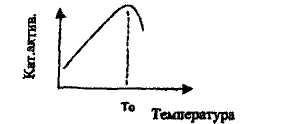
! Для ферментів тваринного походження То = 35 - 50°С, а для ферментів рослинного походження То = 40 - 60°С.
► Вплив рН-середовшца на активність ферментів. Для кожного ферменту характерне своє значення рН, при якому
активність ферменту є максимальною. Так, пепсин найвищу каталітичну активність виявляє при рН = 2, амілаза - 7,
фосфатаза 10.
► Активатори та інгібітори ферментів. Активатори - речовини, які підвищують активність ферментів. До них належать
катіони металів і деякі аніони (Мg2+, Са2+, Сu2+, Мn2+, Мо2+, Fе2+, СІ-та ін.), мінеральні кислоти (НСl), жовчні кислоти, деякі
сполуки з функціональними і рупами (цистеїн, глутатіон), ферменти (ентерокіназа, трипсин).
|
Фермент |
Метал |
Фермент |
Метал |
|
ДІІК-полімераза Глутатіонсингетаза Гексокіназа β-Галактозидаза |
Mg |
α-Амілаза Ліпаза |
Са |
|
Гомосериндегідратаза |
К Li | ||
|
Фосфатаза |
Тирозиназа Фенолоксидаза |
Сu | |
|
Оксидоредуктаза |
Мn | ||
|
Аргіназа |
Аргіназа |
Ni | |
|
Карбоангідраза Уриказа |
Zn |
Каталаза Ксантиноксидаза |
Fе Мо |
Інгібітори - речовини, які викликають гальмування ферментативних процесів (білкові осаджувачі — ССl3СООН, танін, концентровані кислоти, солі важких металів та ін.). Інгібітори розподіляють на зворотної та незворотної дії (за характером дії), причому зворотні інгібітори ділять на конкурентні та неконкурентні (за спорідненістю до субстрату).
