
- •2) Разделение индивидуальных белков
- •1, Строение и функции коллагенов
- •1. Общие структурные особенности аминокислот, входящих в состав белков
- •2. Классификация аминокислот
- •3. Классификация аминокислот
- •1. Строение пептида
- •2. Характеристика пептидной связи
- •1. Определение аминокислотного состава белка
- •2. Определение аминокислотной последовательности в белке
- •1. Супервторичная структура типа б-бочонка
- •2. Структурный мотив "а-спираль-поворот-а-спиралъ"
- •3. Супервторичная структурав виде "цинкового пальца"
- •4. Супервторичная структура в виде "лейциновой застёжки-молнии"
- •11.Амфотерность
- •19.Четвертичная структура белков
- •2.Кооперативность
- •20.Взаимосвязь функции и особенностей строения структурных фибриллярных белков.
- •1. Строение и функции коллагенов
- •21.Взаимосвязь структуры и функции иммуноглобулинов
- •23.Понятие холофермент, апофермент, кофактор, субстрат, продукт реакции, ингибитор,активатор.Примеры.
- •31.Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
- •32.Ассоциация и ассоциация регулярных протеинов как способ регуляции ферментативной активности
- •33.Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
- •34.Кофакторы ферментов: ионы металла и коферменты.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •3. Роль металлов в ферментативном Катализе.Участие в электрофильном катализе
- •35.Витамин рр (никотиновая кислота, никотинамид, витамин b3)
- •38 Специфичность действия ферментов и ее вида
- •1. Субстратная специфичность
- •2. Каталитическая специфичность
- •2. Последовательность событий в ходе ферментативного катализа
19.Четвертичная структура белков
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков". Отдельные полипептидные цепи в таком белке носят название протомеров,
1. Количество протомеров в структуре олигомерных белков В состав олигомерных белков может входить от двух до нескольких десятков протомеров, наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей. олигомеры выполняют более сложные функции.
2.Кооперативность
Кооперативное связывание
Когда субстрат связывается с активным центром одной субъединицы фермента, остальные субъединицы активируются. Лиганды могут иметь некооперативный, положительный или отрицательный кооперативный эффект.(Примером положительной кооперативности может служить связывание кислорода гемоглобином.)Отрицательная кооперативность означает противоположное — в момент связывания лиганда белком, сродство белка к лиганду снижается..
миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
Структура и функции миоглобина
Миоглобин содержит простетическую группу - гем, довольно прочно связанную с белковой частью. Миоглобин имеет только одну полипептидную цепь. содержится в красных мышцах и участвует в запасании кислорода.
Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин).
Гем - специфический лиганд апомиоглобина, присоединяющийся к белковой части в углублении
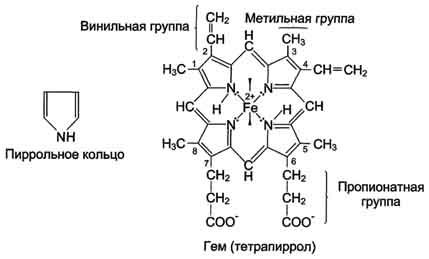
Центр связывания с гемом образован преимущественно гидрофобными остатками аминокислот, В входят также 2 остатка Гис (играющие важную роль в функционировании белка..
Аминокислотное окружение тема создаёт условия для довольно прочного, связывания О2с Fe2+миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fe2+в Fe3+. Трёхвалентное железо в составе тема не способно присоединять О2.
Структура и функции гемоглобина
Гемоглобины - в эритроцитах .функции:
перенос О2из лёгких к периферическим тканям;
участие в переносе СО2и протонов из периферических тканей в лёгкие для последующего выведения из организма.
Гемоглобины, так же как миоглобин, относят к гемопротеинам, но они имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций.
Четвертичная структура гемоглобина
Четыре полипептидные цепи, соединённые вместе, образуют почти правильную форму шара, где каждая ?-цепь контактирует с двумя ?-цепями
Так как в области контакта между цепями находится много гидрофобных радикалов, то между этими полипептидными цепями формируется сильное соединение за счёт возникновения в первую очередь гидрофобных, а также ионных и водородных связей. В результате образуются димеры Между этими димерами в тетрамерной молекуле гемоглобина возникают в основном полярные (ионные и водородные) связи, поэтому при изменении рН среды в кислую или щелочную сторону в первую очередь разрушаются связи между димерами. Кроме того, димеры способны легко перемещаться относительно друг друга. Так как поверхность протомеров неровная, полипептидные цепи в центральной области не могут плотно прилегать друг к другу, в результате в центре формируется "центральная полость", проходящая сквозь всю молекулу гемоглобина.
Следовательно, благодаря уникальной структуре каждый из рассмотренных белков приспособлен выполнять свою функцию: миоглобин - присоединять О2, высвобождаемый гемоглобином, накапливать в клетке и отдавать в случае крайней необходимости; гемоглобин - присоединять О2в лёгких, где его насыщение доходит до 100%, и отдавать О2в капиллярах тканей в зависимости от изменения в них давления О2.
