
- •2) Разделение индивидуальных белков
- •1, Строение и функции коллагенов
- •1. Общие структурные особенности аминокислот, входящих в состав белков
- •2. Классификация аминокислот
- •3. Классификация аминокислот
- •1. Строение пептида
- •2. Характеристика пептидной связи
- •1. Определение аминокислотного состава белка
- •2. Определение аминокислотной последовательности в белке
- •1. Супервторичная структура типа б-бочонка
- •2. Структурный мотив "а-спираль-поворот-а-спиралъ"
- •3. Супервторичная структурав виде "цинкового пальца"
- •4. Супервторичная структура в виде "лейциновой застёжки-молнии"
- •11.Амфотерность
- •19.Четвертичная структура белков
- •2.Кооперативность
- •20.Взаимосвязь функции и особенностей строения структурных фибриллярных белков.
- •1. Строение и функции коллагенов
- •21.Взаимосвязь структуры и функции иммуноглобулинов
- •23.Понятие холофермент, апофермент, кофактор, субстрат, продукт реакции, ингибитор,активатор.Примеры.
- •31.Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
- •32.Ассоциация и ассоциация регулярных протеинов как способ регуляции ферментативной активности
- •33.Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом
- •34.Кофакторы ферментов: ионы металла и коферменты.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •3. Роль металлов в ферментативном Катализе.Участие в электрофильном катализе
- •35.Витамин рр (никотиновая кислота, никотинамид, витамин b3)
- •38 Специфичность действия ферментов и ее вида
- •1. Субстратная специфичность
- •2. Каталитическая специфичность
- •2. Последовательность событий в ходе ферментативного катализа
11.Амфотерность
Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы.
Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0.
Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных рН заряд положительный и обусловлен этими, положительно заряженными, аминокислотами.
Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативнойконформации.
Влияние рН на заряд белка
При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость. Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
наличием заряда и взаимоотталкиванием заряженных молекул белка,
наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Например, 100 г белка альбумина связывает 30-50 г воды


Пример денатурации - свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой.
Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути.
РЕНАТУРА́ЦИЯ — процесс восстановления структурной организации биополимера (белковой молекулы или молекул нуклеиновых кислот). Ренатурация возможна только при обратимой денатурации. Ренатурация лежит в основе многих биологических механизмов.
Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима. Ренатурация возможна только если затронута третичная или вторичная структура. При этом восстанавливаются функции данного белка.
Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности,гидрофобны взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
Вызывать денатурацию белков могут разнообразные факторы, перечисленные ниже.
Нагревание или излучение белка, например инфракрасное или ультрафиолетовое. Кинетическая энергия, сообщаемая белку, вызывает вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются,и белок свертывается (коагулирует).
Сильные кислоты, щелочи, соли денатурируют белок. Под действием этих реагентов ионные связи разрываются и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей.
Тяжелые металлы денатурируют белок. Положительно заряженные ионы тяжелых металлов (катионы) образуют прочные связи с отрицательно заряженными карбоксил-анионами R-групп белка и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок.
Органические растворители и детергенты денатурируют белок. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
13.Свойства белковых растворов определяются большими размерами молекул, т.е. белки являются коллоидными частицами и образуют коллоидные растворы.
К свойствам белковых растворов относятся:
1. Рассеивание света вследствие дифракции на коллоидных частицах – опалесценция. Особенно это заметно при прохождении луча света через белковый раствор, когда виден светящийся конус (эффект Тиндаля).
2. Белковые растворы в отличие от истинных обладают малой скоростью диффузии.
3. Неспособность белковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе. Очистка белковых препаратов от посторонних примесей лежит в основе работы "искусственной почки" при лечении острой почечной недостаточности.
4. Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отеков при повышении проницаемости сосудистой стенки.
5. Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней.
Главными
факторами устойчивости белка в растворе
служат заряд молекулы и гидратная
оболочка.Общий поверхностный
заряд белковой молекулы при растворении
в воде определяется суммой зарядов
отдельных аминокислотных остатков, из
которых построен белок. Если в составе
протеина преобладают "щелоч¬ные"
аминокислоты (аргинин, лизин), то молекула
в целом заряжается по-ложительно; при
преобладании дикарбоновых аминокислот
- отрицатель¬но. Одноименно заряженные
белковые молекулы в растворе отталкивают¬ся
друг от друга, что препятствует их
осаждению.
Важной особенностью белка
является способность менять величину
и даже знак заряда при изменении рН
среды, что связано с обратимостью
диссоциации ионогенных групп в
аминокислотных остатках (см. выше). Так,
при добавлении кислоты к раствору белка
часть СОО^-групп, связы¬вая избыток
протонов, рекомбинирует до СООН-групп;
при этом их отри¬цательные заряды
исчезают, а все положительные заряды
сохраняются. Это ведет к сдвигу общего
заряда белка в положительную сторону.
Для
каждого белка можно подобрать такое
значение рН среды, при котором количество
положительных зарядов в молекуле
сравняется с ко¬личеством отрицательных,
а их алгебраическая сумма будет равна
нулю. Это значение рН (не обязательно
нейтральное!) называется изоэлектриче-ской
точкой белка (ИЭТ). При сдвиге рН в кислую
или щелочную сторону
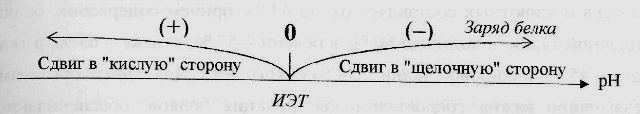 Рис.
2.4. Изменение заряда белковой молекулы
при сдвигах рН среды
С локальными
поверхностными зарядами белка связано
наличие гидратной оболочки: молекулы-диполи
воды "облепляют" белок в один или
несколько слоев в зависимости от величины
заряда. Одно из основных качеств гидратной
оболочки - упругость; при столкновении
гидратирован-ных молекул белка в растворе
они не слипаются, а отскакивают друг от
друга, что препятствует их выпадению в
осадок. Для осаждения белков нужно
нейтрализовать заряд молекулы, доведя
рН среды до ИЭТ, и "снять" гидратную
оболочку действием концентрированных
растворов солей (вы¬саливание) или
спирта.
Рис.
2.4. Изменение заряда белковой молекулы
при сдвигах рН среды
С локальными
поверхностными зарядами белка связано
наличие гидратной оболочки: молекулы-диполи
воды "облепляют" белок в один или
несколько слоев в зависимости от величины
заряда. Одно из основных качеств гидратной
оболочки - упругость; при столкновении
гидратирован-ных молекул белка в растворе
они не слипаются, а отскакивают друг от
друга, что препятствует их выпадению в
осадок. Для осаждения белков нужно
нейтрализовать заряд молекулы, доведя
рН среды до ИЭТ, и "снять" гидратную
оболочку действием концентрированных
растворов солей (вы¬саливание) или
спирта.
Реакции осаждения белков
Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения без белкового раствора.
Обратимое осаждение.Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание.
Высаливание.Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором - глобулиновая фракция. Сущность реакции заключается в дегидратации молекул белка.
Реактивы:
1) неразведенный яичный белок;
2) насыщенный раствор сульфата аммония;
3) NaOH, 10% раствор,
4) CuSO4, 1% раствор;
5) дистиллированная вода;
6) сульфат аммония в порошке.
Необратимое осаждение белков.
Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов.
Осаждение при кипячении.
Белки являются термолабильными соединениями и при нагревании свыше 50-60 градусов С денатурируются. Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую глобулу связей и развертывании белковой молекулы. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку частицы белка при этом наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами - в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором - отрицательный заряд, что повышает их устойчивость в растворе.
Реактивы:
1) яичный белок, 1% раствор;
2) уксусная кислота, 1% и 10% растворы;
3) NaOH, 10% раствор.
Осаждение концентрированными минеральными кислотами.
Концентрированные кислоты (серная, хлористоводородная, азотная и др.) вызывают денатурацию белка за счет удаления факторов устойчивости белка в растворе (заряда и гидратной оболочки). Однако при избытке хлористоводородной и серной кислоты выпавший осадок денатурированного белка снова растворяется. По-видимому, это происходит в результате перезарядки молекул белка и частичного их гидролиза. При добавлении избытка азотной кислоты растворения осадка не происходит. Вот почему для определения малых количеств белка в моче при клинических исследованиях применяется азотная кислота.
Реактивы:
1) яичный белок,1% раствор;
2) концентрированная серная кислота;
3) концентрированная хлористоводородная кислота;
4) концентрированная азотная кислота.
Осаждение органическими кислотами.
Трихлоруксусная кислота осаждает только белки, а сульфосалициловая осаждает не только белки, но и высокомолекулярные пептиды. Сульфосалициловой кислотой пользуются при определении белка в моче.
Реактивы:
1) яичный белок, 1% раствор;
2) трихлоруксусная кислота, 10% раствор;
3) сульфосалициловая кислота, 10% раствор.
Осаждение белка солями тяжелых металлов.
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле.
Реактивы:
1) яичный белок, 1% раствор;
2) сульфат меди, 10% раствор;
3) ацетат свинца, 5% раствор;
4) нитрат серебра, 5% раствор.
14

Классификация белков в зависимости от выполняемых функций:
ферменты – (от лат. «fermentum» - брожение, закваска) – группа специфических белков, увеличивающих скорость протекания химических реакций в клетках всех живых организмов.
транспортные – группа белков, выполняющих функцию переноса различных атомов, молекул, ионов как внутри клетки, так и между клетками в многоклеточных организмах.
структурные – группа белков, отвечающих за поддержание формы и стабильности клеток и тканей.
регуляторные (гормональные) – группа белков, осуществляющих функции сигнальных веществ (гормонов).
защитные – группа белков, предохраняющих организм от вторжения других организмов и повреждений.
запасающие (резервные, пищевые) – группа белков, являющихся ценными пищевыми веществами. У животных – мышечные белки служат резервными питательными веществами, которые мобилизируются при крайней необходимости.
сократительные (дигательные) – группа белков, ответственных за мышечное сокращение и другие формы биологической подвижности.


16) Необходимое условие для функционирования белков - присоединение к нему лиганда ". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением активного центра белка..
А. Активный центр белков и избирательность связывания его с лигандом
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом..
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (
Комплементарность- пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
.
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфорилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в "ловушке", что облегчает его дальнейшее фосфорилирование.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент).
17
В основе функционирования любого белка лежит его способность к избирательному взаимодействию с каким-либо другим веществом — лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе другой белок. Лиганд присоединяется к определенному участку на поверхности белковой молекулы — центру связывания (активный центр).
Активный центр белков – определённый участок белковой молекулы, как правило, находящийся в её углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка и структуры лиганда. Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка, активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структуройпо отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
18

