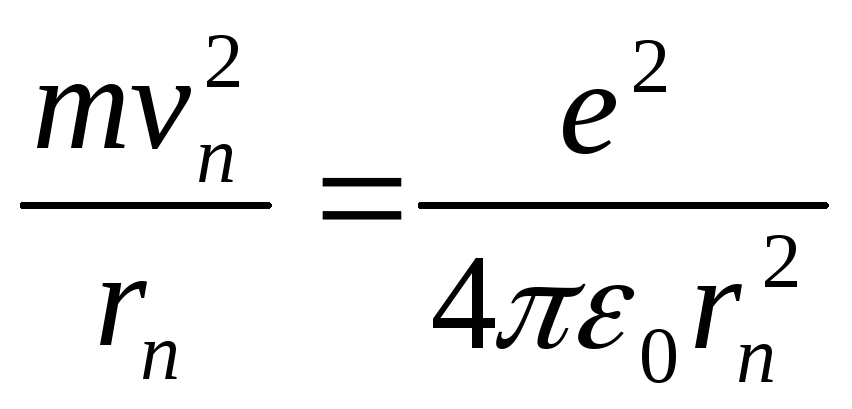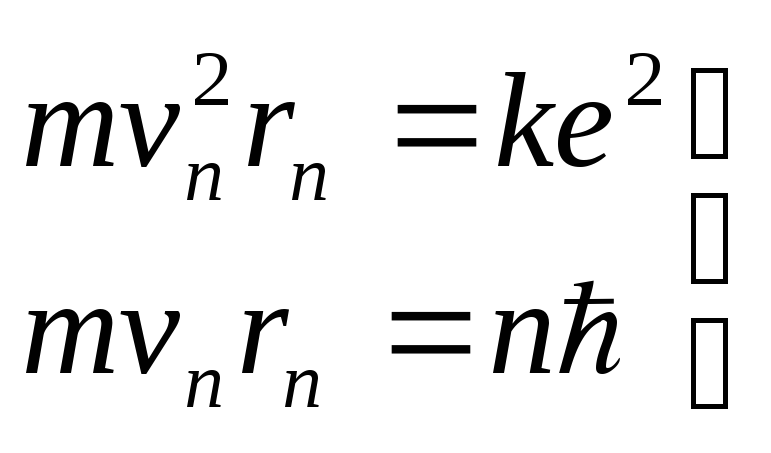-
Постулати Бора. Елементарна теорія атому водню
Розглянемо найпростіший атом – атом водню. Він складається з одного електрону та протону у якості ядра. Протон важчий від електрона приблизно у 1836 разів, тому надалі вважатимемо його практично нерухомим, а електрон таким, що обертається навколо ядра (насправді ж обидві частинки обертаються навколо спільного центру мас, проте, останній лежить дуже близько до центру протона-ядра). Це фактично планетарна модель Резерфорда, гранично спрощена наявністю лише одного атомного електрону. Для подолання труднощів планетарної моделі Нільс Бор у 1913 році запропонував напівкласичну-напівквантову теорію атома водню, яка базувалася на двох постулатах наступного змісту:
І.
Атомний електрон може знаходитися лише
у певних дискретних стаціонарних станах,
кожний з яких можна означити цілим
числом
![]() та характеризувати значенням його
повної енергії
та характеризувати значенням його
повної енергії![]() .
Перебуваючи в одному з таких станів
електрон енергії не випромінює
.
Перебуваючи в одному з таких станів
електрон енергії не випромінює
ІІ.
При
переходах атомного електрону зі стану
з енергією
![]() до стану з енергією
до стану з енергією
![]() випромінюється,
або поглинається фотон з енергією
випромінюється,
або поглинається фотон з енергією
![]()
Далі Бор припустив, що електрон в атомі водню рухається лише по колових стаціонарних орбітах, тобто доцентрове прискорення створюється кулонівською силою притягання поміж зарядами ядра та електрону:
|
|
(5.1.1) |
Для моменту імпульсу електрона на стаціонарній орбіті Бор припустив наступну умову квантування:
|
|
(5.1.2) |
д е
індекс
е
індекс
![]() - має той самий зміст, що й у першому
постулаті Бора. Якщо позначити
- має той самий зміст, що й у першому
постулаті Бора. Якщо позначити
![]() ,
то систему рівнянь (5.1.1,5.1.2) можна
переписати у вигляді:
,
то систему рівнянь (5.1.1,5.1.2) можна
переписати у вигляді:
|
|
(5.1.3) |
З
цієї системи рівнянь негайно отримуємо
для радіусу, та швидкості на стаціонарній
орбіті з номером
![]() прості вирази:
прості вирази:
|
|
(5.1.4) |
Величина
радіусу, який відповідає першій орбіті
(![]() )
електрону в атомі водню
)
електрону в атомі водню
![]() м
отримала в літературі назву радіуса
Бора.
Повну енергію електрона можна отримати
як суму його кінетичної (
м
отримала в літературі назву радіуса
Бора.
Повну енергію електрона можна отримати
як суму його кінетичної (![]() )
та потенційної (
)
та потенційної (![]() )
енергій, а також виразів (5.1.5). В результаті
матимемо:
)
енергій, а також виразів (5.1.5). В результаті
матимемо:
|
|
(5.1.5) |
де
![]() .
.
Для
різних значень головного квантового
числа
![]() формула (5.1.5) дає дискретний ряд дозволених
значень енергій стаціонарних станів.
На Мал.5.1.1 горизонтальними лініями
зображені перші п’ять рівнів енергії,
розраховані за формулою (5.1.5) (для
квантових чисел
формула (5.1.5) дає дискретний ряд дозволених
значень енергій стаціонарних станів.
На Мал.5.1.1 горизонтальними лініями
зображені перші п’ять рівнів енергії,
розраховані за формулою (5.1.5) (для
квантових чисел
![]() ),
а також найвищий рівень для
),
а також найвищий рівень для
![]() ,
причому
,
причому
![]() ,
що є очевидним з виразу (5.1.5). Решта
дискретних енергетичних рівнів з
,
що є очевидним з виразу (5.1.5). Решта
дискретних енергетичних рівнів з
![]() займає, як це видно з мал..5.1.1, вузенький
енергетичний інтервал поміж п’ятим та
найвищим рівнями:
займає, як це видно з мал..5.1.1, вузенький
енергетичний інтервал поміж п’ятим та
найвищим рівнями:
![]() .
Дискретність енергетичного спектру
електрона в атомі водню випливає з
постулатів Бора та (5.1.5).
.
Дискретність енергетичного спектру
електрона в атомі водню випливає з
постулатів Бора та (5.1.5).
Незважаючи на наближений характер припущень Бора (5.1.1, 5.1.2), вираз (5.1.5) виявився абсолютно точним, що пізніше підтвердила більш послідовна квантова теорія атома водню.
Енергія
![]() відповідає так званому основному,
локалізованому станові електрона в
атомі, тоді як гранична енергія
відповідає так званому основному,
локалізованому станові електрона в
атомі, тоді як гранична енергія
![]() відповідає станові нелокалізованого,
відірваного від атому електрона. Різниця
енергій поміж основним та нелокалізованим
станами:
відповідає станові нелокалізованого,
відірваного від атому електрона. Різниця
енергій поміж основним та нелокалізованим
станами:
|
|
(5.1.6) |
(на
Мал..5.1.1 цей перехід відзначено стрілкою)
відповідає енергії
іонізації атому водню.
Яка, по-перше, точно співпадає з енергією
![]() ,
а, по-друге, досить близько відповідає
експериментальному значенню енергії
іонізації атомарного водню.
,
а, по-друге, досить близько відповідає
експериментальному значенню енергії
іонізації атомарного водню.
Н а
Мал..5.1.2 зображено співвідношення
радіусів перших чотирьох стаціонарних
колових орбіт Бора в атомі водню, згідно
із першою формулою (5.1.5). Радіус першої
орбіти Бора (
а
Мал..5.1.2 зображено співвідношення
радіусів перших чотирьох стаціонарних
колових орбіт Бора в атомі водню, згідно
із першою формулою (5.1.5). Радіус першої
орбіти Бора (![]() м) на малюнку прийнятий за одиницю
довжини, таким чином на осях координат
відкладені відношення
м) на малюнку прийнятий за одиницю
довжини, таким чином на осях координат
відкладені відношення
![]() для
для
![]() .
.