
Фізика / Лекции / Квантова ф_зика / 5-4
.doc|
Херсонський державний технічний університет Кафедра загальної та прикладної фізики |
КВАНТОВА ФІЗИКА Лекція 5.4. Багатоелектронні атоми |
|
|
|
|---|---|
|
|
|
|
|
|
|
|
-
Багатоелектронні атоми
Одноелектронний
атом водню є найпростішим за структурою
з тих, що існують в природі. Решта атомів,
починаючи від гелію з його двома
електронами є багатоелектронними
утвореннями. Оскільки кожен атом є
нейтральним, то зарядове число
![]() одночасно показує кількість електронів
в атомі, кількість протонів в його ядрі
і порядковий номер у періодичній таблиці
елементів. Таким чином, в багатоелектронному
нейтральному атомі є
одночасно показує кількість електронів
в атомі, кількість протонів в його ядрі
і порядковий номер у періодичній таблиці
елементів. Таким чином, в багатоелектронному
нейтральному атомі є
![]() електронів. Вони складають взаємодіючу
поміж собою та із зарядженим ядром
стаціонарну систему квантових частинок.
Враховуючи лише кулонівські сили
взаємодії в атомі гелію потенційну
енергію взаємодії треба записувати у
вигляді:
електронів. Вони складають взаємодіючу
поміж собою та із зарядженим ядром
стаціонарну систему квантових частинок.
Враховуючи лише кулонівські сили
взаємодії в атомі гелію потенційну
енергію взаємодії треба записувати у
вигляді:
|
|
(5.4.1) |
де
![]() і враховані сили тяжіння поміж ядром
та двома електронами та відштовхування
поміж електронами. За рахунок третього
доданку виникає часткове зняття
виродження енергетичних рівнів: на
відміну від атому водню, енергія
електронів в багатоелектронних атомах
залежить не тільки від квантового числа
і враховані сили тяжіння поміж ядром
та двома електронами та відштовхування
поміж електронами. За рахунок третього
доданку виникає часткове зняття
виродження енергетичних рівнів: на
відміну від атому водню, енергія
електронів в багатоелектронних атомах
залежить не тільки від квантового числа
![]() ,але
також і від квантового числа
,але
також і від квантового числа
![]() .Саме
наявність третього доданку в потенційній
енергії не дозволяє розділити рух
електронів і розглядати кожен електрон
окремо в його русі у полі ядра.
.Саме
наявність третього доданку в потенційній
енергії не дозволяє розділити рух
електронів і розглядати кожен електрон
окремо в його русі у полі ядра.
Проте
можна розглядати рух кожного електрону
в усередненому полі ядра та решти
![]() електронів, і таке усереднене поле вже
можна вважати приблизно центрально
симетричним. Зрозуміло, що такий
наближений метод, який має назву метода
Хартрі, або методу самоузгодженого
поля, є тим точнішим, чим більша кількість
електронів в атомі. В методі Хартрі
фактично нехтують третім доданком в
(5.4.1) порівняно з сумою двох перших.
Задача про рух одного електрону у
приблизно сферично-симетричному полі
ядра та решти електронів нагадує задачу
про рух електрону у воднеподібній
системі. Зокрема квантові стани такого
електрону можна описати тими ж самими
чотирма квантовими числами:
електронів, і таке усереднене поле вже
можна вважати приблизно центрально
симетричним. Зрозуміло, що такий
наближений метод, який має назву метода
Хартрі, або методу самоузгодженого
поля, є тим точнішим, чим більша кількість
електронів в атомі. В методі Хартрі
фактично нехтують третім доданком в
(5.4.1) порівняно з сумою двох перших.
Задача про рух одного електрону у
приблизно сферично-симетричному полі
ядра та решти електронів нагадує задачу
про рух електрону у воднеподібній
системі. Зокрема квантові стани такого
електрону можна описати тими ж самими
чотирма квантовими числами:
![]() .
.
-
Періодичний закон Мендєлєєва. Електронні шари та оболонки
Ще
одна важлива обставина, яку треба
враховувати під час вивчення
багатоелектронних атомів є тотожність
електронів у межах одного атому. Неможливо
сказати який саме електрон перебуває
в тому чи іншому квантовому стані
дозволеному для
![]() електронів атому. Система електронів
атому є системою ферміонів, отже підлягає
принципу заборони Паулі. Якщо
стан електрона в атомі характеризується
чотирма квантовими числами
електронів атому. Система електронів
атому є системою ферміонів, отже підлягає
принципу заборони Паулі. Якщо
стан електрона в атомі характеризується
чотирма квантовими числами
![]() ,
то згідно з принципом заборони Паулі
жодна пара електронів із сукупності
,
то згідно з принципом заборони Паулі
жодна пара електронів із сукупності
![]() електронів атому не може мати однаковими
всі чотири квантові числа.
При цьому у пари електронів можуть
співпадати одно, два, і навіть три
квантових числа, але не всі чотири.
електронів атому не може мати однаковими
всі чотири квантові числа.
При цьому у пари електронів можуть
співпадати одно, два, і навіть три
квантових числа, але не всі чотири.
Електрони,
які мають однакове квантове число
![]() формують так званий електронний
шар.
Місткість кожного електронного шару
є обмеженою вона дорівнює кількості
різних квантових станів для фіксованого
значення
формують так званий електронний
шар.
Місткість кожного електронного шару
є обмеженою вона дорівнює кількості
різних квантових станів для фіксованого
значення
![]() ,
тобто кратності виродження
,
тобто кратності виродження
![]() .
Тому
.
Тому
![]() електронів
атому звичайно розподілені по декількох
електронних шарах. Позначаються шари
великими літерами латиниці, як це
показано в таблиці 1.
електронів
атому звичайно розподілені по декількох
електронних шарах. Позначаються шари
великими літерами латиниці, як це
показано в таблиці 1.
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Позначення |
K |
L |
M |
N |
O |
P |
|
|
2 |
8 |
18 |
32 |
50 |
72 |
Як
видно з таблиці, найближчий до ядра
![]() -
шар містить лише два електрони, тоді як
наступний
-
шар містить лише два електрони, тоді як
наступний
![]() -
шар максимально може розмістити 8
електронів. Отже, п‘ять-шість шарів —
достатня кількість для розташування
всіх електронів навіть найважчих атомів
(
-
шар максимально може розмістити 8
електронів. Отже, п‘ять-шість шарів —
достатня кількість для розташування
всіх електронів навіть найважчих атомів
(![]() ).
).
Електронні
шари поділяють на оболонки (кожен шар
має стільки оболонок, який має номер
![]() ).
Електрони однієї оболонки мають два
однакових квантових числа
).
Електрони однієї оболонки мають два
однакових квантових числа
![]() .
Позначення та місткість оболонок (кожна
оболонка містить
.
Позначення та місткість оболонок (кожна
оболонка містить
![]() стан) дає таблиця 2.
стан) дає таблиця 2.
|
|
0 |
1 |
2 |
3 |
4 |
5 |
|
Позначення |
s |
p |
d |
f |
g |
h |
|
|
2 |
6 |
10 |
14 |
18 |
22 |
Кількість
електронів, які можна розмістити в
оболонках шару повинна співпадати з
його місткістю, як це можна прослідкувати
на прикладі
![]() -шару,
який складається з трьох оболонок
(s,p,d) і містить відповідно 2+6+10=18 електронів.
В загальному випадку:
-шару,
який складається з трьох оболонок
(s,p,d) і містить відповідно 2+6+10=18 електронів.
В загальному випадку:
|
|
(5.4.2) |
Енергія
зв’язку електронів з атомним ядром в
нашому наближенні є найбільшою для
електронів найближчого для ядра
![]() -
шару (припустимо, що вона дорівнює
-
шару (припустимо, що вона дорівнює
![]() ),
тоді як для електронів більш відділених
шарів вона падає приблизно обернено
пропорційно квадрату головного квантового
числа. Чим більший квантовий номер має
шар, тим менша енергія зв’язку.
),
тоді як для електронів більш відділених
шарів вона падає приблизно обернено
пропорційно квадрату головного квантового
числа. Чим більший квантовий номер має
шар, тим менша енергія зв’язку.
Розподіл
електронів по шарам та оболонкам
диктується їх місткістю (тобто принципом
Паулі). Електронні конфігурації прийнято
позначати спеціальними символами:
наприклад символ
![]() означає, що в першому електронному шарі
атому гелію на
означає, що в першому електронному шарі
атому гелію на
![]() -оболонці
знаходяться два електрони. Вони мають
однакові значення квантових чисел
-оболонці
знаходяться два електрони. Вони мають
однакові значення квантових чисел
![]() проте різні напрями спіну
проте різні напрями спіну
![]() .
Набори квантових чисел для двох електронів
атому гелію є такими:
.
Набори квантових чисел для двох електронів
атому гелію є такими:![]() ,
якщо атом перебуває в основному
незбудженому стані. Цей атом цікавий
ще й тому, що демонструє повністю
заповнену оболонку (
,
якщо атом перебуває в основному
незбудженому стані. Цей атом цікавий
ще й тому, що демонструє повністю
заповнену оболонку (![]() -оболонку
) і навіть повністю заповнений електронний
шар (
-оболонку
) і навіть повністю заповнений електронний
шар (![]() -шар
з
-шар
з
![]() ).
).
Наступним
таким атомом в таблиці Менделєєва
повинен бути атом, у якого повністю
заповненими електронами є два електронні
шари (![]() ).
Згідно з таблицею 1 сумарна місткість
цих двох електронних шарів дорівнює
десяти електронам (2+8). Під десятим
номером в таблиці Менделєєва знаходимо
інший інертний газ –неон – електронна
конфігурація якого наступна:
).
Згідно з таблицею 1 сумарна місткість
цих двох електронних шарів дорівнює
десяти електронам (2+8). Під десятим
номером в таблиці Менделєєва знаходимо
інший інертний газ –неон – електронна
конфігурація якого наступна:
![]() (підкреслені
електрони першого шару, двічі підкреслені
електрони другого шару). Атоми із
заповненими оболонками та шарами повинні
сильно вирізнятися своїми властивостями
від атомів з незаповненими оболонками
та шарами і вони дійсно вирізняються
значною хімічною інертністю. Такі атоми
складають групу інертних елементів
періодичної таблиці елементів (група
(підкреслені
електрони першого шару, двічі підкреслені
електрони другого шару). Атоми із
заповненими оболонками та шарами повинні
сильно вирізнятися своїми властивостями
від атомів з незаповненими оболонками
та шарами і вони дійсно вирізняються
значною хімічною інертністю. Такі атоми
складають групу інертних елементів
періодичної таблиці елементів (група
![]() ).
).
Атоми,
які мають лише один електрон в
недобудованому шарі, або оболонці
повинні досить просто його втрачати,
що взагалі то й спостерігається для
атомів одинадцятого елементу, літію,
електронна конфігурація якого є такою:
![]() .
Порівнюючи цю конфігурацію з конфігурацією
неону, помічаємо, що перші два електронні
шари літію мають таку саму конфігурацію,
як і у неону, тобто є повністю заповненими,
укомплектованими електронами. В третьому
ж шарі на три його оболонки (
.
Порівнюючи цю конфігурацію з конфігурацією
неону, помічаємо, що перші два електронні
шари літію мають таку саму конфігурацію,
як і у неону, тобто є повністю заповненими,
укомплектованими електронами. В третьому
ж шарі на три його оболонки (![]() )
з сумарною місткістю 18 електронів
припадає один-єдиний електрон. Цей
електрон має назву валентного
електрону
літію, з огляду на те, що він легко
віддається під час хімічних реакцій,
тому що найслабше пов’язаний з рештою
електронів та ядром. Шари та оболонки
літію можна розділити на повністю
скомплектовані, заповнені (так званий
„кор”, або серцевину атому) і незаповнені
(так звані валентні) оболонки та шари.
Кількість електронів у валентних шарах
та оболонках атомів визначає їх хімічну
поведінку (зокрема таку важливу в хімії
характеристику як валентність).
)
з сумарною місткістю 18 електронів
припадає один-єдиний електрон. Цей
електрон має назву валентного
електрону
літію, з огляду на те, що він легко
віддається під час хімічних реакцій,
тому що найслабше пов’язаний з рештою
електронів та ядром. Шари та оболонки
літію можна розділити на повністю
скомплектовані, заповнені (так званий
„кор”, або серцевину атому) і незаповнені
(так звані валентні) оболонки та шари.
Кількість електронів у валентних шарах
та оболонках атомів визначає їх хімічну
поведінку (зокрема таку важливу в хімії
характеристику як валентність).
Нарешті, порівнюючи електронні конфігурації елементів однієї групи таблиці Менделєєва (наприклад четвертої групи), помічаємо, що елементи однієї групи мають різні кори, але однакові валентні шари та оболонки і тому з хімічної точки зору мусять бути дуже схожими поміж собою:
|
|
(5.4.3) |
Як
вуглець (14 електронів) так і кремній (32
електрони) мають на зовнішньому
електронному шарі заповнену
![]() -оболонку
і незаповнену
-оболонку
і незаповнену
![]() -оболонку.
Електрони останньої найслабкіше
пов’язані з атомом, тому обидва елементи
часто демонструють валентність +2, тобто
є донорами, віддають ці електрони. Проте
електрони
-оболонку.
Електрони останньої найслабкіше
пов’язані з атомом, тому обидва елементи
часто демонструють валентність +2, тобто
є донорами, віддають ці електрони. Проте
електрони
![]() оболонки які дещо міцніше тримаються
в атомі, незважаючи на її комплектність,
входять до незаповненого валентного
шару і часто також приймають участь в
хімічних реакціях. В такому разі ці
елементи демонструють валентність ±4.
оболонки які дещо міцніше тримаються
в атомі, незважаючи на її комплектність,
входять до незаповненого валентного
шару і часто також приймають участь в
хімічних реакціях. В такому разі ці
елементи демонструють валентність ±4.
Послідовний
порядок заповнення шарів та оболонок,
розглянутий нами, спостерігається лише
до![]() .
Для цього елементу конфігурація повинна
б була бути такою:
.
Для цього елементу конфігурація повинна
б була бути такою:
![]() .
Проте енергія
.
Проте енергія
![]()
![]() -стану
виявляється вищою за енергію
-стану
виявляється вищою за енергію
![]() -стану,
тому реальна конфігурація калію така:
-стану,
тому реальна конфігурація калію така:
![]() .
Такі „збої” заповнення шарів та оболонок
виникають за рахунок явища взаємодії
поміж електронами атому.
.
Такі „збої” заповнення шарів та оболонок
виникають за рахунок явища взаємодії
поміж електронами атому.
Цікавою є також таблиця елементів, побудована на іншому принципі, ніж таблиця Менделєєва, хоча також з урахуванням принципу Паулі. Така таблиця запропонована Лонге та Хіггінсом. В її основу покладені конфігурації валентних оболонок атомів. Таблиця Лонге-Хіггінса фактично приймає до уваги лише валентні оболонки кожного атому і має наступний вигляд:
|
О Шар |
s |
p |
d |
f |
|
1(K) |
H,He |
|
|
|
|
2 (L) |
Li,Be |
C,N,O,F,Ne |
||
|
3(M) |
Na,Mg |
Al,Si,P,S,Cl,Ar |
Sc,Ti,V,Cr,Mn,Fe,Co,Ni,Cu,Zn |
|
|
4(N) |
K,Ca |
Ga,Ge,As,Se,Br,Kr |
Y,Zr,Nb,Mo,Tc,Ru, Rh,Pd,Ag,Cd |
Ce,Pr,Nd,Pm,Sm,Eu,Gd, Tb,Dy,Ho,Er,Tm,Yb,Lu |
|
5(O) |
Rb,Sr |
In,Sn,Sb,Te,I,Xe |
Hf,Ta,W,Re,Os,Ir, Pt,Au,Hg,La |
Th,Pa,U,Np,PuAm,Cm, Bk,Cf,Es,Fm, Md,102,103 |
|
6(P) |
Cs,Ba |
Tl,Pb,Bi,Po At,Rn |
Ac,104—112 |
|
|
7(R) |
Fr,Ra |
113—118 |
|
-
Закон Мозлі*
Характеристичними
називають такі рентгенівські спектри,
які виникають при резонансному поглинанні
електронами атому енергії рентгенівських
квантів. При такому резонансному
поглинанні електрон внутрішнього шару
з номером
![]() та енергією
та енергією
![]() переходить у збуджений стан на інший
вільний рівень в шарі з номером
переходить у збуджений стан на інший
вільний рівень в шарі з номером
![]() та енергією
та енергією
![]() .
При зворотному переході такого електрону
зі збудженого в основний стан випромінювався
рентгенівський квант певної частоти:
.
При зворотному переході такого електрону
зі збудженого в основний стан випромінювався
рентгенівський квант певної частоти:
|
|
(5.4.4) |
Мозлі встановив закономірність такого лінійчатого характеристичного випромінювання атомів. Його закон стверджує, що цю частоту можна записати у наступному вигляді:
|
|
(5.4.5) |
д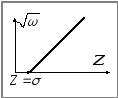 е
е
![]() - стала Ридберга, а константи
- стала Ридберга, а константи
![]() мають
назву констант екранування. Для
мають
назву констант екранування. Для
![]() -шару
така константа дорівнює нулю (
-шару
така константа дорівнює нулю (![]() ),
а для інших шарів поступово зростає за
величиною із ростом номеру шару.
),
а для інших шарів поступово зростає за
величиною із ростом номеру шару.
Якщо
зафіксувати номери шарів у виразі
(5.4.5) і вважати, що
![]() ,
то рівняння (5.4.5) можна переписати у
вигляді:
,
то рівняння (5.4.5) можна переписати у
вигляді:
|
|
(5.4.6) |
|
|
(5.4.7) |
Інакше
кажучи, частота фіксованого характеристичного
кванту (наприклад кванту, відповідного
за перехід з
![]() -
шару до
-
шару до
![]() -
шару) змінюється при переході від
елементу до елементу за законом (5.4.7),
оскільки змінюється порядковий номер
елементу
-
шару) змінюється при переході від
елементу до елементу за законом (5.4.7),
оскільки змінюється порядковий номер
елементу
![]() .
Графік залежності (5.4.7) повинен бути
лінійним, як на Мал.5.4.1.
.
Графік залежності (5.4.7) повинен бути
лінійним, як на Мал.5.4.1.
|
Факультет машинобудування |
|
|
|
Лектор Дон Н.Л. |
|
стор.
|

 5.4.
БАГАТОЕЛЕКТРОННІ АТОМИ
5.4.
БАГАТОЕЛЕКТРОННІ АТОМИ болонка
болонка