
- •Розділ 2.1. Хімічна термодинаміка
- •2.1.1. Основні поняття хімічної термодинаміки
- •2.1.2. Перший закон термодинаміки та його застосування до хімічних процесів
- •2.1.3. Термохімія. Закон Гесса та наслідки з нього
- •2.1.4. Зміни ентропії та енергії Гіббса як критерії напрямленості процесу та стану рівноваги
- •Розділ 2.2. Швидкість хімічних реакцій. Хімічна рівновага
- •2.2.1. Основні положення і поняття швидкості хімічних реакцій
- •2.2.2. Вплив концентрації реагуючих речовин на швидкість реакцій
- •2.2.3. Вплив природи реагуючих речовин і температури на швидкість реакцій
- •2.2.4. Каталіз
- •2.2.5. Хімічна рівновага
2.2.2. Вплив концентрації реагуючих речовин на швидкість реакцій
Залежність швидкості реакції від концентрації для елементарних (одностадійних) процесів виражається законом діючих мас: швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих речовин, які зведені в ступінь їх стехіометричних коефіцієнтів. Так для реакції aА + bВ → dD + fF швидкість виражається кінетичним рівнянням:
![]() , (2.18)
, (2.18)
де
![]() –
концентрації речовин,
–
концентрації речовин,
![]() – константа
швидкості, яка чисельно дорівнює
швидкості реакції, якщо концентрації
всіх реагуючих речовин дорівнюють
одиниці. Ця константа є величиною сталою
за умови сталості температури. Константа
швидкості залежить від природи речовини,
температури і не залежить від концентрації
реагуючих речовин.
– константа
швидкості, яка чисельно дорівнює
швидкості реакції, якщо концентрації
всіх реагуючих речовин дорівнюють
одиниці. Ця константа є величиною сталою
за умови сталості температури. Константа
швидкості залежить від природи речовини,
температури і не залежить від концентрації
реагуючих речовин.
Записуючи
вираз закону діючих мас слід пам’ятати,
що показники ступенів найчастіше
не дорівнюють стехіометричним
коефіцієнтам сумарного рівняння реакції
і мають дещо формальний характер. Тому,
для реакцій, що протікають у декілька
стадій, залежність швидкості від
концентрації реагуючих речовин А і В
виглядає таким чином:
![]() ,
(2.19)
,
(2.19)
де m і n – називають порядком реакції за концентрацією даної речовини, m + n – загальним порядком реакції.
Треба враховувати, що для більшості хімічних реакцій сумарні рівняння не відображають дійсного механізму реакцій, які, як правило, здійснюються через кілька проміжних стадій. Швидкість для таких реакцій зумовлюється (лімітується) швидкістю перебігу найповільнішої з них.
Якщо в реакції, крім газу чи рідини, бере участь також тверда речовина, концентрація якої постійна, то закон діючих мас для гетерогенних реакцій не враховує концентрації твердої речовини, і швидкість реакції змінюється тільки в залежності від концентрації газів і розчинних речовин. Наприклад, для реакції:
FeO(т) + CO(г) → Fe(т) + CO2(г)
згідно
закону діючих мас математичний вираз
швидкості реакції має вигляд:
![]() (FeO – тверда речовина).
(FeO – тверда речовина).
2.2.3. Вплив природи реагуючих речовин і температури на швидкість реакцій
У більшості випадків підвищення температури призводить до збільшення швидкості реакції. Згідно із правилом Вант-Гоффа (для невисоких та середніх температур) при підвищенні температури на кожні 100C швидкість (константа швидкості) реакції зростає в 2-4 рази. Число, яке показує в скільки разів збільшується швидкість даної реакції при збільшенні температури на 100С, називається температурним коефіцієнтом швидкості реакції γ:
 . (2.20)
. (2.20)
Значення температурного коефіцієнта згідно із правилом Вант-Гоффа найчастіше лежать у межах 2–4, хоча відомо багато реакцій, де цей коефіцієнт менший за 2 або більший за 4.
Якщо відома швидкість реакції при температурі Т1 і температурний коефіцієнт γ, то швидкість реакції при будь-якій температурі приблизно може бути обчислена за формулою Вант-Гоффа:
![]() . (2.21)
. (2.21)
Зауважимо, що правило Вант-Гоффа є наближеним, температурний коефіцієнт можна вважати більш-менш сталим тільки у вузькому інтервалі температур. Точніше залежність швидкості від температури передають за допомогою рівняння Арреніуса:
 , (2.22)
, (2.22)
де
![]() і
і![]() – константи
швидкості відповідно при температурах
– константи
швидкості відповідно при температурах![]() і
і![]() ,
,![]() – універсальна газова стала,
– універсальна газова стала,![]() – енергія
активації. Згідно з Арреніусом у хімічну
реакцію вступають тільки ті молекули,
які мають енергію, якої достатньо для
елементарного акту реакції. Ці молекули
Арреніус назвав активними, а енергію
таких молекул –енергією активації.
– енергія
активації. Згідно з Арреніусом у хімічну
реакцію вступають тільки ті молекули,
які мають енергію, якої достатньо для
елементарного акту реакції. Ці молекули
Арреніус назвав активними, а енергію
таких молекул –енергією активації.
Енергія
активації (![]() )
– мінімальна надлишкова енергія, яку
повинні мати молекули по відношенню до
значення середньої енергії реагуючих
молекул для того, щоб реакція стала
можливою. Подолання енергетичного
бар’єра частками вихідних речовин
зв’язано з утворенням активованого
комплексу
[АК],
який перетворюється в продукти реакції
за рахунок розриву старих зв’язків і
утворення нових. Наприклад, для реакції
водню з йодом під час зіткнення молекул
зв’язки Н–Н та І–І послаблюються, і
починають утворюватись нові зв’язки
Н–І. У результаті виникає угруповання,
яке називають активованим комплексом,
або перехідним станом.
)
– мінімальна надлишкова енергія, яку
повинні мати молекули по відношенню до
значення середньої енергії реагуючих
молекул для того, щоб реакція стала
можливою. Подолання енергетичного
бар’єра частками вихідних речовин
зв’язано з утворенням активованого
комплексу
[АК],
який перетворюється в продукти реакції
за рахунок розриву старих зв’язків і
утворення нових. Наприклад, для реакції
водню з йодом під час зіткнення молекул
зв’язки Н–Н та І–І послаблюються, і
починають утворюватись нові зв’язки
Н–І. У результаті виникає угруповання,
яке називають активованим комплексом,
або перехідним станом.
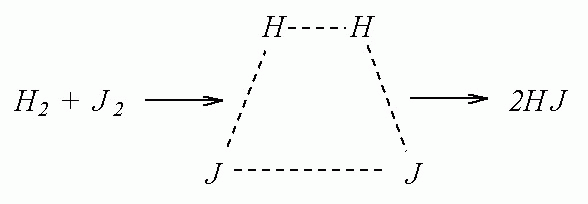
активований комплекс [AK]
Зміну енергії частинок, що реагують, у процесі хімічного перетворення можна зобразити на енергетичній діаграмі (рис. 10).
Різниця між середньою енергією молекул продуктів реакції і молекул вихідних речовин визначає тепловий ефект реакції. Якщо Епродуктів > Евихідних речовин, то процес за тепловим ефектом ендотермічний, якщо Епродуктів < Евихідних речовин, то процес за тепловим ефектом екзотермічний.

a) б)
Рис. 10. Енергетичні
діаграми оборотної хімічної реакції
Н2 + I2 ⇄ 2HI:
а) пряма реакція, для якої
![]() <0,
<0,![]() ;
б) зворотна реакція, для якої
;
б) зворотна реакція, для якої![]() >0,
>0,![]() ,
де
,
де![]() і
і![]() – відповідно
сумарні значення стандартних ентальпій
утворення вихідних речовин і продуктів
реакції,
– відповідно
сумарні значення стандартних ентальпій
утворення вихідних речовин і продуктів
реакції,![]() і
і![]() – енергії
активації відповідних процесів
– енергії
активації відповідних процесів
Енергія активації різних реакцій різна. ЇЇ величина є тим фактором, за допомогою якого позначається вплив природи реагуючих речовин на швидкість реакції.
