
- •Модуль 3. Розчини
- •Розділ 3.1. Уявлення про дисперсні системи і розчини
- •Розділ 3.2. Фізико-хімічні властивості розбавлених розчинів неелектролітів
- •3.2.1. Осмос і осмотичний тиск
- •3.2.2. Тиск пари розчинів. Закон Рауля
- •3.2.3. Температури кипіння і замерзання розчинів
- •Розділ 3.3. Розчини електролітів
- •3.3.1. Теорія електролітичної дисоціації
- •Фізико-хімічні властивості розчинів електролітів
- •3.3.2. Йонні реакції в розчинах електролітів
- •3.3.3. Добуток розчинності малорозчинних речовин
- •3.3.4. Йонний добуток води. Водневий показник як кількісна характеристика кислотності-основності розчинів
- •3.3.5. Гідроліз солей
- •Зміщення рівноваги гідролізу
- •3.3.6. Твердість води та способи її усунення
Модуль 3. Розчини
|
Розділ 3.1. Уявлення про дисперсні системи і розчини |
|
Розділ 3.2. Фізико-хімічні властивості розбавлених розчинів неелектролітів... |
|
3.2.1. Осмос і осмотичний тиск |
|
3.2.2. Тиск пари розчинів. Закон Рауля |
|
3.2.3. Температури кипіння і замерзання розчинів |
|
Розділ 3.3. Розчини електролітів |
|
3.3.1.Теорія електролітичної дисоціації |
|
3.3.2. Йонні реакції в розчинах електролітів |
|
3.3.3. Добуток розчинності малорозчинних речовин |
|
3.3.4. Йонний добуток води. Водневий показник як кількісна характеристика кислотності – основності розчинів |
|
3.3.5. Гідроліз солей |
|
3.3.6. Твердість води та способи її усунення |
Розділ 3.1. Уявлення про дисперсні системи і розчини
Система, у якій речовина у вигляді дуже дрібних частинок рівномірно розподілена в об’ємі іншої, називаються дисперсною. При цьому розрізняють два поняття: дисперсна фаза і дисперсійне середовище. Дисперсна фаза – речовина як складова частина системи, рівномірно розподіленої в її об’ємі. Середовище, у якому рівномірно розподілена дисперсна фаза, називають дисперсійним середовищем.
Агрегатний стан дисперсних систем залежить від агрегатного стану середовища, тобто вони можуть бути твердими (сплави), рідкими (піни, емульсії, суспензії) чи газуватими (дими, тумани, газуваті суміші). Широко поширеними на практиці є суспензії та емульсії. Суспензія – це система, у якій дисперсною фазою є тверда речовина, а дисперсійним середовищем – рідина. Емульсія – дисперсна система, що складається із двох практично взаємно нерозчинних рідких фаз.
Якщо лінійні розміри частинок дисперсної фази не перевищують розмірів молекул чи йонів (до 1 нм), то такі системи називають істинними розчинами, або просто розчинами.
Розчином є гомогенна система, що складається із двох і більше компонентів, одним з яких є розчинник, а інші – розчинені речовини. Розчинником є та речовина, що кількісно переважає і знаходиться в такому ж агрегатному стані, що і розчин. Розчинені речовини в розчинах подрібнюються до окремих молекул або йонів, які не можуть утворити самостійну фазу. Характерною ознакою розчинів є однорідність у різних частинах об’єму, і тим вони нагадують хімічні сполуки. Однак, на відміну від останніх склад розчинів може бути різноманітним. Розчини за агрегатним станом бувають:
1) рідкі (газ + рідина, наприклад, розчин гідроген хлориду у воді; рідина + рідина, наприклад, розчин етанолу в бензолі; тверда речовина + рідина, наприклад, розчин сечовини в гексані).
2) газові (газ + газ, наприклад, суміш кисню та азоту).
3) тверді розчини бувають двох типів:
а) тверді розчини заміщення утворюються під час кристалізації рідких розчинів, якщо компоненти розчину мають однотипні кристалічні ґратки, а часточки компонентів – близкі розміри, наприклад, Ag i Au, KCl i KBr.
б) тверді розчини проникнення утворюються за рахунок проникнення йонів, атомів або молекул однієї речовини в пустоти між решітками іншої речовини.
Згідно з сучасною теорією розчинів між компонентами розчину відбувається фізико-хімічна взаємодія. Процес взаємодії між частинками речовини, що розчиняється, та молекулами розчинника називають сольватацією (або гідратацією, якщо розчинником є вода). Сольватація включає різні види взаємодії, що залежать від природи частинок речовини, що розчиняється, і властивостей молекул розчинника. Вода внаслідок дипольного характеру її молекул є добрим розчинником великої кількості сполук із йонним характером зв’язку. Енергія, яка потрібна для руйнування йонної кристалічної решітки, компенсується в значній мірі енергією утворення йон-дипольних зв’язків, тобто енергією утворення гідратованих йонів.
Якщо розчинник і речовина, що розчиняється, складаються з полярних молекул, то між молекулами цих речовин відбувається орієнтаційна диполь-дипольна взаємодія. Прикладом може бути розчинення метанолу у воді. Молекули цих речовин зв’язані між собою також силами індукційної та дисперсійної взаємодії, але найбільший внесок роблять водневі зв’язки (О∙∙∙Н).
Таким чином, розчинення є складним фізико-хімічним процесом, що супроводжується тепловими ефектами. Тепловий ефект, що супроводжує процес розчинення, відносять до 1 моля розчиненої речовини і називають молярною теплотою розчинення. Теплота розчинення залежить від природи розчиненої речовини і розчинника, а також від температури розчинення. Тепловий ефект розчинення (∆Н), згідно з положення фізико-хімічної теорії розчинів, визначають як алгебраїчну суму теплових ефектів окремих елементарних стадій розчинення:
∆Н = ∆Н1 + ∆Н2 + ∆Н3, (3.1)
де ∆Н1 – ендотермічний ефект руйнування міжмолекулярних зв’язків у речовинах, що розчиняються; ∆Н2 – екзотермічний ефект хімічної взаємодії розчинника з частинками розчиненої речовини (ефект утворення сольватів або гідратів); ∆Н3 – ендотермічний ефект рівномірного розподілу сольватів або гідратів у розчиннику завдяки дифузії.
Знак ∆Н залежить від того, який із зазначених доданків переважає.
Утворення розчину – процес завжди самодовільний, тобто за ізобарно-ізотермічних умов утворення розчину має супроводжуватись зменшенням енергії Гіббса.
Розчинністю називається здатність речовини розчинятися в даному розчиннику при даній температурі. Розчинність речовин значною мірою залежить від температури. З підвищенням температури розчинність твердих речовин здебільшого зростає, проте для деяких сполук вона може зменшуватися (Ca(OH)2, CaSO4∙2H2O).
Розчинність – процес оборотний. В залежності від умов відбувається або розчинення, або виділення з розчину розчиненої речовини. Внаслідок оборотності процесу розчинення до нього може бути застосований принцип Ле-Шательє. З підвищенням температури в системі буде переважати процес, що послаблює зростання температури, тобто ендотермічний процес. А таким процесом найчастіше є розчинення твердих речовин. Тому в більшості випадків розчинність твердих речовин у рідинах при нагріванні зростає. Але відомі випадки, коли розчинення твердих речовин перебігає з виділенням теплоти; тоді при нагріванні їх розчинність зменшується. Якщо розчинення супроводжується незначним тепловим ефектом, то розчинність практично не залежить від температури.
Тиск практично не впливає на розчинність твердих речовин у рідинах, оскільки об’єм системи зі зміною тиску в процесі розчинення змінюється мало.
Розглядаючи взаємну розчинність рідин, треба зазначити, що під час змішування мають місце випадки, коли рідини: а) розчиняються одна в одній необмежено (етанол-вода); б) розчиняються обмежено (фенол-вода), в) практично одна в одній не розчиняються (ртуть-вода). Як вже зазначалося, розчинність перш за все визначається природою цих рідин.
Вплив температури на розчинність розглянемо для випадку обмеженої розчинності рідин. У системі вода-фенол під час змішування речовин за звичайних умов утворюються дві різні фази – розчини фенолу у воді та води у фенолі. Склад їх неоднаковий і залежить від температури: так за 293 К у першому із цих розчинів міститься 8 % фенолу і 92 % води, у другому – 72 % фенолу та 28 % води. Процес розчинення фенолу у воді та води у фенолі супроводжується поглинанням теплоти, тому з нагріванням взаємна розчинність речовин збільшується, тобто зростає концентрація фенолу в першому розчині та води в другому. Склад фаз наближається один до іншого, і за 339 К лишається одна фаза (36 % фенолу і 64 % води), тобто в системі настає необмежена розчинність. Температура, починаючи з якої дві рідини необмежено змішуються, називаються критичною температурою розчинення. При охолодженні система повертається до стану обмеженої розчинності і розшаровується, тобто утворюються дві фази.
Зауважимо, що зростання взаємної розчинності рідин та перехід до стану необмеженої розчинності при нагріванні спостерігається не завжди. Вплив температури на розчинність рідин у рідинах часто має досить складний характер.
Розчинність газів у рідинах залежить від природи речовин, що утворюють розчин, температури і тиску.
Розчинність газів у воді проходить із виділенням теплоти, тому згідно із принципом Ле-Шательє, підвищення температури знижує розчинність газів. Наприклад, кип’ятінням розчину здебільшого можна повністю позбутися розчинених у воді газів (СО2, О2, N2).
При розчиненні газів у рідинах встановлюється рівновага:
Газ + Рідина ⇄ Насичений розчин газу у рідині.
При цьому об’єм системи переважно зменшується, тому зі збільшенням зовнішнього тиску, згідно із принципом Ле-Шательє, у рівноважній системі більшою мірою повинен відбуватися процес, який послабить підвищення тиску. Тому частина молекул газу перейде в розчин, і розчинність збільшиться. Залежність розчинності газу від тиску визначається законом Генрі: за сталої температури розчинність газу в рідині прямо пропорційна його парціальному тиску: m = k∙р, (3.2)
де m – маса газу, що розчиняється в 1 л розчинника, k–константа Генрі, р – тиск газу (або парціальний тиск, коли маємо суміш газів).
Мірою розчинності речовини є концентрація її в насиченому розчині. Розчини бувають: насичені, пересичені і ненасичені. Насиченим вважається розчин, що знаходиться в рівновазі з речовиною, що розчиняється. У насиченому розчині міститься гранична за даних умов кількість розчиненої речовини. Розчин є пересиченим, якщо в ньому міститься розчиненої речовини більше ніж визначено межею розчинності. Розчин, що містить речовини менше, чим визначено межею розчинності, називається ненасиченим. На практиці розчинність речовини часто виражають коефіцієнтом розчинності, який показує масу речовини, що розчиняється при даній температурі в 100 г розчинника з утворенням насиченого розчину.
Способи вираження концентрації розчинів
Важливою характеристикою будь-якого розчину є відносний вміст у ньому розчиненої речовини і розчинника, що називається концентрацією. На практиці використовують наступні способи вираження концентрації.
1. Масова (об’ємна) частка – відношення маси (об’єму) розчиненої речовини до загальної маси (об’єму) розчину:
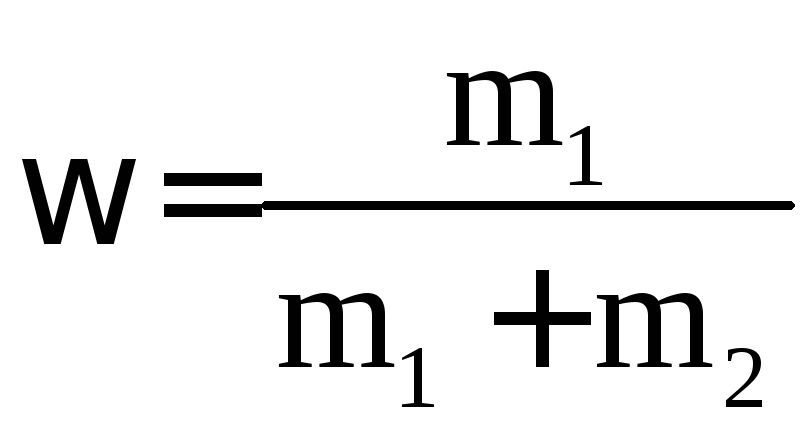 ·100
%; (3.3)
·100
%; (3.3)
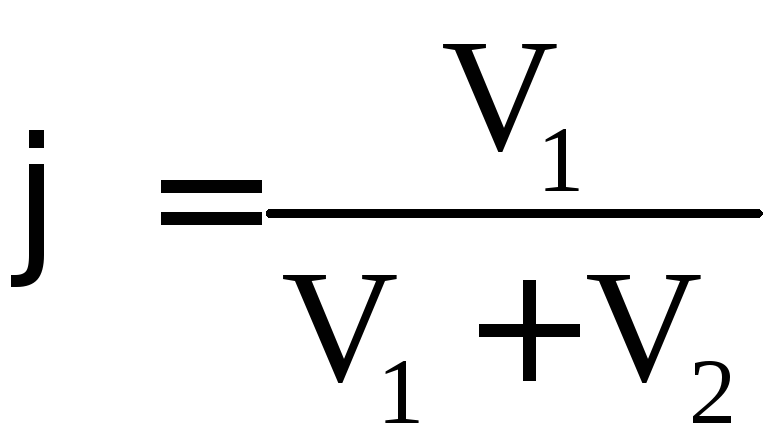 ·100
%. (3.4)
·100
%. (3.4)
Частки виражають у частинах від одиниці або у відсотках.
2. Молярна концентрація – відношення кількості розчиненої речовини до об’єму розчину:
![]()
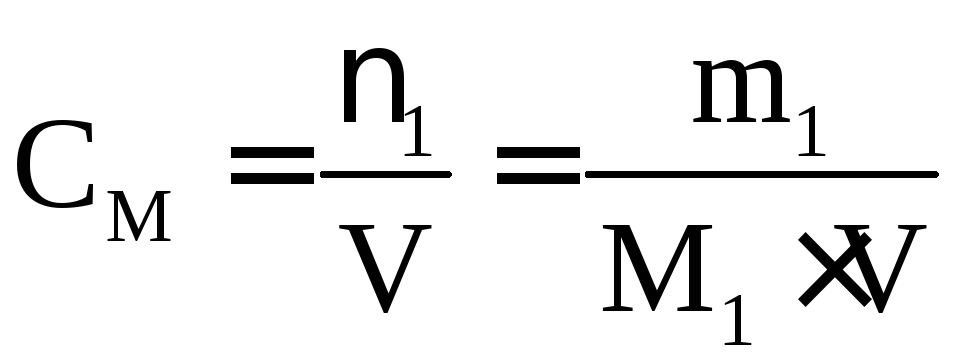 ,
[моль/л] (скорочено М).
(3.5)
,
[моль/л] (скорочено М).
(3.5)
3. Молярна концентрація еквівалентів (нормальна концентрація) – відношення кількості еквівалентів розчиненої речовини до об’єму розчину:
 ,
[моль/л або н]. (3.6)
,
[моль/л або н]. (3.6)
4. Моляльна концентрація (моляльність) – відношення кількості розчиненої речовини до маси розчинника (кількість молів розчиненої речовини, що припадає на 1 кг (1000 г) розчинника):
 ,
[моль/кг].(3.7)
,
[моль/кг].(3.7)
5. Молярна
частка – відношення
кількості даного компонента до загальної
кількості речовин у розчині. Для
двокомпонентних розчинів: 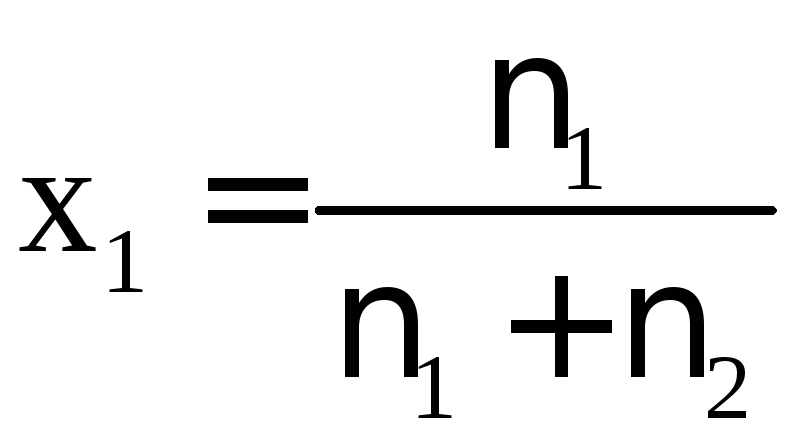 ,(3.8)
,(3.8)
х1 + х2 = 1, (3.9)
де
ME – молярна
маса еквівалентів розчиненої речовини,
m1
(m2)
– маса розчиненої речовини (розчинника),
г; M1
– молярна маса розчиненої речовини,
г/моль; V – об’єм розчину, л;
![]() (
(![]() )
– кількість молів розчиненої речовини
(розчинника);
)
– кількість молів розчиненої речовини
(розчинника);![]() (
(![]() )
– молярна частка розчиненої речовини
(розчинника).
)
– молярна частка розчиненої речовини
(розчинника).
