
- •Модуль 3. Розчини
- •Розділ 3.1. Уявлення про дисперсні системи і розчини
- •Розділ 3.2. Фізико-хімічні властивості розбавлених розчинів неелектролітів
- •3.2.1. Осмос і осмотичний тиск
- •3.2.2. Тиск пари розчинів. Закон Рауля
- •3.2.3. Температури кипіння і замерзання розчинів
- •Розділ 3.3. Розчини електролітів
- •3.3.1. Теорія електролітичної дисоціації
- •Фізико-хімічні властивості розчинів електролітів
- •3.3.2. Йонні реакції в розчинах електролітів
- •3.3.3. Добуток розчинності малорозчинних речовин
- •3.3.4. Йонний добуток води. Водневий показник як кількісна характеристика кислотності-основності розчинів
- •3.3.5. Гідроліз солей
- •Зміщення рівноваги гідролізу
- •3.3.6. Твердість води та способи її усунення
3.3.3. Добуток розчинності малорозчинних речовин
У гетерогенній системі малорозчинної сполуки, яка складається з осаду та насиченого розчину електроліту, з однаковою швидкістю безперервно здійснюються два процеси: за одиницю часу під дією полярних молекул розчинника і йони речовини переходять у розчин і в такій же кількості осаджуються на поверхні кристалу.
Із часом при сталій температурі встановлюється динамічна рівновага між твердою фазою (осадом) та йонами в розчині:
Cd(OH)2 ⇄ Cd2+(р) + 2OH– (р)
Згідно із законом діючих мас, таку рівновагу характеризують величиною константи рівноваги:
 ,
,
де
![]() – концентрація речовини в осаді, яка
при переході йонів у розчин практично
не змінюється, тому її вважають сталою
величиною.
– концентрація речовини в осаді, яка
при переході йонів у розчин практично
не змінюється, тому її вважають сталою
величиною.
Добуток
константи рівноваги (К) і рівноважної
концентрації твердої фази (![]() )
також величина стала. Для гетерогенних
систем таку константу називають добутком
розчинності та позначають ДР (додаток
5).
)
також величина стала. Для гетерогенних
систем таку константу називають добутком
розчинності та позначають ДР (додаток
5).
В загальному вигляді для малорозчинної речовини AmBn, для якої рівняння динамічної рівноваги можна записати так:
AmBn ⇄ mAn+ + nBm–,
вираз добутку розчинності має вигляд:
ДР(AmBn) = [An+]m · [Bm–]n. (3.24)
Добуток розчинності важкорозчинної сполуки у насиченому розчині при даній температурі дорівнює добутку молярних концентрацій йонів, кожна з яких знаходиться у ступені, що дорівнює стехіометричному коефіцієнту при відповідному йоні в рівнянні рівноваги.
Наприклад,
ДР(Ag2S)
= [Ag+]2
·
[S2–],
ДР(Са3(РО4)2)
= [Са2+]3
·
[РО![]() ]2.
]2.
Добуток розчинності характеризує розчинність речовини, тобто, чим більше значення добутку розчинності, тим більша при даній температурі розчинність (S) малорозчинного електроліту.
Так
для насиченого розчину Ag2S:
[Ag+] = 2S,
[S2–] = S,
тоді ДР(Ag2S) = [Ag+]2 · [S2–] = (2S)2 · S = 4S3.
За значенням добутку розчинності Ag2S
обчислюють розчинність цієї солі:
 .
.
Так визначають розчинність малорозчинної сполуки у моль/л. Щоб визначити розчинність у г/л використовують рівняння:
![]() .
.
Осад утвориться в тому випадку, коли добуток концентрацій йонів малорозчинного електроліту перевищить величину його добутку розчинності при даній температурі.
Для того, щоб розчинити осад, у розчин уводять такий електроліт, йони якого можуть утворювати малодисоційовану сполуку з одним з йонів важкорозчинного електроліту. Введення однойменних йонів у розчин важкорозчинного електроліту знижує його розчинність.
3.3.4. Йонний добуток води. Водневий показник як кількісна характеристика кислотності-основності розчинів
Вода є досить слабким електролітом. Однією з причин слабкої дисоціації води є те, щоб молекули її є асоційованими за допомогою водневих зв’язків. Іншою причиною є амфолітні властивості води, коли одна молекула її відіграє роль кислоти (відщеплює протон H+), а друга – основи (приєднує протон), тобто дисоціацію води можна умовно подати як двостадійний процес:
а) Н2О ⇄ H+ + ОН– (ендотермічний процес)
б) H+ + Н2О ⇄ Н3О+ (екзотермічний процес)
або HОН + HОН ⇄ Н3О+ + ОН–.
Сполуки-амфоліти, які дисоціюють за схемою так званого автопротолізу, виявляють слабкі електролітичні властивості. Дисоціацію води записують спрощено: Н2О ⇄ H+ + ОН–.
Для
стану рівноваги вираз константи
дисоціації води можна представити як:
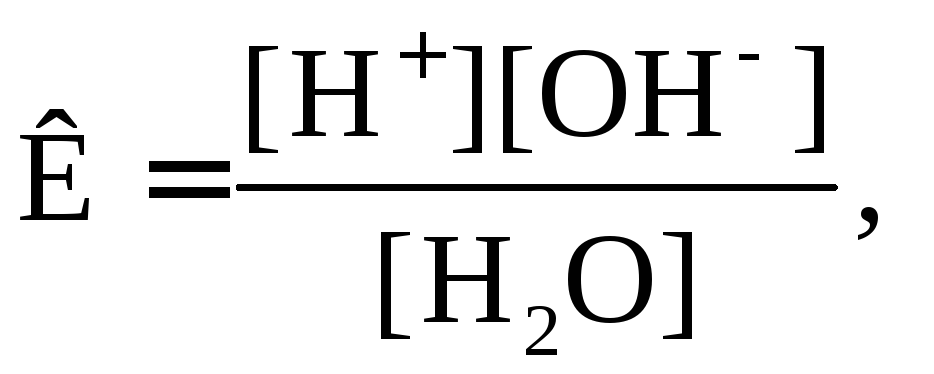 або
або![]()
Оскільки для води при 298 К значення Кдис.=1,86∙10–16 і концентрація води – величина стала, яку розраховують, як:

то
добуток
![]() є також величиною сталою за цих умов і
називається йонним добутком води
є також величиною сталою за цих умов і
називається йонним добутком води![]() ,
який чисельно дорівнює:
,
який чисельно дорівнює:![]() Таким чином:
Таким чином:
![]() (3.25)
(3.25)
Оскільки концентрації йонів Н+ і ОН– взаємопов’язані, то для визначення кислотності-основності середовища використовують концентрацію йонів Н+ або водневий показник рН. Водневим показником рН називають десятковий логарифм концентрації йонів Гідрогену зі знаком мінус:
pН= –lg [H+] (3.26)
або
![]() ,
(3.27)
,
(3.27)
де [H+] – молярна концентрація йонів Гідрогену в розчині. Аналогічно концентрацію гідроксид-йонів виражають через показник рОН, який є десятковим логарифмом концентрації гідроксид йонів, взятий зі знаком мінус:
рОН = –lg [ОН–]. (3.28)
На основі йонного добутка води обчислюють концентрацію [H+]- та [ОH–]-йонів за формулами:
рН + рОН = 14; (3.29)
рН = 14 – рОН; (3.30)
рОН = 14 – рН. (3.31)
У кислих розчинах: [H+] > [ОН–] і pН < 7.
У лужних розчинах: [H+] < [ОН–] і pН > 7.
У чистій воді (нейтральне середовище): [H+] = [OH–] = 10–7 і pН = 7.
Вся шкала кислотності-основності знаходиться в межах від 10–14 до нуля, моль йонів/л:
|
[H+] |
0 |
10–1, |
10–2, |
..., |
10–6, |
10–7, |
10–8, |
..., |
10–12, |
10–13, |
10–14 |
|
[ОН–] |
10–14, |
10–13, |
10–12, |
..., |
10–8, |
10–7, |
10–6, |
..., |
10–2, |
10–1, |
0 |
![]()
![]()
![]()
нейтральне середовище
[H+] = [OH–] = 10–7
Для визначення рН користуються спеціальними речовинами –індикаторами. Індикатори – складні органічні сполуки, які за хімічними властивостями є слабкими кислотами або основами. Вони змінюють своє забарвлення залежно від концентрації йонів Н+ та ОН–. Характеристики деяких важливих індикаторів наведено в табл. 3.2. Зміна забарвлення індикаторів відбувається в певному інтервалі значень рН розчину.
Таблиця 3.2
|
Індикатор |
Характер індикатора |
Інтервал переходу рН |
Забарвлення за умови рН > 7 |
Забарвлення за умови рН = 7 |
Забарвлення за умови рН < 7 |
|
Метиловий оранжевий |
основний |
3,1 – 4,5 |
жовте |
оранжеве |
рожеве |
|
Метиловий червоний |
основний |
4,2 – 6,3 |
жовте |
оранжеве |
червоне |
|
Лакмус |
кислотний |
5,0 – 8,0 |
синє |
фіолетове |
червоне |
|
Фенолфталеїн |
кислотний |
8,3 – 9,8 |
малинове |
безбарвне |
безбарвне |
