
- •Розділ ііі. Молекулярна фізика і термодинаміка Лекція 1. Молекулярно-кінетична теорія речовини
- •1. Атомно-молекулярна будова речовини.
- •Лекція 2. Елементи статистичної фізики.
- •1. Розподіл молекул ідеального газу за їхніми швидкостями.
- •2. Барометрична формула, розподіл Больцмана.
- •3. *Зіткнення молекул, середня довжина вільного пробігу молекул.
- •4. *Поведінка газів за умов низького тиску.
- •5. *Вакуумна техніка.
- •Лекція 3. Основи термодинаміки.
- •2. Внутрішня енергія системи як функція стану.
- •3. Перше начало термодинаміки.
- •4. Термодинамічні діаграми.
- •5. Ізопроцеси в газах.
- •6. Адіабатний процес.
- •Для адіабатного процесу,
- •7. Теплоємність газів.
- •Лекція 4. Друге начало термодинаміки
- •1. Термодинамічні цикли, робочі цикли теплових та холодильних машин.
- •2. Цикл Карно.
- •3. Оборотні та необоротні процеси.
- •4. Ентропія. Друге начало термодинаміки та його статистичне розуміння. *Теорема Нернста.
- •Лекція 5. Реальні гази
- •Лекція 6. Тверді тіла. Рідини
2. Внутрішня енергія системи як функція стану.
Однією з основних характеристик термодинамічної системи є внутрішня енергія.
Під внутрішньою енергією системи розуміють суму кінетичних енергій руху всіх молекул (атомів) газу і потенціальних енергій взаємодії між ними.
Внутрішня енергія ідеального газу буде складатися лише з суми кінетичних енергій теплового руху молекул (атомів) газу:
![]() .
.
Середня кінетична енергія руху однієї молекули:
![]() ,
,
тоді для
одного моля газу,
який містить
![]() молекул,внутрішня
енергія
становитиме:
молекул,внутрішня
енергія
становитиме:
![]() або
або
![]() ,
,
оскільки
![]() .
.
Внутрішня енергія довільної кількості газу:
![]() ,
,
де
![]() – маса газу;
– маса газу;
![]() –молярна маса
газу,
–молярна маса
газу,
![]() ;
;
![]() –кількість
речовини,
–кількість
речовини,
![]() .
.
3. Перше начало термодинаміки.
Дослід показує,
що відповідно до закону збереження
енергії при довільному способі переходу
системи з першого стану у другий зміна
внутрішньої енергії
![]() дорівнюватиме різниці між кількістю
теплотиQ,
отриманою системою, і роботою A,
яка виконана системою проти зовнішніх
сил:
дорівнюватиме різниці між кількістю
теплотиQ,
отриманою системою, і роботою A,
яка виконана системою проти зовнішніх
сил: ![]() ,або
,або ![]()
Перше начало
термодинаміки:
якщо
системі передається певна кількість
теплоти
![]() ,
то за законом збереження енергії, вона
піде на збільшення внутрішньої енергії
газу
,
то за законом збереження енергії, вона
піде на збільшення внутрішньої енергії
газу![]() (підвищення температури) та на виконання
газом роботи
(підвищення температури) та на виконання
газом роботи![]() проти зовнішніх сил:
проти зовнішніх сил:
![]()
або
![]() .
.
Вираз для першого закону термодинаміки для нескінченно малої зміни стану системи матиме вигляд:
![]()
або в коректнішій формі
![]() ,
,
де
![]() – нескінченно мала зміна внутрішньої
енергії системи,
– нескінченно мала зміна внутрішньої
енергії системи,
![]() –нескінченно
мала робота,
–нескінченно
мала робота,
![]() –нескінченно
мала кількість теплоти.
–нескінченно
мала кількість теплоти.
У цьому виразі
![]() є повним диференціалом, а
є повним диференціалом, а![]() і
і![]() не є повними диференціалами, а функціоналами
і залежать від вигляду функції, що описує
перехід з одного стану в другий.
не є повними диференціалами, а функціоналами
і залежать від вигляду функції, що описує
перехід з одного стану в другий.
Важливим є випадок, у якому система – це періодично діюча машина, в якій газ, пара або інше “робоче тіло” внаслідок деякого процесу повертається у початковий стан, у цьому разі:
![]() і
і
![]() .
.
Робота, яку виконує
машиною за один цикл, дорівнює підведеній
ззовні теплоті
![]() .
Цей висновок дає змогу дати
.
Цей висновок дає змогу дати
друге формулювання першого закону термодинаміки: неможливо побудувати періодично діючий двигун, який виконував би роботу без підведення енергії ззовні або виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний двигун першого роду неможливий).
4. Термодинамічні діаграми.
Т ермодинамічна
діаграма
– це геометричне зображення рівноважних
станів термодинамічної системи при
різних значеннях параметрів, які описують
дану систему:
ермодинамічна
діаграма
– це геометричне зображення рівноважних
станів термодинамічної системи при
різних значеннях параметрів, які описують
дану систему:
![]() ,
,![]() і
і![]() .
.
Будують термодинамічні
діаграми у наступних координатах:
![]() ,
,![]() ,
,![]() .
Найбільш поширеною є
.
Найбільш поширеною є![]() діаграма,
оскільки площа під кривою цієї діаграми
чисельно дорівнює роботі газу (рис.).
діаграма,
оскільки площа під кривою цієї діаграми
чисельно дорівнює роботі газу (рис.).
5. Ізопроцеси в газах.
Розглянемо найбільш прості процеси, що відбуваються у термодинамічних системах.
Ізопроцеси
– це термодинамічні процеси у газах,
що відбуваються при сталій масі газу і
ще одному сталому параметрі
![]() ,
,![]() або
або![]() :
:
ізотермічний процес –
 :
:
![]() –закон
Бойля-Маріотта.
–закон
Бойля-Маріотта.
Т ермодинамічна
ді-аграма ізотермічного процесу
називаєтьсяізотермою,
у кординатах
ермодинамічна
ді-аграма ізотермічного процесу
називаєтьсяізотермою,
у кординатах
![]() має вигляд гіперболи (рис.).
має вигляд гіперболи (рис.).
Оскільки при
ізотермічному процесі
![]() ,
то
,
то![]() ,
отже і
,
отже і![]() .
Це означає, що при ізотермічному процесі
уся кількість теплоти надана газу йде
на виконання ним роботи:
.
Це означає, що при ізотермічному процесі
уся кількість теплоти надана газу йде
на виконання ним роботи:
![]() –І начало
термодинаміки для ізотермічного процесу.
–І начало
термодинаміки для ізотермічного процесу.
ізохорний процес –
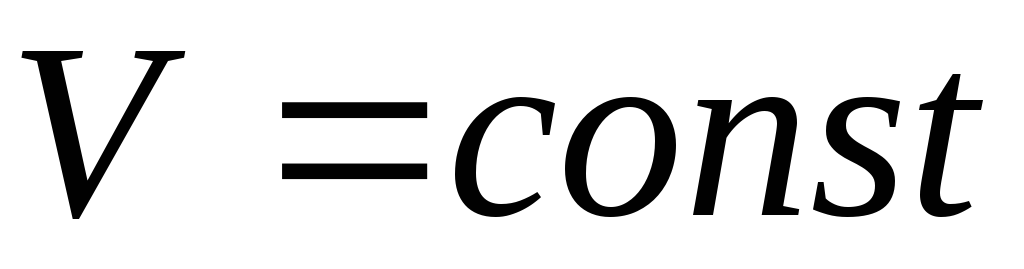 :
:
![]() –закон Шарля.
–закон Шарля.
Т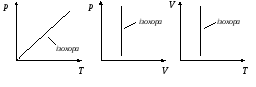 ермодинамічна
діаграма ізохорного процесу називаєтьсяізохорою
(рис.).
ермодинамічна
діаграма ізохорного процесу називаєтьсяізохорою
(рис.).
Оскільки при
ізохорному процесі
![]() ,
то
,
то![]() ,
отже і
,
отже і![]() .
Це означає, що при ізохорному процесі
уся кількість теплоти надана газу йде
на зміну його внутрішньої енергії:
.
Це означає, що при ізохорному процесі
уся кількість теплоти надана газу йде
на зміну його внутрішньої енергії:
![]() –І начало
термодинаміки для ізохорного процесу.
–І начало
термодинаміки для ізохорного процесу.
ізобарний процес –
 :
:
![]() –закон
Гей-Люссака.
–закон
Гей-Люссака.

Термодинамічна діаграма ізобарного процесу називається ізобарою (рис.).
При ізобарному
процесі
![]() і
і![]() .
Це означає, що при ізобарному процесі
кількість теплоти надана газу йде на
зміну його внутрішньої енергії і на
виконання газом роботи:
.
Це означає, що при ізобарному процесі
кількість теплоти надана газу йде на
зміну його внутрішньої енергії і на
виконання газом роботи:
![]() або
або
![]() –І начало
термодинаміки
–І начало
термодинаміки
для ізобарного процесу.
