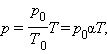- •5 Билет
- •Мощность
- •§5.6. Уравнение Клапейрона-Менделеева. Связь между числом молей газа, его температурой, объемом и давлением.
- •Задачи.
- •[Править]Формулировки
- •Точка росы
- •Измерение влажности
- •[Править]Мнемоническая диаграмма для Закона
- •Опыт Мандельштама и Папалекси по выяснению движения электрона
- •Практическое применение электролиза
- •Электрический Ток в Полупроводниках
- •Магнитное Поле
- •Магнитное Поле
- •[Править]Источники магнитного поля
- •[Править]Вычисление
- •[Править]Проявление магнитного поля
- •[Править]Взаимодействие двух магнитов
- •[Править]Явление электромагнитной индукции
Мощность
Мощностью N называют величину, равную отношению работы А к промежутку времени t, в течение которого эта работа была совершена:
N=A/t (3.11)
Из формулы (3.11) следует, что в СИ единицей мощности яв-ляется 1 Дж/с (джоуль в секунду). Эту единицу иначе называют ватт (Вт), 1 Вт= 1 Дж/с.
Связь между мощностью и скоростью при равномерном движении найдем, подставив (3.10) в (3.11):
N=Fvcosa.
(Эта формула справедлива и для переменного движения, если под N понимать мгновенную мощность, а под V - мгновенную скорость). Если направление силы совпадает с направлением перемещения, то cosa=1 и N=Fv. Из последней формулы следует, что
F=N/v и v=N/F.
Из этих формул видно, что при постоянной мощности двигателя скорость движения обратно пропорциональна силе тяги и наоборот. На этом основан принцип действия коробки скоростей (коробки перемены передач) различных транспортных средств.
17 билет
Работа
и изменение скорости тела. Установим
связь между работой постоянной силы и
изменением скорости тела. Рассмотрим
случай, когда на тело массой mдействует
постоянная сила ![]() (она
может быть равнодействующей нескольких
сил) и векторы силы
(она
может быть равнодействующей нескольких
сил) и векторы силы ![]() и
перемещения
и
перемещения ![]() направлены
вдоль одной прямой в одну сторону. В
этом случае работу силы можно определить
как
направлены
вдоль одной прямой в одну сторону. В
этом случае работу силы можно определить
как ![]() .
Модуль силы по второму закону Ньютона
равен
.
Модуль силы по второму закону Ньютона
равен ![]() ,
а модуль перемещения
,
а модуль перемещения ![]() при
равноускоренном прямолинейном движении
связан с модулями начальной
при
равноускоренном прямолинейном движении
связан с модулями начальной ![]() и
и ![]() конечной
скорости и ускорения
конечной
скорости и ускорения ![]() выражением
выражением
![]() .
.
Отсюда для работы получаем
![]() .
(19.1)
.
(19.1)
Кинетическая энергия. Физическая величина, равная половине произведения массы тела на квадрат его скорости, называется кинетической энергией тела.
Кинетическая энергия тела обозначается буквой Eк:
![]() .
(19.2)
.
(19.2)
Тогда равенство (19.1) можно записать в таком виде:
![]() .
(19.3)
.
(19.3)
Работа равнодействующей сил, приложенных к телу, равна изменению кинетической энергии тела. Это утверждение называют теоремой о кинетической энергии.
Так как изменение кинетической энергии равно работе силы (19.3), кинетическая энергия выражается в тех же единицах, что и работа, т. е. в джоулях.
Если
начальная скорость движения тела
массой m равна
нулю и тело увеличивает свою скорость
до значения ![]() ,
то работа силы равна конечному значению
кинетической энергии тела:
,
то работа силы равна конечному значению
кинетической энергии тела:
![]() .
(19.4)
.
(19.4)
Кинетическая
энергия тела массой m,
движущегося со скоростью ![]() ,
равна работе, которую должна совершить
сила, действующая на покоящееся тело,
чтобы сообщить ему эту скорость.
,
равна работе, которую должна совершить
сила, действующая на покоящееся тело,
чтобы сообщить ему эту скорость.
18 билет
Энергия - это способность совершить работу. Кинетическая - за счет движения. Например - всадится машина в столб и совершит работу по разборке на запчасти:) и нагреву. Потенциальная - способность совершить работу за счет любых других свойств тела. Например - подвесили гирю на веревке под потолок - если отпустить она может совершить работу, подняв что-то вверх. Или дрова могут совершить работу по нагреву котелка за счет того, что в них углерод неокисленный, а может окислиться. То же машина - она может сжечь свой бензин из бака и разогнаться. Возможность совершить какую-от работу за счет своиз внутренних резервов или своего положения по отношению к другим телам ("на веревочке под потолком") - потенциальная энергия.
19 билет
Закон сохранения энергии — результат обобщения многих экспериментальных данных. Идея этого закона принадлежит М.В.Ломоносову (1711 — 1765), изложившему закон сохранения материи и движения, а количественная формулировка закона сохранения энергии дана немецким врачом Ю. Майером (1814 — 1878) и немецким естествоиспытателем Г. Гельмгольцем (1821 — 1894).
Рассмотрим систему материальных точек массами m1, m2, ..., mn,движущихся со скоростями v1, v2, …,vn. Пусть F`1, F`2 , …, F`n,равнодействующие внутренних консервативных сил, действующих на каждую из этих точек, a F1 F2, ..., Fn — равнодействующие внешних сил, которые также будем считать консервативными. Кроме того, будем считать, что на материальные точки действуют еще и внешние неконсервативные силы; равнодействующие этих сил, действующих на каждую из материальных точек, обозначим f1, f2, ..., in. При v <<c массы материальных точек постоянны и уравнения второго закона Ньютона для этих точек следующие:
![]() ,
,
![]() ,
,
………………………..
![]()
Двигаясь под действием сил, точки системы за интервал времени dtсовершают перемещения, соответственно равные dr1, dr2, ..., drn. Умножим каждое из уравнений скалярно на соответствующее перемещение и, учитывая, что dr1 = v1 dt, получим:
m1(v1 dv1) - (F'1 + F1) drl = f1 dr1,
m2(v2 dv2) - (F'2 + F2) dr2 = f2dr2,
. . . . . . . . . . . .
mn(vn dvn) - (F'n + Fn) drn= fn drn,
Сложив эти уравнения, получим

Первый член левой части равенства
![]()
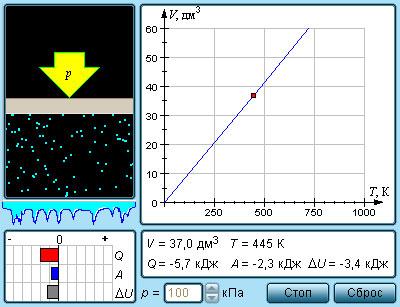
где dW есть приращение кинетической энергии системы. Второй член у (F'i+Fi)dri равен элементарной работе внутренних и внешних консервативных сил, взятой со знаком минус, т. е. равен элементарному приращению потенциальной энергии dU системы.
Правая часть равенства
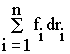
задает работу внешних неконсервативных сил, действующих на систему. Таким образом, имеем
d(W+U)=dA
При переходе системы из состояния 1 в какое-либо состояние 2
![]()
т. е. изменение полной механической энергии системы при переходе из одного состояния в другое равно работе, совершенной при этом внешними неконсервативными силами. Если внешние неконсервативные силы отсутствуют, то из (13.2) следует, что
d(W+U) = 0
откуда
W +U = E =const
т. е. полная механическая энергия системы сохраняется постоянной. Полученное выражение представляет собой закон сохранения механической энергии: в системе тел, между которыми действуют только консервативные силы, полная механическая энергия сохраняется, т. е. не изменяется со временем.
Механические системы, на тела которых действуют только консервативные силы (внутренние и внешние), называютсяконсервативными системами. Закон сохранения механической энергии можно сформулировать так: в консервативных системах полная механическая энергия сохраняется.
Модель: упругий удар.
Закон сохранения механической энергии связан с однородностью времени,т. е. инвариантностью физических законов относительно выбора начала отсчета времени. Например, при свободном падении тела в поле сил тяжести его скорость и пройденный путь зависят лишь от начальной скорости и продолжительности свободного падения тела и не зависят от того, когда тело начало падать.
Существует еще один вид систем — диссипативные системы, в которых механическая энергия постепенно уменьшается за счет преобразования в другие (немеханические) формы энергии. Этот процесс получил названиедиссипации (или рассеяния) энергии. Строго говоря, все системы в природе являются диссипативными.
В консервативных системах полная механическая энергия остается постоянной. Могут происходить лишь превращения кинетической энергии в потенциальную и обратно в эквивалентных количествах, так что полная энергия остается неизменной. Поэтому, как указывает Ф. Энгельс, этот закон не есть просто закон количественного сохранения энергии, а закон сохранения и превращения энергии, выражающий и качественную сторону взаимного превращения различных форм движения друг в друга. Закон сохранения и превращения энергии — фундаментальный закон природы,он справедлив как для систем макроскопических тел, так и для систем микротел.
В системе, в которой действуют также неконсервативные силы, например силы трения, полная механическая энергия системы не сохраняется. Следовательно, в этих случаях закон сохранения механической энергии несправедлив. Однако при «исчезновении» механической энергии всегда возникает эквивалентное количество энергии другого вида. Таким образом, энергия никогда не исчезает и не появляется вновь, она лишь превращается из одного вида в другой. В этом и заключается физическая сущность закона сохранения и превращения энергии — сущность неуничтожимости материи и ее движения.
20 билет
теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
все тела состоят из частиц: атомов, молекул и ионов;
частицы находятся в непрерывном хаотическом движении (тепловом);
частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Основными доказательствами этих положений считались:
Диффузия
Броуновское движение
Изменение агрегатных состояний вещества
В современной (теоретической) физике термин молекулярно-кинетическая теория уже не используется, хотя он встречается в учебниках по курсу общей физики. В современной физике МКТ заменила кинетическая теория, в русскоязычной литературе —физическая кинетика, и статистическая механика. В этих разделах физики изучаются не только молекулярные (атомные или ионные) системы, находящиеся не только в «тепловом» движении, и взаимодействующие не только через абсолютно упругие столкновения.
21 билет
Соотношение
|
p = nkT, |
связывающее давление газа с его температурой и концентрацией молекул, получено в §3.2 для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
|
|
Здесь N – число молекул в сосуде, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
|
|
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть:
|
R = 8,31 Дж/моль·К. |
Соотношение
|
|
|
(*) |
называется уравнением состояния идеального газа.
Для одного моля любого газа это соотношение принимает вид:
|
Если температура газа равна Tн = 273,15 К (0 °С), а давлениеpн = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V0, равный
|
V0 = 0,0224 м3/моль = 22,4 дм3/моль. |
Это утверждение называется законом Авогадро.
Для смеси невзаимодействующих газов уравнение состояния принимает вид
|
где ν1, ν2, ν3 и т. д. – количество вещества каждого из газов в смеси.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном, в форме (*) оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.
Следует отметить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально. Поэтому уравнение (*) можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний(например, в координатах p, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров (p,V или T) остается неизменным. Такие процессы называютсяизопроцессами.
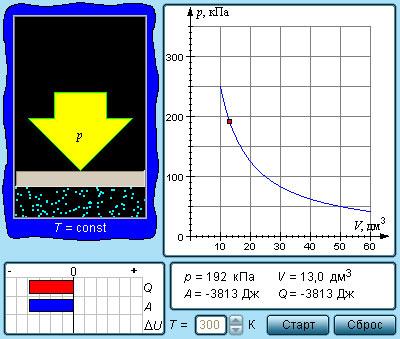
Изотермический процесс (T = const)
Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T. Из уравнения (*)состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
|
![]()
|
|
|
Модель. Изотермический процесс |
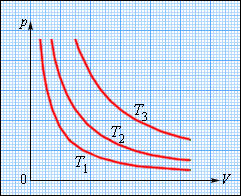
На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гиперболp ~ 1 / V, которые называются изотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 3.3.1). Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
|
|
|
Рисунок 3.3.1. Семейство изотерм на плоскости (p, V).T3 > T2 > T1 |
Изохорный процесс (V = const)
Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным.
Как следует из уравнения (*) состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или
|
![]()
|
|
|
Модель. Изохорный процесс |
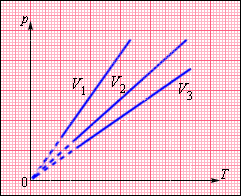
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 3.3.2).
|
|
|
Рисунок 3.3.2. Семейство изохор на плоскости (p, T).V3 > V2 > V1 |
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля.
Уравнение изохорного процесса может быть записано в виде:
|
где p0 – давление газа при T = T0 = 273,15 К (т. е. при температуре0 °С). Коэффициент α, равный (1/273,15) К–1, называюттемпературным коэффициентом давления.
Изобарный процесс (p = const)
Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p.
Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид:
|
где V0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273,15) К–1. Его называют температурным коэффициентом объемного расширения газов.
![]()
|
|
|
Модель. Изобарный процесс |
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 3.3.3), которые называются изобарами.
|
|
|
Рисунок 3.3.3. Семейство изобар на плоскости (V, T).p3 > p2 > p1 |
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
Экспериментально установленные законы Бойля–Мариотта, Шарля и Гей-Люссака находят объяснение в молекулярно-кинетической теории газов. Они являются следствием уравнения состояния идеального газа.
22 билет
Моделируется процесс изобарного сжатия и расширения идеального газа. Возможен выбор величины внешнего давления. Текущие значения параметров газа выводятся на экран. Состояние газа указывается на графике в координатах (V, T).
Изобарный процесс – это процесс квазистатического расширения или сжатия вещества (в данном случае идеального газа) при постоянном давлении P. На плоскости (V, T) изобариные процессы при разных значениях давления P изображаются семейством прямых линий V~T (закон Гей-Люссака). Для одного моля идеального газа
|
|
|
|
где R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная.
Работа газа при изобарном расширении или сжатии выражается соотношением
|
|
A = P (V2 – V1) = P ΔV. |
|
Первый закон термодинамики для изобарного процесса записывается в виде
|
|
Q = U(T2) – U(T1) + P(V2 – V1) = ΔU + PΔV. |
|
Здесь U (T1) и U (T2) – внутренняя энергия газа в начальном и конечном состояниях, V1 и V2 – начальный и конечный объемы. При изобарном расширении Q > 0 – тепло поглощается, и газ совершает положительную работу. При изобарном сжатии Q > 0 – тепло отдается внешним телам. В этом случае A < 0.
В модели можно выбирать давление газа и проводить процесс при выбранном давлении. Приводится график зависимости V (T) для изобарного процесса, выводится энергетическая диаграмма, на которой указываются количество теплоты Q, полученной газом, произведенная работа A и изменение ΔU его внутренней энергии.
При помощи энергетической диаграммы вы также можете убедиться, что при изобарном расширении внутренняя энергия газа увеличивается (при этом его температура растет), и газ совершает положительную работу. При изобарном сжатии температура и внутренняя энергия уменьшаются, работа газа отрицательна. Также из диаграммы видно, что при расширении газ поглощает тепло, а при сжатии – отдает окружающим телам.
23 билет
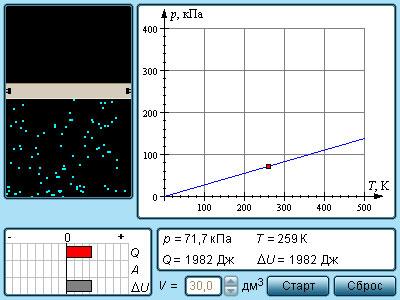
Моделируется процесс изохорного нагревания и охлаждения идеального газа. Текущие значения параметров газа выводятся на экран. Состояние газа указывается на графике в координатах (P, T).
Изохорный процесс – это процесс квазистатического нагревания или охлаждения вещества (в данном случае идеального газа) при постоянном объеме V. На плоскости (P, T) изохорные процессы при разных значениях объема V изображаются семейством прямых линий P ~ T (закон Шарля). Для одного моля идеального газа
|
|
|
|
где R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная.
В изохорном процессе газ не совершает работы:
|
|
A = 0. |
|
Первый закон термодинамики для изохорного процесса записывается в виде
|
|
Q = U(T2) – U(T1) = ΔU. |
|
Здесь U(T1) и U(T2) – внутренняя энергия газа в начальном и конечном состояниях.
При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0); внутренняя энергия газа уменьшается.
В модели можно выбирать объем газа и проводить процесс при разных объемах газа.
Приведен график зависимости P(T) для изохорного процесса, выводится энергетическая диаграмма, на которой указываются количество теплоты Q, полученной газом, произведенная газом работа A и изменение ΔU его внутренней энергии.
Из энергетической диаграммы видно, что при изохорном процессе работа газа равна нулю, и все полученное тепло затрачивается на изменение внутренней энергии газа.
24 билет