
Значення ізобарної, їзохорної теплоємностей та показника адіабати
|
Атомність газу |
Мольна теплоємність, (кДж/кмольК) |
| |
|
|
| ||
|
Одноатомний |
20,8 |
12,5 |
1,67 |
|
Двохатомний |
29,1 |
20,8 |
1,40 |
|
Трьох- та багатоатомний |
37,7 |
29,3 |
1,29 |
Перший закон термодинаміки. В термодинамічному процесі кількість теплоти Q, яка підведена до системи, витрачається на зміну внутрішньої енергії U і на виконання зовнішньої роботи L:
Q=U + L. (1.42)
Для 1 кг речовини:
![]() .
(1.43)
.
(1.43)
![]() .
(1.44)
.
(1.44)
Рівняння першого закону термодинаміки можна представити у вигляді схеми енергобалансу в термодинамічному процесі (рис.1.7).
Для кругового процесу 1-й закон:
![]() .
(1.45)
.
(1.45)
Перша форма запису 1-го закону:
![]() або
або
![]() . (1.46)
. (1.46)
Проведемо перетворення:
![]() ;
(1.47)
;
(1.47)
![]() ;
(1.48)
;
(1.48)
![]() .
(1.49)
.
(1.49)
Підставивши
значення
![]() в рівняння першої форми, отримаємо другу
форму запису 1-го закону:
в рівняння першої форми, отримаємо другу
форму запису 1-го закону:
![]() або
або
![]() . (1.50)
. (1.50)
Якщо
об’єднати першу, другу форми запису і
рівняння
![]() ,
знайдемо основне рівняння термодинаміки
або термодинамічна тотожність:
,
знайдемо основне рівняння термодинаміки
або термодинамічна тотожність:
![]() .
(1.51)
.
(1.51)
Для необоротних процесів:
![]() або
або
![]() .
(1.52)
.
(1.52)
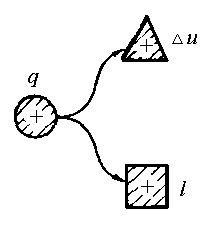
Рис.1.7. Схема енергобалансу в термодинамічному процесі.
Другий закон термодинаміки. Перетворення теплоти в роботу без компенсації (наприклад, розширення робочого тіла в розімкненому процесі або переходу тепла від менш нагрітого до більш нагрітого) неможливе.
Для
отримання роботи з теплоти потрібне
періодичне повторення процесу розширення
1
m
2 (рис.1.8,а), тобто повернення робочого
тіла в початковий стан в процесі стикання
2
n
1 з витратою деякої роботи
![]() .
Якщо робота розширення
.
Якщо робота розширення![]() більше роботи стискання
більше роботи стискання![]() ,
то в результаті обох процесів отримується
корисна робота
,
то в результаті обох процесів отримується
корисна робота![]() .
Процес розширення робочого тіла з
підведенням теплоти
.
Процес розширення робочого тіла з
підведенням теплоти![]() буде супроводжуватися збільшенням
ентропії, а процес повернення в початковий
стан за годинниковою стрілкою –
зменшенням ентропії, тобто відведенням
теплоти
буде супроводжуватися збільшенням
ентропії, а процес повернення в початковий
стан за годинниковою стрілкою –
зменшенням ентропії, тобто відведенням
теплоти![]() .
Лише частина теплоти
.
Лише частина теплоти![]() витрачається корисно і використовується
для отримання роботи
витрачається корисно і використовується
для отримання роботи![]() .
Відношення теплоти, перетвореної в
роботу, до теплоти, підведеної до робочого
тіла, називаєтьсятермічним
коефіцієнтом корисної дії:
.
Відношення теплоти, перетвореної в
роботу, до теплоти, підведеної до робочого
тіла, називаєтьсятермічним
коефіцієнтом корисної дії:
![]() .
(1.53)
.
(1.53)
Для
необоротних процесів частина роботи
перетворюється на теплоту тертя
![]() і зміна ентропії дорівнює:
і зміна ентропії дорівнює:
![]() (принцип
зростання ентропії). (1.54)
(принцип
зростання ентропії). (1.54)
Отже, для будь-якого процесу:
![]() ,
або
,
або
![]() .
(1.55)
.
(1.55)
В адіабатній ізольованій системі:
![]() .
(1.56)
.
(1.56)
Якщо
в системі є два тіла з різними температурами
![]() ,
то елемнетарна зміна ентропії першого
тіла складе
,
то елемнетарна зміна ентропії першого
тіла складе![]() ,
другого
,
другого![]() ,
а системи двох тіл:
,
а системи двох тіл: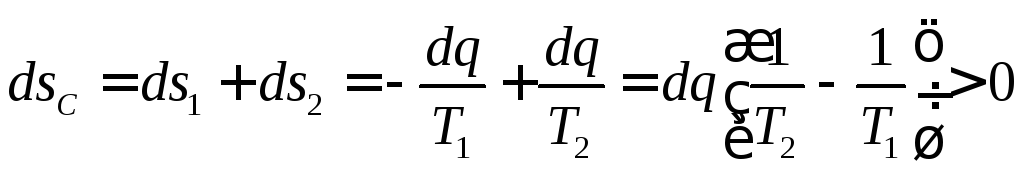 .
(1.57)
.
(1.57)
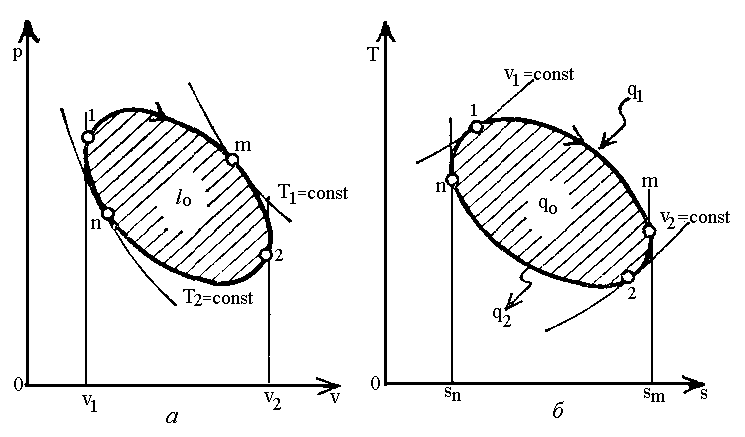
Рис.1.8. Діаграма кругового процесу теплового двигуна.
Лекція2. Термодинамічні процеси з ідеальними газами
Задачі аналізу і загальні аналітичні залежності. Задачами аналізу є встановлення закономірностей зміни параметрів стану робочого тіла і виявлення особливостей перетворення енергії.
Враховуючи,
що в ізохорному процесі
![]() і робота
і робота![]() ,
вираз першого закону термодинаміки
набуває вигляду:
,
вираз першого закону термодинаміки
набуває вигляду:
![]() .
(2.1)
.
(2.1)
Кількість теплоти можна виразити через середню теплоємність:
![]() .
(2.2)
.
(2.2)
З (2.1) і (2.2) випливає:
![]() ,
або в диференціальній формі
,
або в диференціальній формі
![]() .
(2.3)
.
(2.3)
З виразу першого закону термодинаміки для ізобарного процесу випливає:
![]() ,
або
,
або
![]() .
(2.4)
.
(2.4)
Кількість теплоти, виражена через середню теплоємність:
![]() або
в диференціальній формі
або
в диференціальній формі
![]() .
(2.5)
.
(2.5)
Тоді:
![]() або
або
![]() .
(2.6)
.
(2.6)
В диференціальній формі:
![]() .
(2.7)
.
(2.7)
Для розрахунку зміни питомої ентропії в політропному процесі використовуємо об'єднаний вираз 1-го і 2-го законів термодинаміки для оборотних процесів:
![]() або
або
![]() .
(2.8)
.
(2.8)
![]() або
або
![]() .
(2.9)
.
(2.9)
Замінивши
в цих виразах
![]() і
і![]() ,
і враховуючи, що
,
і враховуючи, що![]() ;
;![]() ,
отримаємо:
,
отримаємо:
![]() ;
(2.10)
;
(2.10)
![]() .
(2.11)
.
(2.11)
Після інтегрування для кінцевого процесу 1-2 маємо:
![]() .
(2.12)
.
(2.12)
![]() .
(2.13)
.
(2.13)
Ізохорний
процес
(![]() ).
Процес може протікати з підвищенням
(
).
Процес може протікати з підвищенням
(![]() )
або зниженням (
)
або зниженням (![]() )
тиску (рис. 2.1).
)
тиску (рис. 2.1).
Р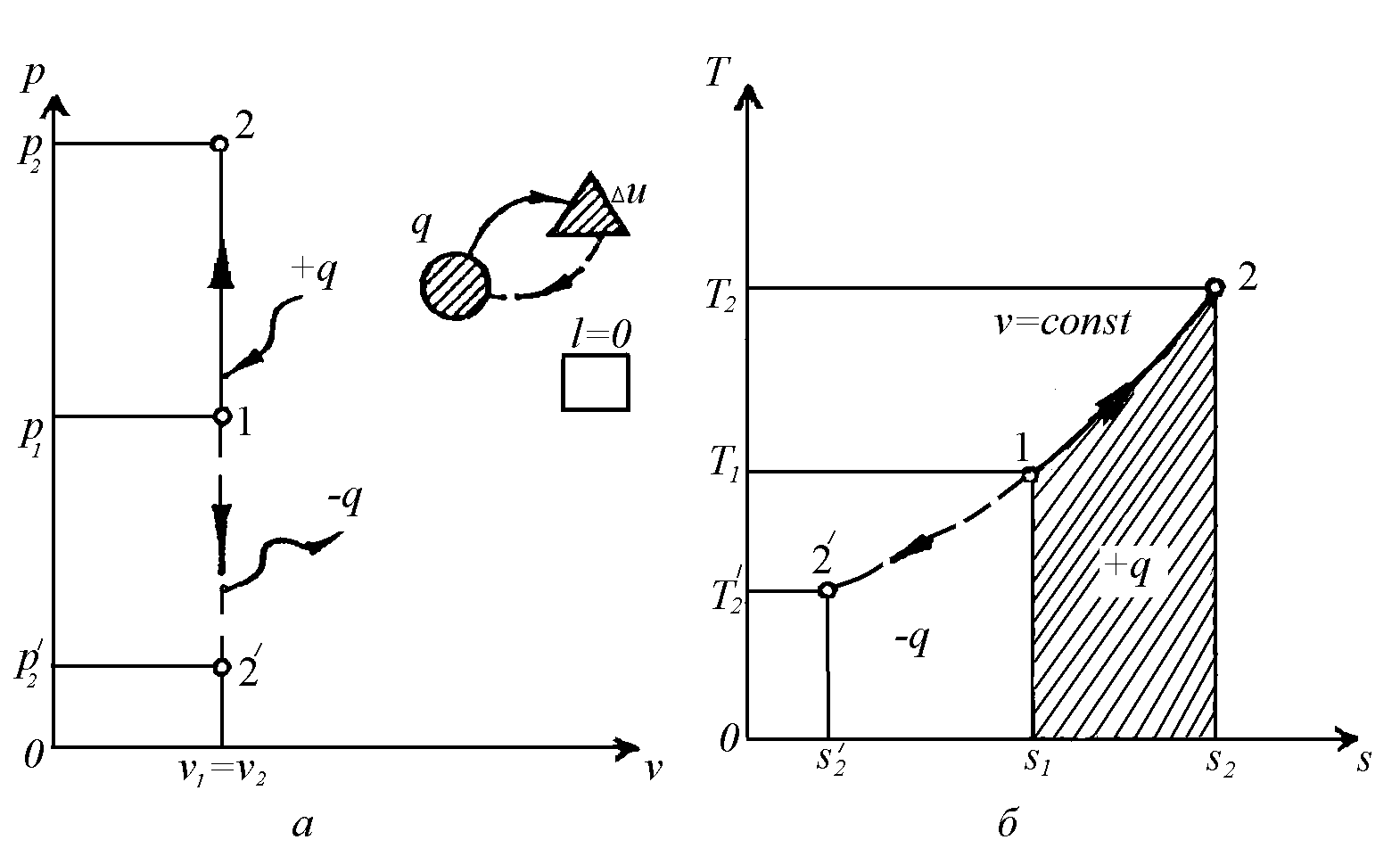 ис.
2.1. Графіки ізохорного процесу.
ис.
2.1. Графіки ізохорного процесу.
З рівняння стану ідеального газу випливає закон Шарля:
![]() ;
;
![]() ;
;![]() .
(2.14)
.
(2.14)
Оскільки
![]() ,
то з рівняння 1-го закону термодинаміки
випливає, що:
,
то з рівняння 1-го закону термодинаміки
випливає, що:
![]() .
(2.15)
.
(2.15)
Зміна
ентропії, згідно з (2.12) при
![]() :
:
![]() .
або, згідно з (2.14),
.
або, згідно з (2.14),
![]() .
(2.16)
.
(2.16)
Оскільки
![]() ,
то доля теплоти, яка йде на зміну
внутрішньої енергії:
,
то доля теплоти, яка йде на зміну
внутрішньої енергії:
![]() .
(2.17)
.
(2.17)
Оскільки
![]() ,
то робота в цьому процесі дорівнює нулю:
,
то робота в цьому процесі дорівнює нулю: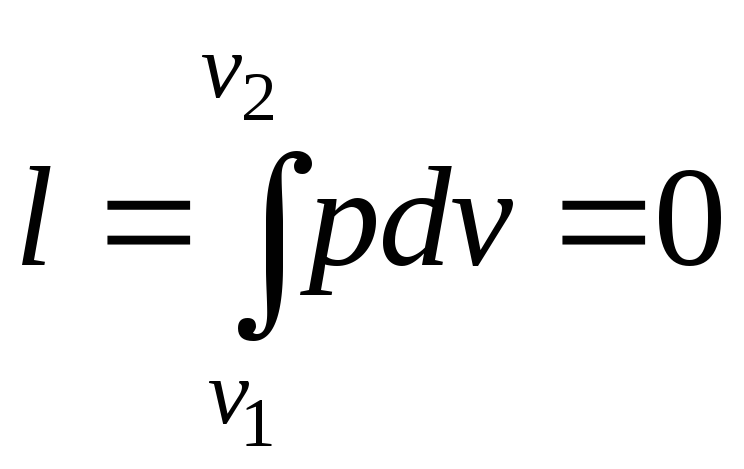 .
.
Таким чином, підведена до газу в ізохорному процесі теплота цілком йде на збільшення його внутрішньої енергії.
Ізобарний
процес
(![]() ).
З рівняння стану ідеального газу при
).
З рівняння стану ідеального газу при![]() (рис.
2.2) випливає закон Гей-Люссака:
(рис.
2.2) випливає закон Гей-Люссака:
![]() ;
;
![]() ;
;![]() .
(2.18)
.
(2.18)

Рис.2.2. Графіки ізобарного процесу.
Робота в процесі:
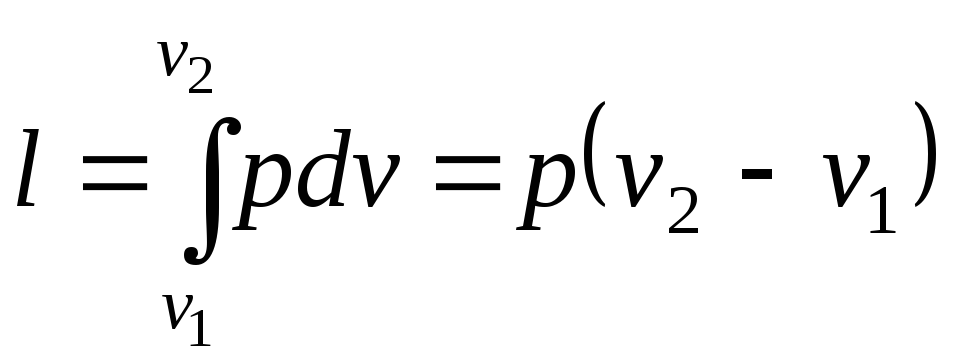 .
(2.19)
.
(2.19)
Оскільки
для ідеального газу
![]() ,
то:
,
то:
![]() .
(2.20)
.
(2.20)
Отже, питома газова стала R – це робота, яка виконується 1кг газу в процесі p=const при його нагріванні на один градус. Розмірність R: Дж/кгК.
Кількість
теплоти в цьому випадку, при
![]() ,
згідно другої форми запису рівняння
першого закону
,
згідно другої форми запису рівняння
першого закону![]() :
:
![]() .
(2.21)
.
(2.21)
Таким чином, уся теплота, підведена до газу в ізобарному процесі, витрачається на збільшення його ентальпії.
Ця теплота для ідеальго газу дорівнює:
![]() .
(2.22)
.
(2.22)
Зміна
ентропії, згідно з (2.13) при
![]() :
:
![]() ,
або, згідно з (2.18)
,
або, згідно з (2.18)
![]() .
(2.23)
.
(2.23)
Оскільки
![]() ,
то ізобара в
,
то ізобара в![]() координатах більш полога логарифмічна
крива, ніж ізохора.
координатах більш полога логарифмічна
крива, ніж ізохора.
Коефіцієнт розподілу теплоти в процесі дорівнює:
![]() ,
,
![]() .
(2.24)
.
(2.24)
Ізотермний
процес
(![]() ).
З рівняння стану ідеального газу при
).
З рівняння стану ідеального газу при![]() (рис. 2.3) витікає закон Бойля-Маріотта:
(рис. 2.3) витікає закон Бойля-Маріотта:
![]()
 ;
;
![]() ;
;![]() ;
;![]() (2.25)
(2.25)
Рис.2.3. Графіки ізотермного процесу.
Зміна
внутрішньої енергії і ентальпії
![]() і
і![]() ,
оскільки
,
оскільки![]() .
Отже, вся теплота, яка підводиться,
витрачається на роботу:
.
Отже, вся теплота, яка підводиться,
витрачається на роботу:
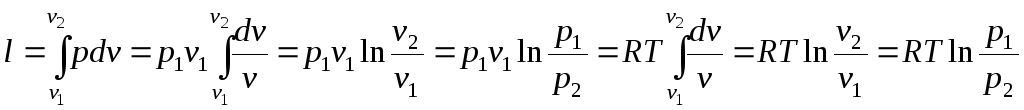 .
(2.26)
.
(2.26)
Теплота, необхідна для здійснення процесу:
![]() .
(2.27)
.
(2.27)
З виразів (2.26), (2.27) і (2.25) отримаємо:
![]() .
(2.28)
.
(2.28)
Доля теплоти, яка витрачається на зміну внутрішньої енергії:
![]() .
(2.29)
.
(2.29)
А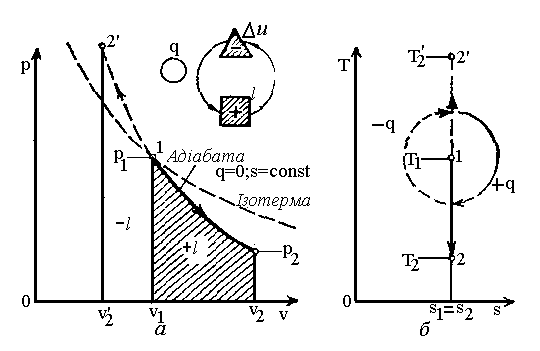 діабатний
процес
(
діабатний
процес
(![]() ;
;![]() )
– це процес, що протікає без зовнішнього
теплообміну (рис. 2.4).
)
– це процес, що протікає без зовнішнього
теплообміну (рис. 2.4).
Рис.2.4. Графіки адібатного процесу.
Якщо записати для цього випадку рівняння 1-го закону термодинаміки у вигляді:
![]() чи
чи
![]() ,
(2.30)
,
(2.30)
![]() чи
чи
![]() ,
(2.31)
,
(2.31)
то після ділення (2.30) на (2.31) одержимо:
![]() -
показник адіабати. (2.32)
-
показник адіабати. (2.32)
Тоді
після інтегрування виразу
![]() для кінцевого процесу 1-2 будемо мати:
для кінцевого процесу 1-2 будемо мати:
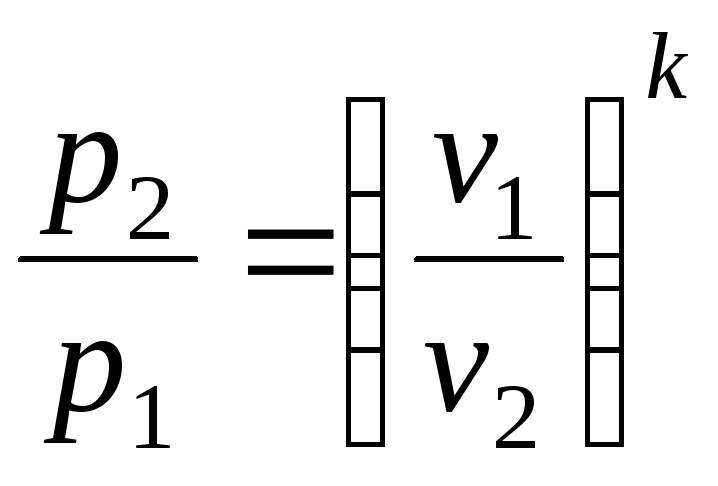 ,
чи
,
чи
![]() .
(2.33)
.
(2.33)
Співвідношення між параметрами стану для двох точок в цьому процесі:
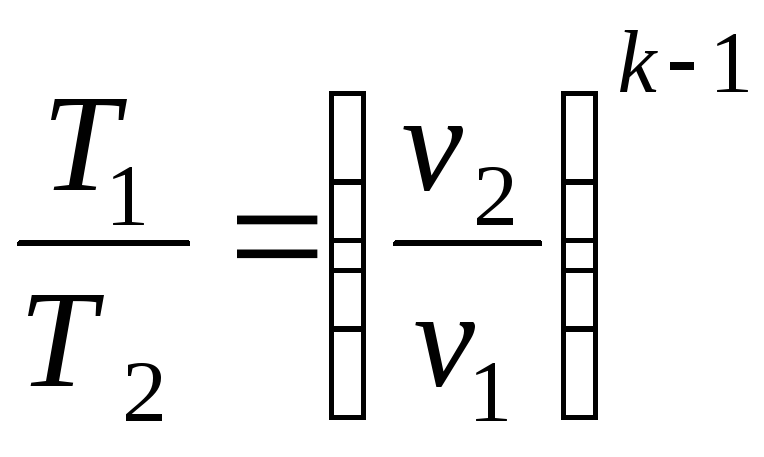 і
і
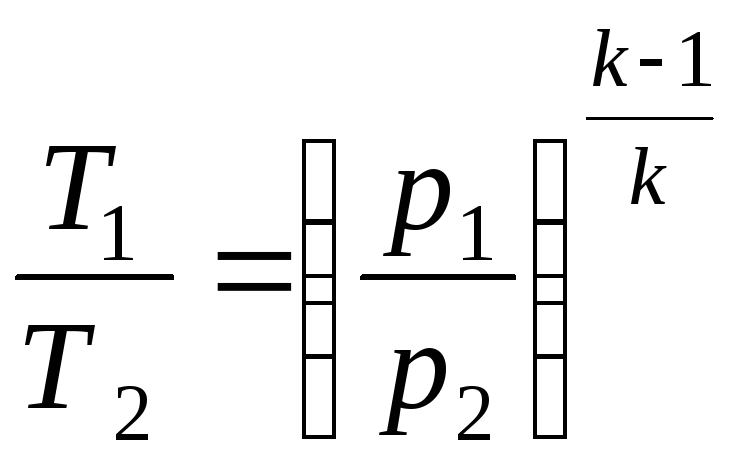 .
(2.34)
.
(2.34)
З
рівняння 1-го закону термодинаміки
випливає, що
![]() ,
тобто:
,
тобто:
![]() ,
або
,
або
![]() .
(2.35)
.
(2.35)
