
- •-Пути поступления аминокислот
- •Белки – незаменимые высокомолекулярные соединения в организме человека, они содержат азот и не
- •Основные функции белков
- •Белок в организме не депонируется. При его дефиците мобилизуются белки мышц, кожи, костей,
- •Азотистый баланс
- •Азотистый баланс
- •Биологическая ценность белков определяется их аминокислотным составом
- •Метионин обеспечивает дезинтоксикационные процессы, прежде всего по связыванию тяжелых металлов, эндогенных и экзогенных
- •Триптофан необходим для производства витамина B3 (ниацина) и серотонина-важнейшего нейромедиатора, передающего нервные импульсы.
- •Заменимые аминокислоты
- •Глицин (аминоуксусная кислота) является центральным нейромедиатором
- •Цистеин - серосодержащая аминокислота играет важную роль в
- •Пути обмена белков в организме
- •Промежуточный обмен аминокислот
- •Механизм всасывания аминокислот в кишечнике
- •Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортньгх систем, обеспечивающих
- •Одна из специфических транспортных систем для некоторых
- •γ-Глутамильный цикл: Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты
- •Аминокислоты как и белки не накапливаются и не запасаются в тканях
- •Общие пути обмена АК
- •Трансаминирование - реакция переноса а-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются
- •Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариотов. Причём митохондриальные
- •Органоспецифичные аминотрансферазы АЛТ и АСТ
- •Аминотрансферазы обладают субстратной
- •АЛТ катализирует реакцию трансами-нирования между
- •. Биологическое значение трансаминирования
- •Биологическое значение реакций трансаминирования
- •Диагностическое значение определения аминотрансфераз в клинической практике
- •ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
- •Окислительное дезаминирование
- •Непрямое дезаминирование (трансдезаминирование)
- •Биологическая роль непрямого дезаминирования.
- •Неокислительное дезаминирование
- •Пути обмена безазотистого остатка аминокислот
- •При недостатке глюкозы в организме фос- фоенолпируват включается в глюконеогенез (см. раздел 7).
- •ГЛИКОГЕННЫЕ И КЕТОГЕННЫЕ АМИНОКИСЛОТЫ
- •Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат или ацетил-КоА и могут использоваться
- •Классификация аминокислот по судьбе безазотистого ост
- •Включение безазотистого остатка аминокислот в общий путь кат
- •Пути биосинтеза заменимых аминокислот
- •Декарбоксилирование
- •Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных
- •Синтез и биологическая роль серотонина
- •Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры,
- •Синтез и биологическая роль ацетилхолина
- •Внервных клетках
- •Предшественники и биологическая роль некоторых биогенных аминов
- •Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в
- •Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование
- •Пять путей обезвреживания аммиака
- •Основной путь обезвреживания аммиака в организме – биосинтез мочевины в печени.
- •Орнитиновый цикл
- •2-я реакция и 3 реакции
- •4-й этап
- •5-я реакция
- •Энергетический баланс процесса
- •Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата,
- •Биологическое значение орнитинового цикла
- •Источники азота , углерода и кислорода в цикле мочевины
- •Гипераммониемия – повышение концентрации аммиака в крови.
- •Спасибо за внимание!

Глицин (аминоуксусная кислота) является центральным нейромедиатором |
|||
тормозного типа действия, оказывает седативное действие, улучшает |
|||
метаболические процессы в тканях мозга, ослабляет влечение к алкоголю, |
|||
оказывает положительное влияние при мышечных дистрофиях, уменьшает |
|||
повышенную |
раздражительность, |
нормализует |
сон. |
Глутаминовая кислота (глутамин) обладает уникальным свойством |
|||||
присоединять дополнительный атом азота, тем самым, являясь организатором |
|||||
синтеза различных белков (перенос азота), либо связывая избыток азота (в том |
|||||
числе аммиак), который может вызывать нарушение работы различных органов, |
|||||
но, |
прежде |
всего |
мозга |
и |
печени. |
В центральной нервной системе глутаминовая кислота является возбуждающим |
|||||
нейромедиатором. Глутаминовая кислота является важной составляющей |
|||||
мышечной |
ткани, |
воздействует |
на |
гормон |
роста. |
Пролин участвует в синтезе коллагена, восстанавливает структуру соединительной ткани (в том числе опорно-двигательного аппарата, паренхиматозных органов, сердца). Тирозин является предшественником нейромедиаторов норадреналина и дофамина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина и улучшает функции надпочечников, щитовидной железы и гипофиза. Симптомами дефицита тирозина также являются пониженное артериальное давление, низкая температура тела и синдром беспокойных ног. Тирозин может синтезироваться из фенилаланина в организме человека.

Цистеин - серосодержащая аминокислота играет важную роль в |
||||
процессах формирования тканей кожи. Имеет значение для |
||||
дезинтоксикационных процессов. Цистеин входит в состав |
||||
альфа-керотина, основного белка ногтей, кожи и волос. Он |
||||
способствует |
формированию |
коллагена |
и |
улучшает |
эластичность кожи. Цистеин входит в состав и других белков |
||||
организма, в том числе некоторых пищеварительных |
||||
ферментов. |
|
|
|
|
Цистеин помогает обезвреживать некоторые токсические |
||||
вещества и защищает организм от повреждающего действия |
||||
радиации. Он представляет собой один из самых мощных |
||||
антиоксидантов. |
|
|
|
|
Цистеин является предшественником глютатиона - вещества, |
||||
оказывающего защитное действие на клетки печени и головного |
||||
мозга от повреждения алкоголем, некоторых лекарственных |
||||
препаратов и токсических веществ, в том числе содержащихся в |
||||
сигаретном |
|
|
|
дыме. |
Эта аминокислота образуется в организме из метионина, при |
|||
обязательном |
присутствии |
витамина |
B6. |

Пути обмена белков в организме
Переваривание и всасывание - белки лишаются своей видовой и тканевой специфичности и распадаются до аминокислот
Промежуточный (межуточный) обмен – в клетках печени и всех тканей, включающий процессы переаминирования, дезаминирования, восстановительного аминирования, декарбоксилирования, биосинтеза заменимых аминокислот и др.
Образование и выведение из организма конечных продуктов распада белков

Промежуточный обмен аминокислот
Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30- 50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L- аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь . Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Na+- зависимых механизмов симпорта, подобно переносу глюкозы.
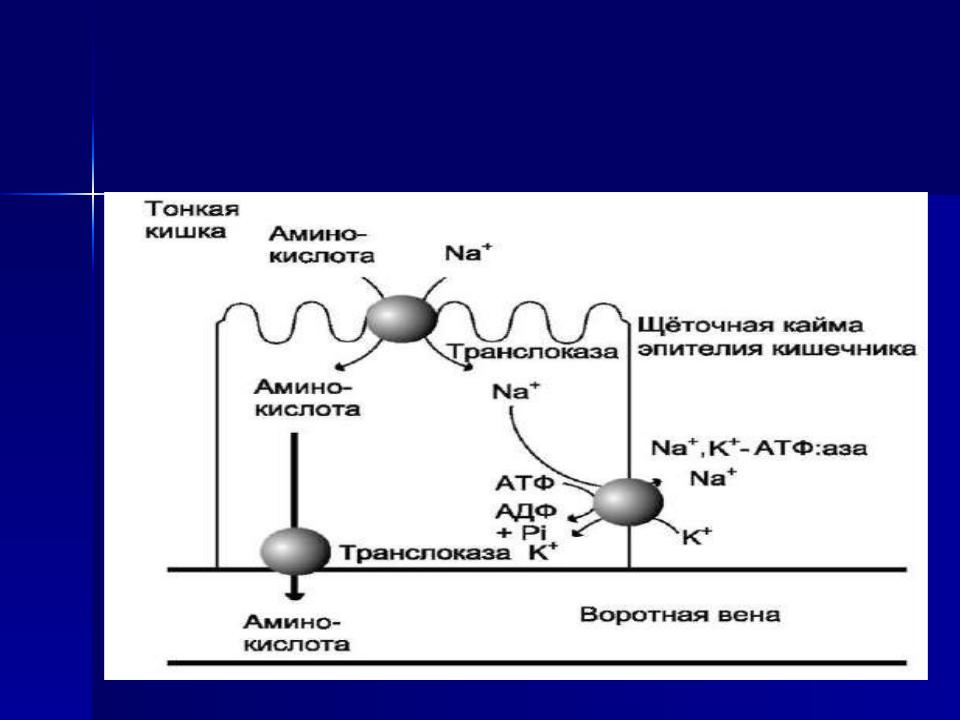
Механизм всасывания аминокислот в кишечнике

L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первичного активного транспорта с помощью Na+, К+-АТФ-азы.

Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортньгх систем, обеспечивающих перенос аминокислот как через внешнюю плазматическую мембрану, так и через внутриклеточные мембраны. В настоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот:
•нейтральных, с короткой боковой цепью (аланин, серин, треонин);
•нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолей-цин);
•с катионными радикалами (лизин, аргинин);
•с анионными радикалами (глутаминовая и аспарагиновая кислоты);
•иминокислот (пролин, оксипролин). Причём к числу Na+- зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин).

Одна из специфических транспортных систем для некоторых
нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге. Это γ-глутамильный цикл.

γ-Глутамильный цикл: Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ- глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты.
E1 - γ-глутамилтрансфераза; E2 - γ- глутамилциклотрансфераза; E3- пептидаза; E4 - оксопролиназа;
E5 - γ-глутамилцистеинсинтетаза;
E6 - глутатионсинтетаза.

Аминокислоты как и белки не накапливаются и не запасаются в тканях
Промежуточный обмен аминокислот –
это совокупность превращений аминокислот в организме человека от момента поступления их в кровь до выведения из организма в виде мочевины, углекислого газа и воды
Условно промежуточный обмен делят : Общие пути обмена аминокислот
Специфические (индивидуальные ) пути превращения аминокислот
Катаболизм большинства аминокислот начинается с отщепления α-аминогруппы.
Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования и дезаминирования.
