
- •Клиническая Анестезиология книга третья
- •Содержание
- •Физиология печени и анестезия
- •Сосудистые функции печени
- •Глава 35 Анестезия при сопутствующих заболеваниях печени
- •36 Анестезия при сопутствующих эндокринных заболеваниях
- •37 Анестезия при сопутствующих нервно-мышечных заболеваниях
- •38 Анестезия при офтальмологических операциях
- •39 Анестезия при оториноларингологических операциях
- •40 Анестезия при ортопедических операциях
- •Сердечный выброс
- •41 Анестезия при травме
- •42 Беременность, плод и анестезия
- •43 Анестезия в акушерстве
- •1. Интраспинальное введение опиоидов
- •2. Интраспинальное введение местных анестетиков
- •3. Интраспинальное введение местных анестетиков в сочетании с опиоидами
- •1. Спинномозговая анестезия
- •2. Эпидуральная анестезия
- •3. Комбинированная спинально-эпидуральная анестезия
- •1. Кардиотокография (мониторинг сердечного ритма плода)
- •2. Исследование крови, взятой из кожи головки плода
- •3. Лечение внутриутробной гипоксии
- •1. Общие принципы
- •2. Примесь мекония в околоплодных водах
- •3. Асфиксия новорожденного
- •44 Детская анестезиология
- •45 Анестезия у пожилых
- •46Анестезия при амбулаторных вмешательствах
- •47 Осложнения анестезии и профессиональные вредности в анестезиологии
- •1. Длительное воздействие ингаляционных анестетиков
- •2. Инфекционные заболевания
- •3. Злоупотребление лекарственными препаратами
- •4. Рентгеновское облучение
- •48 Сердечно-легочная реанимация
- •49 Ранний послеоперационный период
- •50 Интенсивная терапия
- •1. Методы доставки кислорода
- •2. Осложнения кислородотерапии
- •1. Аппараты ивл, обеспечивающие положительное давление в дыхательных путях
- •2. Некоторые аспекты ивл
- •3. Перевод с ивл на самостоятельное дыхание
- •1. Кардиогенный отек легких
- •2. Некардиогенный отек легких и респираторный дистресс-синдром взрослых
- •(Концентрация креатинина в моче/Концентрация креатинина в плазме)
- •Дж. Эдвард Морган-мл. Мэгид с. Михаил
- •Isbn 5-95180023-4
41 Анестезия при травме
В США травма — это первая по частоте причина смерти в возрастной группе от 1 до 35 лет. Травма является причиной каждой третьей госпитализации в США. Летальность от травмы имеет следующую структуру: в половине случаев смерть наступает немедленно, в 30% случаев — в течение нескольких часов после травмы (концепция "золотого часа"). Поскольку многим пострадавшим требуется экстренная операция, анестезиолог играет важную роль в их лечении. Часто бывает, что анестезиолог больше занимается проведением реанимационных мероприятий, нежели собственно анестезией. Многие из пострадавших являются наркоманами, носителями вирусов гепатита В, С или ВИЧ, находятся в состоянии острой интоксикации, поэтому анестезиолог должен предпринять необходимые меры защиты. В этой главе освещаются принципы первичного обследования пострадавшего в приемном отделении, а также особенности проведения анестезии при ЧМТ, травме позвоночника и спинного мозга, груди, живота и конечностей. Случай из практики посвящен анестезии при ожогах.
Первичное обследование пострадавшего в приемном отделении
Первичное обследование пострадавшего в приемном отделении можно разделить на два этапа. Первый этап аналогичен основным реанимационным мероприятиям и состоит в обеспечении дыхательных путей, восстановлении дыхания и кровообращения. У пострадавших, находящихся в критическом состоянии, реанимационные и неотложные диагностические мероприятия проводят одновременно. Принципы сердечно-легочной реанимации подробно освещаются в главе 48. Реанимация пострадавших включает два дополнительных элемента: остановку кровотечения и оказание специализированной помощи. Второй этап состоит в тщательном осмотре, на основании которого проводят необходимые дополнительные исследования.
Первый этап
Дыхательные пути
У пострадавших необходимо исключить травму шейного отдела позвоночника, даже если нет видимых повреждений выше уровня ключиц. Чтобы не усугублять возможного повреждения шейного отдела позвоночника, для поддержания проходимости дыхательных путей следует выдвинуть нижнюю челюсть вперед и не прибегать к запрокидыва-нию головы. Для поддержания проходимости дыхательных путей можно использовать также ро-то- или носоглоточный воздуховод. Чтобы исключить травму шейного отдела позвоночника, проводят рентгенографию шейных позвонков в боковой проекции, а также в положении пловца (для визуализации нижних шейных позвонков одну руку поднимают над головой, оттягивая назад, и делают снимок в косой проекции через подмышечную впадину). Хотя с помощью этого рентгенологического исследования можно выявить 80-90% переломов, только KT позволяет достоверно исключить серьезное повреждение шейного отдела позвоночника. Если больной находится в сознании, не жалуется на боль в шее и пальпация шеи безболезненна, то травма шейного отдела позвоночника маловероятна.
Хотя выдвижения нижней челюсти вперед может быть достаточно для восстановления проходимости дыхательных путей, нарушенной вследствие угнетения сознания (рис. 48-1), тяжелая травма всегда сопряжена с высоким риском аспирации и, соответственно, всегда служит показанием к интубации трахеи или трахеостомии. Чтобы защитить шейный отдел позвоночника и спинного мозга при ларингоскопии, необходимо (1) отказаться от за-прокидывания головы и избыточной осевой трак-ции и (2) попытаться стабилизировать шейные позвонки с помощью мешочков с песком, воротниковой шины или фиксации головы налобной лентой.
К сожалению, исследования показали, что, несмотря на вышеперечисленные методы стабилизации, при масочной ИВЛ и прямой ларингоскопии сохраняются движения в шейном отделе позвоночника, особенно C1 и C2. Следовательно, при подозрении на травму шейного отдела позвоночника и сохранном самостоятельном дыхании целесообразно проводить назотрахеальную интубацию вслепую без ларингоскопа. На выбор методики влияет еще и персональный опыт врача: следует учитывать, что большинство анестезиологов лучше владеет орот-рахеальной методикой. Оротрахеальная интубация показана у больных с апноэ, нуждающихся в немедленной интубации. Кроме того, назотрахеальная интубация противопоказана при переломах костей лица и основания черепа. Если на этапе добольнич-ной помощи был введен пищеводный обтуратор, то его во избежание регургитации нельзя удалять до установки эндотрахеальной трубки (глава 48).
Травма гортани значительно осложняет обеспечение проходимости дыхательных путей. Открытая травма гортани может сочетаться с кровотечением из крупных сосудов шеи, нарушением проходимости дыхательных путей (вследствие сдавления гематомой или отечными тканями), подкожной эмфиземой и повреждением шейного отдела позвоночника. Закрытая травма гортани менее заметна; ее можно заподозрить на основании таких симптомов, как крепитация при пальпации шеи, гематома на шее, кровохарканье, дисфагия или нарушение речи. Можно попытаться выполнить интубацию в сознании под местной анестезией тонкой эндотрахеальной трубкой (№ 6 у взрослых) с помощью прямой ларингоскопии или фибробронхоско-па, при условии, что удается визуализировать трахею. Если травма лица или шеи не позволяет инту-бировать трахею, то показана трахеостомия под местной анестезией. Острая обструкция, обусловленная травмой верхних дыхательных путей, может потребовать экстренной крикотиреотомии (см. Случай из практики, глава 5).
Дыхание
Большинство пострадавших с тяжелыми травмами нуждается во вспомогательной или принудительной ИВЛ. Адекватную вентиляцию сразу после интубации и во время транспортировки можно обеспечить с помощью реанимационного дыхательного мешка с нереверсивным клапаном. Пока неизвестны результаты анализа ГАК, следует проводить ИВЛ дыхательной смесью с FiO2 100%. Если больного доставили в операционную с установленной интубационной трубкой, то необходимо удостовериться в ее правильном положении. При ЧМТ может возникать необходимость в проведении ИВЛ в режиме умеренной гипервентиляции, что позволяет уменьшить ВЧД. Нарушение вентиляции может быть обусловлено пневмотораксом, окончатым переломом ребер, обтурацией интубационной трубки, а также прямым повреждением легкого.
Кровообращение и инфузионная терапия
А. Кровотечение: Шок — это состояние, которое характеризуется резким снижением перфузии органов. Существует множество причин шока (табл. 41-1). Шок при травме чаще всего обусловлен гиповолемией. Клинические проявления кровотечения зависят от объема кровопотери и могут колебаться от относительно легких (тахикардия, замедленное наполнение капилляров после надавливания, снижение пульсового давления) до очень тяжелых (артериальная гипотония, тахипноэ, нарушения сознания; табл. 41-2). При остром кровотечении гематокрит и уровень гемоглобина в крови не являются точными индикаторами объема кровопотери. Раздражение периферических соматических нервов и массивная травма тканей усугубляют снижение сердечного выброса и ударного объема, характерное для гиповолемического шока. Нестабильность гемодинамики требует инвазивного мониторинга АД. При выраженной гиповолемии ИВЛ может приводить к почти полному исчезновению пульсовой кривой в фазу аппаратного вдоха. Четко доказано, что чем ниже АД при поступлении больного в приемное отделение и в операционную, тем выше летальность.
Для остановки наружного кровотечения следует наложить давящую повязку. Внутреннее кровотечение (внутригрудное, внутрибрюшное, забрю-шинное, при переломах длинных трубчатых костей) бывает трудно диагностировать и остановить. При повреждениях ног, таза и живота, сопровождающихся большой кровопотерей, эффективен пневматический противошоковый костюм: он позволяет остановить кровотечение, увеличить ОПСС, усилить кровоток в сердце и миокарде, а также осуществить иммобилизацию при переломах таза и длинных трубчатых костей. Противопоказанием к применению пневматического противошо-кового костюма является неостановленное кровотечение выше уровня его наложения (например, внутригрудное).
Основой лечения геморрагического шока является инфузионная терапия. В любые хорошо визуали-зируемые периферические вены устанавливают несколько коротких (3,75-5 см) катетеров большого диаметра (14-16G, что соответствует 7F). Если нельзя исключить повреждение полой вены или пе-
ТАБЛИЦА 41 -1. Классификация шока
|
Гиповолемический шок |
Кардиогенный шок |
|
Кровопотеря (геморрагический шок) |
Аритмии |
|
Наружное кровотечение |
Тахиаритмии |
|
Травма |
Брадиаритмии |
|
Кровотечение из ЖКТ |
Снижение насосной функции сердца (в результате инфаркта миокарда или других кардиомиопатий) |
|
Внутреннее кровотечение |
Острая дисфункция клапанов сердца (особенно недостаточность) |
|
Гематома |
Разрыв межжелудочковой перегородки или наружной стенки желудочка |
|
Гемоторакс или гемоперитонеум |
Обструктивный шок |
|
Потеря плазмы |
Напряженный пневмоторакс |
|
Ожоги |
Заболевания перикарда (тампонада сердца, кон- |
|
Эксфолиативный дерматит |
стриктивный перикардит) |
|
Потери жидкости и электролитов |
Заболевания сосудов легких (массивная эмболия |
|
Наружные потери |
легочной артерии, легочная гипертензия) |
|
Рвота |
Опухоль сердца (миксома предсердия) |
|
Диарея |
Тромбоз ушка левого предсердия |
|
Повышенное потоотделение |
Аортальный стеноз, митральный стеноз |
|
Гиперосмолярные состояния (диабетический кетоацидоз, гиперосмолярная некетоновая кома) |
Распределительный шок |
|
Внутренние потери |
Септический шок |
|
Панкреатит |
Анафилактический шок |
|
Асцит |
Нейрогенный шок |
|
Кишечная непроходимость |
Применение вазодилататоров |
|
|
Острая надпочечниковая недостаточность |
Воспроизведено с изменениями, из Но MT, Saunders CE: Current Emergency Diagnosis & Treatment, 3rd ed. Appleton & Lange.1990.
чени, то необходимо катетеризировать вены из системы обеих полых вен, чтобы не лишиться венозного доступа при необходимости наложения зажима на одну из полых вен. Хотя катетеризация центральной вены позволяет получить ценную информацию о состоянии ОЦК, она занимает много времени и сопряжена с риском опасных для жизни осложнений (например, пневмоторакс). Для начального этапа инфузионной терапии достаточно катетеризировать периферические вены.
Массивная кровопотеря приводит к снижению ОЦК. Компенсаторная реакция состоит в перемещении интерстициальной жидкости в сосудистое русло. Кроме того, жидкость из интерстициального пространства также перемещается внутрь клеток: гипоксия снижает содержание внутриклеточного АТФ (при анаэробном гликолизе из молекулы глюкозы образуется только 2 молекулы АТФ, в то время как при аэробном — 36 молекул). Снижение содержания внутриклеточного АТФ вызывает дисфункцию Nа+-К+-зависимой АТФазы, что в свою очередь приводит к отеку клеток.
Б. Инфузионная терапия: Инфузионную терапию начинают с раствора, который имеется в наличии. Лучше всего использовать цельную кровь, совпадающую по группе и резус-фактору с кровью реципиента и проверенную на индивидуальную совместимость; следует отметить, что ее подбор занимает 45-60 мин. При необходимости можно использовать кровь, совпадающую по группе и резус-фактору с кровью реципиента, без проверки на индивидуальную совместимость; для подготовки нужно 5-10 мин. В экстренных случаях (массивное профузное кровотечение) используют эритроци-тарную массу "универсального" донора (группа О (I), резус отрицательный). Осложнения массивной гемотрансфузии обсуждаются в главе 29.
Кристаллоидные растворы дешево стоят и обычно всегда имеются в наличии. Вместе с тем большая доля кристаллоидных растворов быстро покидает сосудистое русло, поэтому объем вводимых растворов должен быть в несколько раз больше предполагаемого объема кровопотери. При переливании изотонического раствора NaCl вероятность гиперхлоремического метаболического ацидоза выше, чем при использовании раствора Рингера с лактатом. С другой стороны, в растворе Рингера с лактатом содержится кальций, поэтому его нежелательно переливать с препаратами крови, содержащими антикоагулянты. Глюкозосодержащие растворы усугубляют ишемическое повреждение мозга, поэтому в отсутствие документированной гипогликемии они противопоказаны. В экстренных случаях могут оказаться эффективными гипертониче-
ТАБЛИЦА 41-2. Классификация шока по тяжести*
|
|
Патофизиология |
Клинические проявления |
|
Легкая (потеря <20% ОЦК) |
Снижение перфузии периферических органов, способных переносить длительную ишемию (кожа, жир, мышцы и кости). рН артериальной крови нормальный |
Больной жалуется на ощущение холода. По-стуральная гипотония и тахикардия, Холодная, липкая, бледная кожа. Вены на шее спавшиеся. Концентрированная моча |
|
Умеренная (потеря 20-40% ОЦК) |
Снижение перфузии органов, способных переносить только кратковременную ишемию (печень, кишечник, почки). Метаболический ацидоз |
Жажда. Артериальная гипотония в положении на спине и тахикардия (симптомы присутствуют не всегда). Олигурия и анурия |
|
Тяжелая (потеря > 40% ОЦК) |
Снижение перфузии сердца и мозга. Выраженный метаболический ацидоз, возможен дыхательный ацидоз |
Возбуждение, спутанность сознания или оглу-шенность. Артериальная гипотония в положении на спине и тахикардия (симптомы присутствуют всегда). Частое глубокое дыхание |
Воспроизведено с изменениями из Но MT, Saunders CE:Current Emergency Diagnosis& Treatment, 3rd ed. Appleton & Lange, 1990. *Эта классификация касается в первую очередь геморрагического шока, но может употребляться и при описании других видов шока.
ские растворы (например, 7,5% NaCl), особенно если постинфузионный отек тканей опасен для жизни (например, при закрытой ЧМТ). Хотя переливание небольших объемов гипертонического раствора быстро увеличивает ОЦК за счет перемещения жидкости из интерстициального пространства в сосудистое русло, при этом значительно повышается осмоляльность плазмы, что может привести к вазодилатации и артериальной гипотонии.
Коллоидные растворы значительно дороже кри-сталлоидных, но более эффективно восстанавливают ОЦК. Вместе с тем дефицит интерстициальной жидкости, сопряженный с гиповолемическим шоком, целесообразнее устранять переливанием кри-сталлоидных растворов. Из коллоидов препаратом выбора является альбумин, потому что он не вызывает коагулопатии, в отличие от растворов гидро-ксиэтилированного крахмала и декстрана. Особенно высок риск коагулопатии при использовании растворов декстрана.
Перед переливанием все растворы необходимо подогреть. При массивных трансфузиях следует использовать специальные устройства, позволяющие согревать и быстро вводить инфузионные растворы и препараты крови. Другие методы профилактики и лечения гипотермии: применение одеял с форсированной подачей теплого воздуха; подогрев дыхательной смеси. Гипотермия нарушает свертываемость (вследствие секвестрации тромбоцитов и деформации эритроцитов) и кислотно-основное состояние, а также угнетает функцию миокарда (табл. 6-7). Гипотермия смещает кривую диссоциации оксигемоглобина влево, угнетает метаболизм лактата, цитрата и некоторых анестетиков.
Критериями эффективности инфузионно-трансфузионной терапии является АД, пульсовое давление и ЧСС, а также ЦВД и диурез, позволяющие оценить восстановление перфузии жизненно-важных органов. Ишемия органов нарушает аэробный метаболизм, что приводит к накоплению лактата и метаболическому ацидозу. Переливание бикарбоната натрия, диссоциирующего на ион бикарбоната и СО, может вначале усугубить внутриклеточный ацидоз, потому что проницаемость клеточной мембраны для бикарбоната ниже, чем для СО2 При восстановлении ОЦК и перфузии органов кислотно-основное состояние нормализуется. Лактат в печени подвергается метаболическому превращению в бикарбонат, а ион H+ выделяется почками.
Артериальную гипотонию при гиповолемиче-ском шоке следует лечить путем интенсивной ин-фузионной терапии, а не с помощью вазопрессоров. Исключения из этого правила: кардиогенный шок (например, снижение насосной функции сердца в результате инфаркта миокарда); тяжелая артериальная гипотония, резистентная к инфузионной терапии; остановка кровообращения. Некоторые врачи считают, что инфузия низких доз дофамина (2 мкг/кг/мин) увеличивает почечный кровоток.
При нестабильной гемодинамике и опасных для жизни травмах регионарную анестезию обычно не применяют. Гиповолемию по возможности следует устранить до индукции общей анестезии. Если ге-модинамика нестабильна, то используют прежде всего миорелаксанты, в то время как общие анесте-тики вводят дробно в очень малых дозах под контролем АД (среднее АД должно быть не ниже 50-60 мм рт. ст.), пытаясь обеспечить хотя бы амнезию. У больных со стабильной гемодинамикой ке-тамин и закись азота, вызывая симпатическую активацию, стимулируют сердечно-сосудистую систему. У больных в состоянии шока симпатическая нервная система обычно находится в состоянии максимальной активации, так что у них кетамин и закись азота могут, наоборот, привести к угнетению кровообращения. Многие анестезиологи у этих больных вообще не применяют закись азота из-за риска усугубления латентного пневмоторакса и нежелания снижать FiO2. Очевидно, что при гипово-лемическом шоке противопоказаны лекарственные препараты с гипотензивным эффектом (например, тубокурарин). Шок значительно ускоряет прирост альвеолярной концентрации ингаляционных ане-стетиков вследствие сниженного сердечного выброса и увеличения вентиляции (глава 7). Чем выше парциальное давление анестетика в альвеолах, тем больше напряжение его в артериальной крови и тем сильнее депрессия миокарда. Сходным образом, при шоке в/в анестетики, распределяясь в сниженном ОЦК, вызывают выраженное угнетение кровообращения. Анестетики при шоке следует вводить в малых дозах и дробно.
Причины неэфффективности агрессивной ин-фузионно-трансфузионной терапии при гиповоле-мическом шоке: неостановленное кровотечение, интенсивность которого превышает скорость трансфузии; кардиогенный шок (например, при тампонаде сердца, ушибе или инфаркте миокарда); нейрогенный шок (например, при дисфункции ствола мозга, перерыве спинного мозга); септический шок (позднее осложнение); легочная недостаточность (например, при пневмо- или гемотораксе); тяжелый ацидоз; гипотермия.
Второй этап
На втором этапе больного обследуют, что называется, с головы до пят и при необходимости проводят дополнительные исследования (например, рентгенографическое, лабораторное и т.д.). Неврологическое исследование включает оценку сознания, состояния зрачков, двигательной функции и чувствительности. Фиксированные расширенные зрачки не являются безусловным признаком смерти мозга. Больного раздевают и внимательно осматривают все его тело. При обследовании грудной клетки и органов грудной полости исключают переломы ребер и грудины. Парадоксальное дыхание может свидетельствовать об окончатом переломе ребер (множественные двойные или двусторонние переломы ребер с образованием "реберного клапана"). Ослабленное дыхание может быть признаком пневмоторакса, который является показанием к дренированию плевральной полости. Глухие тоны сердца, уменьшение пульсового давления и набухание вен шеи указывают на тампонаду сердца, требующую немедленной пункции перикарда. Даже если клиническое обследование не выявило этих повреждений и состояний, полностью их исключить нельзя. Исследование брюшной полости влючает осмотр, аускультацию и пальпацию живота. Диагностический перитонеальный лаваж позволяет выявить внутрибрюшное кровотечение, но чувствительность этого метода < 90%. Исследование конечностей позволяет выявить переломы и вывихи, оценить пульсацию артерий.
Анестезия при отдельных травмах
ЧМТ и травма спинного мозга
Любое нарушение сознания у пострадавшего следует считать симптомом ЧМТ (глава 26). Для оценки уровня сознания в динамике используют шкалу комы Глазго (табл. 26-1). Другие симптомы ЧМТ включают беспокойство, судороги и нарушения функции черепных нервов (например, отсутствие реакции зрачков на свет). Классическая триада Кушинга (артериальная гипертония, брадикардия и нарушение дыхания) является поздним и недостоверным признаком, возникающим непосредственно перед вклинением мозга. Изолированная ЧМТ редко вызывает артериальную гипотонию. При подозрении на ЧМТ в премедикацию нельзя включать лекарственные препараты, влияющие на сознание (например, анальгетики и седативные) или затрудняющие неврологическое исследование (например, холиноблокаторы, вызывающие мид-риаз).
ЧМТ часто приводит к повышению ВЧД вследствие внутричерепной гематомы или отека мозга. Для снижения ВЧД ограничивают прием жидкости (если только ЧМТ не сопутствует гиповолемический шок), применяют диуретики (например, маннитол 0,5 г/кг), барбитураты, проводят ИВЛ в условиях умеренной гипокапнии (РаСО2 26-30 мм рт. ст.). Необходимо подчеркнуть, что каждый из этих методов лечения применим не во всех случаях ЧМТ и имеет свои противопоказания. Для проведения ИВЛ и профилактики аспирации необходима интубация трахеи. Чтобы снизить выраженность подъема АД и ЧСС при интубации трахеи, вводят лидокаин или фентанил в/в. Интубация трахеи при сохраненном сознании приводит к резкому подъему ВЧД. При переломе основания черепа установка назотрахе-альной трубки или назогастрального зонда сопряжена с риском перфорации решетчатой пластинки, что может привести к контаминации ЦСЖ. Придание головному концу кровати (или операционному столу) возвышенного положения улучшает венозный отток и уменьшает ВЧД. Противопоказаны анестетики, повышающие ВЧД (например, кета-мин). Гипергликемия повышает риск неврологических осложнений, поэтому ее необходимо активно выявлять (измерением глюкозы крови в динамике) и агрессивно лечить инсулином. Умеренная гипотермия противодействует ишемическому повреждению мозга и поэтому в некоторых случаях применяется при ЧMT.
ЧMT приводит к нарушению ауторегуляции мозгового кровотока, поэтому артериальная гипертония может усугубить отек мозга и повысить ВЧД. С другой стороны, эпизоды артериальной гипотонии могут вызвать локальную ишемию мозга. Церебральное перфузионное давление (ЦПД) следует поддерживать выше 60 мм рт. cm (ЦПД = АДср -ЦВДили АДср - ВЧД). Умеренная гипокапния может улучшить ауторегуляцию мозгового кровотока.
Тяжелая ЧМТ сопряжена с высоким риском аспирации, ателектазов, а также прямого нейрогенно-го воздействия на легочные сосуды. Эти осложнения служат причиной внутрилегочного шунтирования и нарушения вентиляционно-перфузионных отношений, поэтому при тяжелой ЧМТ часто развивается гипоксия. Увеличенное ВЧД вызывает повышение симпатического тонуса, что может привести к отеку легких.
Выраженность нарушений после травмы спинного мозга определяется уровнем его повреждения. Следует принять необходимые меры предосторожности, чтобы не допустить дальнейшего повреждения спинного мозга при транспортировке и интубации трахеи. Повреждение верхних шейных сегментов (СЗ-С5) может нарушить функцию диафрагмальных нервов и привести к апноэ. Утрата функции межреберных мышц снижает легочный резерв и делает невозможным кашель. Повреждение верхних грудных сегментов спинного мозга (Т1-Т4) устраняет влияния симпатической нервной системы на сердце, что приводит к брадикар-дии. Острый перерыв спинного мозга может вызвать спиналъный шок — состояние, которое характеризуется утратой симпатического тонуса ниже уровня повреждения, что приводит к вазодилата-ции резистивных и емкостных сосудов, вызывая артериальную гипотонию, брадикардию, арефлексию и атонию ЖКТ. Симптомом повреждения спинного мозга является расширение вен ног. Лечение артериальной гипотонии заключается в агрессивной инфузионной терапии. Следует отметить, что объем и скорость инфузии не должны быть чрезмерными, потому что иначе после разрешения острой фазы повреждения спинного мозга может развиться отек легких. В первые 48 ч после повреждения спинного мозга сукцинилхолин не вызывает осложнений, но в более поздние сроки может вызвать опасную для жизни гиперкалиемию. Применение высоких доз метилпреднизолона улучшает неврологический прогноз после травмы спинного мозга. Вегетативная гиперрефлексия, возникающая при поражении спинного мозга выше уровня Т5, развивается через 1-3 недели после травмы и, следовательно, не имеет отношения к ведению больного в остром периоде.
Травма груди
Травма груди может вызвать тяжелые нарушения функции сердца и легких, приводя к развитию кардиогенного шока или гипоксии. Пневмоторакс представляет собой скопление воздуха между париетальной и висцеральной плеврой. Коллапс легочной ткани на пораженной стороне приводит к тяжелым нарушениям вентиляционно-перфузионных отношений и гипоксии. При перкуссии над пораженной стороной грудной клетки определяется тимпанический звук, при аускультации дыхательные шумы резко ослаблены или отсутствуют, а при рентгеноскопии выявляется коллапс легкого. Закись азота может увеличить объем пневмоторакса и поэтому противопоказана. Лечение состоит в установке плеврального дренажа в четвертом или пятом межреберье по средней подмышечной линии. Поступление воздуха по плевральному дренажу, не прекращающееся в течение долгого времени, может указывать на повреждение крупного бронха.
Если во время вдоха воздух поступает в плевральную полость, а во время выдоха мягкие ткани грудной стенки или паренхима легкого перекрывают раневой канал и препятствуют выходу воздуха наружу, пневмоторакс называется клапанным. В этом случае объем воздуха и давление в плевральной полости постепенно нарастают и возникает напряженный пневмоторакс. Пораженное легкое полностью коллабируется, средостение и трахея смещаются в противоположную сторону. ИВЛ может привести к трансформации обычного пневмоторакса в напряженный. При напряженном пневмотораксе снижается венозный возврат и нарушается вентиляция здорового легкого. Признаки напряженного пневмоторакса включают ослабление или отсутствие дыхательных шумов и громкий тимпанический звук при перкуссии на стороне пораженного легкого, смещение трахеи в сторону здорового легкого, набухание вен шеи. Прежде всего необходимо экстренно перевести напряженный пневмоторакс в открытый, для чего плевральную полость пунктируют во втором межреберье по средней ключичной линии катетером на игле (калибр 14G, длина 3-6 см). Отсосав воздух, катетер оставляют открытым, а затем устанавливают плевральный дренаж по вышеописанной методике. После того как плевральный дренаж начинает функционировать, катетер удаляют.
Множественные двойные или двусторонние переломы ребер могут привести к образованию "реберного клапана" (синоним: окончатый перелом ребер), чреватого тяжелыми нарушениями дыхания. Сопутствующий ушиб легкого или гемоторакс усугубляют гипоксию. Ушиб легкого со временем приводит к утяжелению дыхательной недостаточности. Гемоторакс отличается от пневмоторакса притупленным звуком при перкуссии на стороне, где ослаблены или отсутствуют дыхательные шумы.
Тампонада сердца является опасным для жизни осложнением травмы груди, ее необходимо своевременно распознать. Признаками тампонады сердца являются триада Бека (набухание шейных вен, артериальная гипотония и глухость сердечных тонов) и парадоксальный пульс (снижение АД при самостоятельном вдохе более чем на 10 мм рт. ст.). При угрозе остановки кровообращения в качестве временной меры перед операцией проводят пункцию перикарда. Используют катетер на игле калибра 16G длиной не менее 15 см. Иглу вводят между мечевидным отростком и левой реберной дугой по направлению к углу левой лопатки под углом 45°. Появление изменений на ЭКГ во время пункции указывает на чрезмерно глубокое введение иглы. Для окончательного устранения тампонады сердца необходима торакотомия. В ходе анестезии первостепенное значение имеет обеспечение адекватной ино- и хронотропной функции сердца, а также преднагрузки. Соответственно, препаратом выбора для индукции анестезии является кетамин.
Ушиб миокарда диагностируют на основании ЭКГ-картины, имитирующей ишемию миокарда (подъем сегмента ST), повышения уровня кардиос-пецифических ферментов (MB фракция КФК) или данных ЭхоКГ. Высок риск нарушений ритма и проводимости, в том числе фибрилляции желудочков. Плановые операции следует отложить до разрешения последствий ушиба сердца. Другие возможные осложнения травмы груди: разрыв аорты, дисфункция клапанов сердца, разрыв межжелудочковой или межпредсердной перегородки, грыжа диафрагмы, разрыв пищевода.
Респираторный дистресс-синдром взрослых
(РДСВ) относится к поздним осложнениям травмы. Его причины многочисленны: сепсис, прямая травма груди, аспирация, ЧMT, жировая эмболия, массивная гемотрансфузия, кислородная интоксикация. Часто в генезе РДСВ задействовано несколько факторов. Хотя методы лечения РДСВ постоянно совершенствуются, летальность достигает 50%.
Травма живота
О травме органов брюшной полости свидетельствуют проникающие раны живота или нижних отделов груди, симптомы кишечной непроходимости и симптомы раздражения брюшины (например, напряжение мышц передней брюшной стенки, болезненность при пальпации pi перкуссии живота). Om-метим, что при скоплении несвернувшейся крови в брюшной полости, даже в большом количестве, (например, при разрыве селезенки) симптоматика может быть очень скудной. Обзорная рентгенография позволяет выявить свободный воздух в брюшной полости или забрюшинном пространстве, диагностический перитонеальный лаваж — аспириро-вать кровь. При травме живота обычно выполняют диагностическую лапаротомию. Во избежание ин-траоперационного растяжения кишечника закись азота не применяют. Назогастральный зонд позволяет предупредить растяжение желудка, но при подозрении на перелом основания черепа зонд в желудок следует устанавливать через рот. Необходимо иметь достаточный запас препаратов крови, особенно при сочетании травмы живота с переломом костей таза или забрюшинным кровотечением.
Травма конечностей
Травмы конечностей могут быть опасными для жизни из-за повреждения крупных сосудов и вторичных инфекционных осложнений. Повреждение сосудов может сопровождаться массивным кровотечением, а также угрожать жизнеспособности конечности. Например, скрытая кровопотеря при переломе бедра составляет 1500 мл, а закрытый перелом костей таза может вызвать гиповолемический шок. Несвоевременное лечение или неправильное положение больного могут усугубить смещение от-ломков и повреждение сосудисто-нервного пучка. Жировая эмболия, часто возникающая на 1-3 сутки после перелома костей таза или длинных трубчатых костей, вызывает дыхательную недостаточность, аритмии, петехии и нарушения сознания (глава 40). Диагноз жировой эмболии подтвержда-
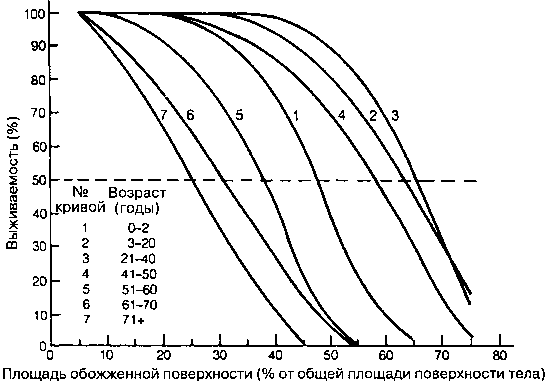
Рис. 41-1. Выживаемость при ожогах зависит от площади обожженной поверхности (выраженной в процентах от общей площади поверхности тела) и возраста. Кривые выживаемости расчитаны для семи возрастных категорий. (Воспроизведено с изменениями из Merrell SW et al: Increased survival after major thermal injury. AmJ Surg 1987; 154:623.)
ется данными лабораторных исследований: повышение уровня липазы плазмы, наличие жира в моче, тромбоцитопения.
В настоящее время технически возможно выполнить реплантацию конечностей или пальцев после травматической ампутации (глава 40). Если травматическая ампутация конечности не сопровождается другими повреждениями, то целесообразно проводить регионарную анестезию (например, блокаду плечевого сплетения), позволяющую увеличить периферический кровоток благодаря симпатической блокаде. Если выбрана общая анестезия, то нельзя допускать гипотермии и дрожи во время пробуждения, с тем чтобы обеспечить максимальный кровоток по сосудистым анастомозам.
Случай из практики: анестезия при ожогах
Мужчине 43 лет с тяжелыми термическими ожогами, полученными 7 дней назад, планируется некрэктомия и пересадка кожи в условиях общей анестезии.
Как классифицируют ожоги?
Ожоги классифицируют в зависимости от их площади и глубины. Выживаемость при ожогах зависит от площади обожженной поверхности и возраста (рис. 41 -1). У взрослых площадь обожженной поверхности принято оценивать с помощью правила девяток: голова и шея составляют 9% общей площади поверхности тела, руки — по 9%, ноги — по 18%, передняя поверхность туловища и задняя поверхность туловища — по 18%, промежность — 1% (рис. 41-2). Площадь ладони — 1%.
В США принята трехстепенная классификация ожогов по глубине поражения. Ожоги I степени: поражен только эпидермис. Ожоги II степени: эпидермис и часть дермы. Ожоги III степени: все слои кожи и подкожная клетчатка. При ожогах III степени повреждаются нервные окончания, поэтому они менее болезненны, чем ожоги II степени (или вовсе безболезненны). К тяжелым термическим ожогам относят ожоги II степени > 25% поверхности тела или ожоги III степени > 10% поверхности тела. Электрические ожоги обычно тяжелее, чем кажутся при визуальном осмотре, вследствие обширных повреждений глубоких мягких тканей. Сопутствующее поражение органов дыхания (особенно пневмония) значительно увеличивает летальность.
В чем состоит поражение органов дыхания при тяжелых ожогах?
Тяжелые ожоги могут быть причиной прямого или опосредованного поражения органов дыхания. Так, после ожога может возникнуть обструкция верхних дыхательных путей, обусловленная оте-
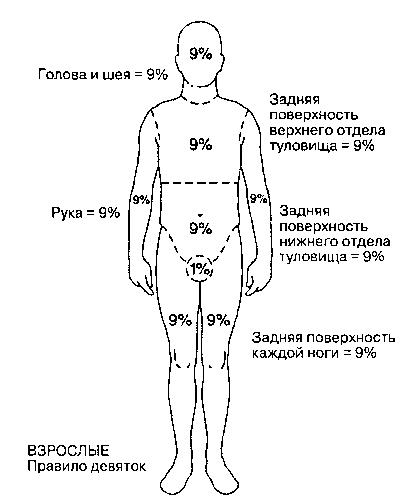
Рис. 41-2. Измерение площади обожженной поверхности (Воспроизведено с изменениями из Schroeder SA et al: Current Medical Diagnosis & Treatment 1991. Appleton &Lange,1991.)
ком их слизистой. Нижние дыхательные пути могут подвергаться прямому воздействию высокой температуры (например, при вдыхании пара), дыма и токсичных продуктов горения. Разрушение сур-фактанта приводит к ателектазу и внутрилегочно-му шунтированию. Признаки поражения легких: стридор; охриплость; ожоги лица; опаленные брови и волоски в носу; черная мокрота; копоть в ротоглотке; явные нарушений дыхания. Анамнестическим признаком поражения легких является указание на то, что ожог был получен в закрытом помещении. Очень часто поражение легких в течение нескольких часов после ожога протекает бессимптомно.
При тяжелых ожогах дыхательные осложнения могут возникать даже в отсутствие прямого поражения легких. Например, возникающее при тяжелых ожогах увеличение проницаемости сосудов микроциркуляторного русла сопряжено с высоким риском отека легких и РДСВ. Круговые ожоги груди сдавливают грудную клетку, препятствуя венти-ляции.
Вдыхание окиси углерода (угарного газа) смещает кривую диссоциации оксигемоглобина влево (препятствуя отдаче кислорода тканям) и снижает насыщение гемоглобина кислородом. PaO2 и цвет кожи при этом могут оставаться нормальными, но концентрация карбоксигемоглобина в крови увеличена (в норме COHb < 1,5% у некурящих и < 10% у курящих). В отличие лабораторных анализаторов, пульсоксиметры не позволяют выявить кар-боксигемоглобинемию (глава 6). Сродство окиси углерода к гемоглобину в 200 раз выше, чем у кислорода. При дыхании комнатным воздухом период полувыведения карбоксигемоглобина составляет 4 ч, при дыхании 100% кислородом — < 1 ч. Эффективность гипербарической оксигенации при отравлении окисью углерода четко не установлена. Вместе с тем, если барокамера доступна, то ей следует воспользоваться. Отравление HCN, выделяющегося при горении синтетических материалов, тоже нарушает транспорт кислорода (в норме уровень цианидов в крови <0,2 мкг/мл) и является показанием к гипербарической оксигенации.
Заживление ожогов сопровождается увеличением основного обмена. Это гиперметаболическое состояние проявляется увеличением потребления кислорода и образования CO2. В этот период необходимо увеличить альвеолярную вентиляцию и назначить ингаляцию кислорода.
Какие сердечно-сосудистые осложнения возникают при тяжелых ожогах?
Повышение проницаемости капилляров, возникающее не только в очаге повреждения, но и во всем микроциркуляторном русле организма, приводит к перемещению очень большого объема жидкости из плазмы в интерстициальное пространство. ОЦК значительно уменьшается, поэтому гематок-рит может возрастать даже несмотря на индуцированную ожогом деструкцию эритроцитов. Снижение ОЦК, наиболее выраженное в первые 24 ч после ожога, восполняют переливанием растворов кристаллоидов (например, раствор Рингера с лактатом, 2-4 мл х вес тела (кг) х процент обожженной поверхности тела). Сердечный выброс снижен в результате гиповолемии и депрессии миокарда (обусловленной циркулирующими в крови токсинами). Для оценки кровотока в жизненно важных органах проводят мониторинг диуреза с помощью катетера Фоли. Если диурез ниже 1 мл/кг/ч несмотря на адекватную инфузионную терапию, то показана инфузия дофамина.
Через 24-48 ч после ожога проницаемость капилляров нормализуется, и можно переливать коллоидные растворы, не опасаясь, что они тотчас покинут сосудистое русло. Реабсорбция интерстици-альной жидкости, повышение основного обмена и высокий уровень циркулирующих в крови катехо-ламинов могут привести к сердечной недостаточности с высоким сердечным выбросом. АД и ЧСС обычно повышены.
Какие электролитные нарушения возникают при ожогах?
Ожоговая деструкция тканей может вызывать гиперкалиемию, осложняющую течение острого периода. Позже, наоборот, может возникать гипо-калиемия, обусловленная потерями калия через почки и ЖКТ. Местное применение антибактериальных препаратов тоже может привести к нарушениям электролитного обмена: например, мафенид ингибирует карбоангидразу, что сопряжено с риском гиперхлоремического ацидоза. Нитрат серебра вызывает гипонатриемию, гипохлоремию и гипока-лиемию, а в редких случаях — выраженную метге-моглобинемию. Электрические ожоги сопряжены с выраженной деструкцией мышечных клеток, в результате чего возникает миоглобинурия, которая может привести к почечной недостаточности.
Какой мониторинг необходим при некрэктомии и трансплантации кожи?
Некрэктомия после обширных ожогов обычно сопровождается значительной кровопотерей. Кро-вопотеря выше, если операцию проводят через несколько дней после ожога (а не сразу), и ожог находится на той части тела, куда нельзя наложить жгут. Этим больным следует катетеризировать вены (не менее двух катетеров большого диаметра), лучевую артерию (для прямого измерения АД), а также центральную вену или легочную артерию. Если затруднен доступ к периферическим венам, то целесообразно установить в центральную вену трехпросвет-ный катетер. Если имеется возможность, то наряду с инвазивным мониторингом АД следует применять и неинвазивный, так как в ходе операций положение тела больного часто меняют, что может вызвать перебои в функционировании артериальной линии.
Электрокардиографические электроды нельзя приклеивать к обожженной поверхности, кроме того, они могут препятствовать рассечению струпа на груди. В этих случаях используют игольчатые электроды, которые фиксируют кожными швами. При дыхательной недостаточности показана пуль-соксиметрия, если имеется подходящее место для установки датчика.
Теплопотери через обожженную поверхность могут быть очень велики, поэтому необходим мониторинг температуры. Для профилактики гипотермии применяют следующие методы: использование одеял с форсированной подачей теплого воздуха и обогревательных ламп; повышение температуры воздуха в операционной; увлажнение дыхательной смеси; согревание инфузионных растворов.
Каковы особенности интубации у больных с ожогами?
Если ожоги сопровождались поражением дыхательных путей, то трахею часто интубируют еще до операции. Показания к ранней интубации: гипоксия, не устраняемая ингаляцией кислорода через лицевую маску; отек верхних дыхательных путей, сопряженный с риском обструкции; обильная мокрота. В сомнительных случаях, а также в ситуациях, когда обеспечение проходимости дыхательных путей затруднено (например, при транспортировке), необходимо интубировать трахею до того, как разовьется отек дыхательных путей и интубация станет технически сложной. Это особенно важно сделать перед транспортировкой в другую больницу. Прогрессирующая обструкция дыхательных путей и выраженные контрактуры лицевых мышц служат показанием к интубации при сохраненном сознании с помощью фиброскопа. Следует предпринять необходимые меры для профилактики рвоты и аспирации, особенно в острой фазе ожога, во время эпизодов сепсиса, а также при использовании больших доз опиоидов. У больных с ожогами трахеостомия сопряжена с высоким риском легочного сепсиса.
Как влияют ожоги на фармакологию анестетиков?
Сукцинилхолин противопоказан при ожогах, потому что может привести к остановке кровообращения из-за резкого повышения уровня калия в крови. При ожогах сукцинилхолин вызывает продолжительную мышечную деполяризацию, что обусловлено увеличением числа внесинаптических холинорецепторов; отметим, что эта реакция наблюдалась даже при площади ожогов < 10% поверхности тела. Напротив, потребность в недеполяризующих миорелаксантах при ожогах значительно возрастает. Эта резистентность обусловлена нарушением связывания препаратов с белками плазмы и увеличением числа внесинаптических холинорецепторов, при взаимодействии которых с недеполяризующими миорелаксантами нервно-мышечная блокада не возникает.
Ингаляционные анестетики потенциируют депрессию миокарда, так что их целесообразно использовать после разрешения острого периода. Если для уменьшения интраоперационной крово-потери предполагается использование пропитанных адреналином салфеток, то во избежание аритмий следует отказаться от галотана.
Список литературы
Advanced Trauma Life Support Course for Physicians. American College of Surgeons, 1993. Fitch W, Barker J: Head Injury and the Anesthetist. Elsevier, 1985. Рассмотрены все аспекты ведения больных с ЧMT, в том числе анестезиологические.
Hastings RH,Marks JD: Airway management for trauma patients with potential cervical spine injuries. AnesthAnalgl991;73:471.
Jaffe D, Wesson D: Emergency management of blunt trauma in children. N Engl J Med 1991: 324: 1477.
Lam AM (editor): Anesthetic Management of Acute Head Injury. McGraw-Hill, 1994.
Lamb JD: Anesthetic considerations for major thermal injury. Can Anaesth Soc J 1985;32:84.
Martyn JA ( editor): Acute Management of the Burned Patient. Saunders, 1990.
Skerman JH: Anesthetic management of the pregnant trauma patient. Seminars in Anesthesia 1989;8:353.
Stene JK, Grande CM(editors): Trauma Anesthesia. Williams &Wilkins, 1991. Рассмотрены все аспекты анестезии при травмах.
Welch GW: Anesthesia for the patient with thermal injury. Curr Rev Clin Anesth 1991; 12:45.
Wood PR,Lawler PGP: Managing the airway in cervical spine injury: A review of the advanced trauma life support protocol. Anaesthesia 1992;47:792.
