
- •Биологические мембраны
- •Роль мембран в метаболизме и их разнообразие
- •Строение и состав мембран
- •Типы движений липидных молекул в бислое мембран
- •Белки мембран
- •Особенности строения
- •Перенос веществ через мембраны
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •1. Эндоцитоз
- •2. Экзоцитоз
- •Трансмембранная передача сигнала
- •1. Рецепторы адреналина — адренорецепторы
- •2. Рецепторы с тирозинкиназной активностью
- •Активация рецептора инсулина — тирозиновой протеинкиназы
- •3. Рецепторы с гуанлатциклазной активностью
1. Эндоцитоз
Перенос вещества из среды в клетку вместе с частью плазматической мембраны называют «эндоцитоз». Путём эндоцитоза (фагоцитоза) клетки могут поглощать большие частицы, такие как вирусы, бактерии или обломки клеток. Захват больших частиц осуществляется в основном специализированными клетками — фагоцитами.
Поглощение жидкости и растворённых в ней веществ с помощью небольших пузырьков называют «пиноцитоз». Усвоение веществ механизмом эндоцитоза (пиноцитоза) характерно для всех клеток.
Цикл эндоцитоза начинается в определённых участках плазматической мембраны, называемых «окаймлённые ямки». На долю окаймлённых ямок приходится всего 1-2% общей площади мембраны. Белок клатрин образует решётчатые структуры, связанные с углублениями на поверхности плазматической мембраны.
Окаймлённые ямки втягиваются в клетку, сужаются у основания, отделяются от мембраны, образуя окаймлённые пузырьки (пиноцитозные пузырьки). Время жизни окаймлённых ямок невелико, они формируются в течение минуты, затем совершают цикл эндоцитоза.
Вещества в составе пиноцитозных пузырьков не смешиваются с другими макромолекулами клетки. Они заканчивают свой путь в лизосомах, а мембранные компоненты пузырьков, содержащие клатрин, возвращаются в плазматическую мембрану.
Эндоцитоз, происходящий с участием рецепторов, встроенных в окаймлённые ямки, позволяет клеткам поглощать специфические вещества. Макромолекулы или частицы связываются рецепторами и накапливаются в окаймлённой ямке. Затем следует погружение в клетку и отделение эндоцитозного пузырька, в составе которого находится поглощённое вещество, мембранные компоненты окаймлённой ямки и рецептор. В разные окаймлённые ямки могут быть встроены разные рецепторы.
Примером рецептор-зависимого эндоцитоза может служить поступление в клетку холесте-рола в составе липопротеинов низкой плотности (ЛПНП).
2. Экзоцитоз
Макромолекулы, например белки плазмы крови, пептидные гормоны, пищеварительные ферменты, белки внеклеточного матрикса, липопротеиновые комплексы, синтезируются в клетках и затем секретируются в межклеточное пространство или кровь. Но мембрана непроницаема для таких макромолекул или комплексов, их секреция происходит путём экзоцитоза. Особенность экзоцитоза в том, что секретируемые вещества локализуются в пузырьках и не смешиваются с другими макромолекулами или органеллами клетки. В ходе экзоцитоза содержимое секреторных пузырьков выделяется во внеклеточное пространство, когда они сливаются с плазматической мембраной.
В организме имеются как регулируемый, так и нерегулируемый пути экзоцитоза. Нерегулируемая секреция характеризуется непрерывным синтезом секретируемых белков, упаковкой их в транспортные пузырьки в аппарате Гольджи и переносом к плазматической мембране длясекреции. Примером может служить синтез и секреция коллагена фибробластами для формирования межклеточного матрикса.
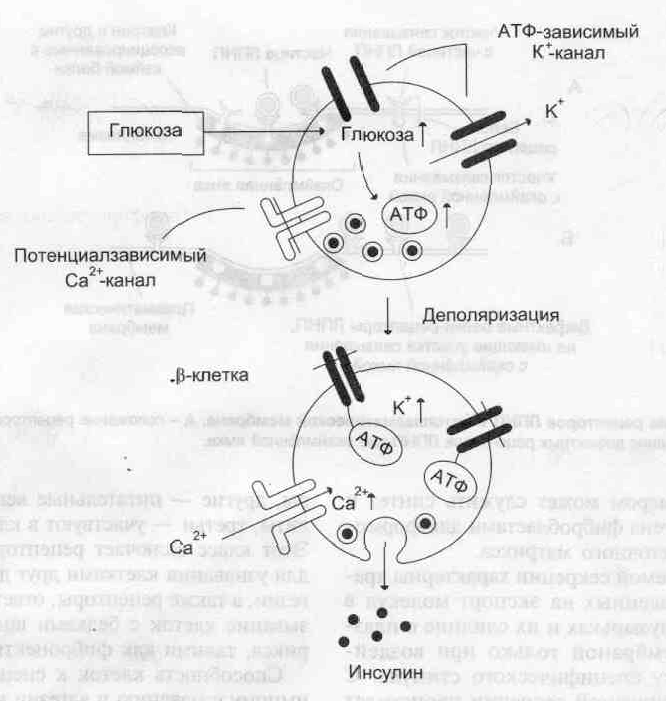
Регуляция
секреции инсулина.
Повышение концентрации глюкозы приводит
к увеличению соотношения АТФ/АДФ в
β-клетке,
закрытию АТФ-зависимых калиевых каналов,
деполяризации, раскрытию потенциалзависимых
кальциевых каналов, Повышение концентрации
ионов калия и кальция в β-кпетке
инициирует слияние секреторных пузырьков
(инсулинсодержащих гранул) с мембраной
и выделение содержимого пузырьков
(инсулина] из клетки.
УЧАСТИЕ МЕМБРАН В МЕЖКЛЕТОЧНЫХ ВЗАИМОДЕЙСТВИЯХ
В плазматической мембране эукариотических клеток содержится множество специализированных рецепторов, которые, взаимодействуя с лигандами, вызывают специфические клеточные ответы. Одни рецепторы связывают сигнальные молекулы — гормоны, нейромедиаторы, другие — питательные вещества и метаболиты, третьи — участвуют в клеточной адгезии. Этот класс включает рецепторы, необходимые для узнавания клетками друг друга и для их адгезии, а также рецепторы, ответственные за связывание клеток с белками внеклеточного матрикса, такими как фибронектин или коллаген.
Способность клеток к специфическому взаимному узнаванию и адгезии важна для эмбрионального развития. У взрослого человека адгезивные взаимодействия «клетка—клетка» и «клетка—матрикс» продолжают оставаться существенными для поддержания стабильности тканей. В многочисленном семействе рецепторов клеточной адгезии наиболее изучены интегрины, селектины и кадгерины.
Интегрины — обширное суперсемейство гомологичных рецепторов клеточной поверхности для молекул межклеточного матрикса, таких как коллаген, фибронектин, ламинин и др. Являясь трансмембранными белками, они взаимодействуют как с внеклеточными молекулами, так и с внутриклеточными белками цитоскелета. Благодаря этому интегрины участвуют в передаче информации из внеклеточной среды в клетку, определяя таким образом направление её дифференцировки, форму, митотическую активность, способность к миграции. Передача информации может идти и в обратном направлении — от внутриклеточных белков через рецептор во внеклеточный матрикс.
Идентифицировано примерно 20 разных членов семейства рецепторов в разных типах клеток.
Интегрины — гетеродимеры, а каждая субъединица (α, β) содержит один трансмембранный домен.
Индивидуальные интегрины строго специфичны. Центр связывания интегринов образован внеклеточными доменами α- и β-субъединиц. Интегрины узнают и связываются с белками, содержащими определённую аминокислотную последовательность -Арг-Гли-Асп-, присутствующую в ряде матриксных белков (фибронектин, фибриноген, ламинин, коллаген I типа и другие). Эффект связывания усиливается в присутствии ионов Са2+ и Mg2+.
Кадгерины и селектины — семейства трансмембранных Са2+-зависимых гликопротеинов, участвующих в межклеточной адгезии.
Кадгерины разных тканей очень схожи, гомологичные аминокислотные последовательности составляют 50—60%. Каждый рецептор имеет один трансмембранный домен. В отсутствие Са2+ конформация кадгеринов меняется, и они становятся доступными для протеолитических ферментов, которые их расщепляют. Наиболее полно охарактеризованы 3 группы кадгериновых рецепторов:
• Е-кадгерин находится на поверхности многих клеток эпителиальных и эмбриональных тканей;
• N-кадгерин локализован на поверхности нервных клеток, клеток сердца и хрусталика;
• Р-кадгерин расположен на клетках плаценты и эпидермиса.
Кадгерины играют важную роль при начальной межклеточной адгезии, на стадиях морфо-и органогенеза. Они обеспечивают структурную целостность и полярность тканей, особенно эпителиального монослоя.
В семействе селектиновых рецепторов наиболее хорошо изучены три белка: L-селектин,
Р-селектин и Е-селектин. Внеклеточная часть селектинов состоит из 3 доменов: первый домен представлен 2—9 блоками повторяющихся аминокислотных остатков (комплементрегуляторный белок), второй — домен эпидермального фактора роста (ЭФР), третий — N-концевой лектиновый домен. Селектины L, Р, Е различаются количеством блоков в комплементрегуляторном белке. Лектины — семейство белков, специфически взаимодействующих с определёнными последовательностями углеводных остатков в составе гликопротеинов, протеогликанов и гликолипидов внеклеточного матрикса.
Углеводные структуры — поливалентные линкерные молекулы, которые могут быть суль-фатированы, фукозилированы и сиализированы. Связывание лигандов с рецепторами происходит в области N-концевого лектинового домена.
